- 2021-04-25 发布 |
- 37.5 KB |
- 31页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学一轮复习学案课件(人教版):第9章 认识有机物 烃第2节 脂肪烃
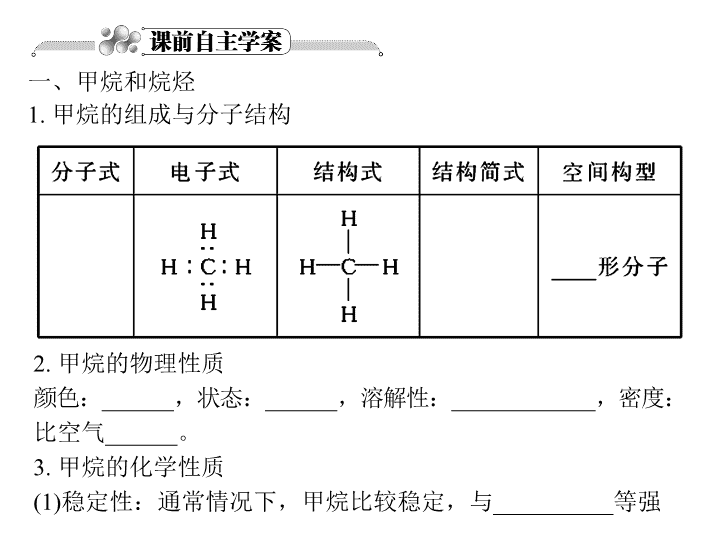
第二节 脂肪烃 一、甲烷和烷烃 1. 甲烷的组成与分子结构 2. 甲烷的物理性质 颜色:______,状态:______,溶解性:____________,密度: 比空气______。 3. 甲烷的化学性质 (1)稳定性:通常情况下,甲烷比较稳定,与__________等强 氧化剂不反应,与______、______也不反应。 (2)氧化反应:甲烷燃烧的化学方程式为__________________。 (3)取代反应:甲烷在光照条件下与Cl2发生反应: 【温馨提示】甲烷与Cl2反应所得生成物是5种物质的混合物 (HCl和4种卤代烃),其中HCl的物质的量最多,4种卤代烃中只 有CH3Cl为气态。 4. 烷烃 (1)通式:______________。 (2)结构特点:碳与氢、碳与碳之间以______相连,其中的碳原 子皆为______(填“饱和”或“不饱和”)碳原子。 (3)物理性质:________溶于水,密度比水小,通常条件下含 ______个碳原子的烃为气体。 (4)化学性质 ①稳定性:通常与________、________、________等强氧化剂 不反应。 ②可燃性:完全燃烧的通式为_______________________。 ③取代反应:与卤素单质在光照条件下发生取代反应。 二、乙烯 1. 乙烯的组成与分子结构 2. 乙烯的物理性质 颜色:________,状态:______,溶解性:__________。 3. 乙烯的化学性质 (1)氧化反应 ①燃烧的化学方程式:__________________________。 ②能使酸性高锰酸钾溶液______。 (2)加成反应 ①与Br2:________________________________________。 ②与HCl:______________________________________。 ③与H2O:____________________________________。 (3)加聚反应:____________________________________。 想一想 乙烯可以使酸性高锰酸钾溶液和溴水褪色,原理相同吗? 【答案】不同,前者发生氧化反应,后者发生加成反应。 4. 乙烯的用途 (1)乙烯的产量是用来衡量一个国家石油化工水平的标志。 (2)乙烯是一种植物生长调节剂,可作水果的催熟剂。 5. 乙烯的实验室制法 反应原理:______________________________。 【温馨提示】酸性KMnO4溶液可以用于区分烷烃和烯烃,但 不能用于除烷烃中的烯烃。一般用溴水除去烷烃中的烯烃。 三、乙炔 1. 乙炔的组成与分子结构 分子式 电子式 结构式 结构简式 空间构型 C2H2 CHC—H HCCH ______形分子 2. 乙炔的物理性质 纯净的乙炔是______色、______味的气体,______溶于水, ______溶于有机溶剂,俗名________,密度比空气略______。 3. 乙炔的化学性质 (1)氧化反应 ①能使酸性KMnO4溶液______。 ②可燃性:化学方程式为________________(火焰______并伴有浓 烟)。 点燃乙炔前应先______________。氧炔焰温度很高,可用来 ______或______金属。 (2)加成反应 ①乙炔与少量溴水、足量溴水反应的化学方程式分别为: ________________________,__________________________; ②乙炔与HCl反应的化学方程式为__________________。 4. 实验室制法 (1)药品:碳化钙(CaC2),又叫电石。 (2)反应原理为:________________________。 【想一想】 如何鉴别甲烷和乙炔? 烯烃 炔烃 组成通式 CnH2n(n≥2) CnH2n-2(n≥2) 结构特点 含有__________,碳 原子连接成链状 含有__________,碳 原子连接成链状 四、烯烃和炔烃 【答案】①燃烧时有明亮的浓烟的是乙炔。②使酸性KMnO4溶 液褪色的是乙炔。③使溴水褪色的是乙炔。 物理性质 随着分子里碳原子数的 增多而呈现规律性的 变化,沸点逐渐 ________,相对密度 逐渐________。 化学性质 ①氧化反应都能使酸性 KMnO4溶液________, 都具有可燃性; ②都能发生______ 反应,如使溴水 褪色; ③都能发生______ 反应,生成高分 子化合物。 【例1】 (2010高考·全国卷Ⅱ,11)在一定的温度、压强下, 向100 mL CH4和Ar的混合气体中通入400 mL O2,点燃使其完 全反应,最后在相同条件下得到干燥气体460 mL,则反应前混 合气体中CH4和Ar的物质的量之比为( ) A. 1∶ 4 B. 1∶ 3 C. 1∶ 2 D. 1∶ 1 1. 燃烧前后气体体积变化规律 (1)若生成的水为气态时,根据反应式: 当y=4时,ΔV=0;当y>4时,ΔV>0;当y<4时,ΔV<0。 (2)若生成的水为液态时,则不论气态烃所含氢原子数多少,总 是ΔV<0 。 2. 完全燃烧时的耗氧量规律 (1)等物质的量的烃完全燃烧时,其耗氧量的大小取决于(x+)的 值,其值越大,耗氧量越多。 (2)等质量的烃完全燃烧时,其耗氧量大小取决于该烃分子中氢 的质量分数(或氢原子数与碳原子数的比值),其值越大,耗氧量 越多。 (3)最简式相同的烃,不论它们以何种比例相混合,只要总质量 一定,完全燃烧时所消耗的O2以及燃烧后生成的CO2和H2O的 量均为定值。 【知识关联】有机物燃烧的规律与有机物分子式的确定、差量 法和平均值法等方法的计算联系。 1. (2011·江苏盐城中学期中)两种气态烃组成的混合气体0.1 mol, 完全燃烧得0.16 mol CO2和3.6 g水,下列说法正确的是( ) A. 混合气体中一定有甲烷和乙烯 B. 混合气体中一定有甲烷 C. 混合气体中一定有乙烷 D. 混合气体中一定有乙炔 【解析】根据题目条件,混合气体平均化学式为C1.6H4。则两 种气态烃分子中,必有一种碳原子数大于1.6,另一种小于1.6, 并且应该是整数,故肯定含有CH4,又因为平均H原子数为4, 则另一种烃的H原子数必为4,可以是乙烯或丙炔等,但不可能 含乙烷。 【答案】B 【例2】 (2010·福建泉州一中期中)某气态烃1体积最多能与同 条件下2体积氯化氢发生加成反应生成氯代烷,此氯代烷1 mol 可与6 mol氯气发生完全的取代反应,则该烃为( ) A. 乙烯 B. 丙炔 C. 1,3丁二烯 D. 乙炔 【解析】某气态烃和HCl发生加成反应,且物质的量之比为1∶ 2, 则该烃为炔烃或二烯烃,A不符合题意。加成反应后,1 mol氯 代烷可与6 mol氯气发生完全取代反应,即1 mol氯代烷分子中含 有6 mol H原子,其中2 mol H 原子来自HCl,故原烃分子中有4个 H原子,B符合题意。 【答案】B 取代反应 加成反应 加聚反应 概念 有机物分子里 的某些原子 或原子团被 其他原子或 原子团所代 替的反应 有机物分子中双键 或三键两端的 碳原子与其他 原子或原子团 直接结合生成 新的化合物的 反应 由不饱和的相对 分子质量小的 化合物分子结 合成相对分子 质量大的化合 物分子的反应 【温馨提示】①烷烃能与氯气发生取代反应,且反应条件为 光照,而不能与氯水发生取代反应。②取代反应中,每取代 一个H原子消耗一个Cl2分子;加成反应中,一个碳碳双键加 成消耗一个Cl2分子。 【知识关联】取代反应、加成反应、加聚反应与有关实验、 定量计算、有机物推断及有机合成等联系。 2. 若用乙烯和氯气在适当的条件下反应制取四氯乙烷,这一过 程中所要经历的反应及消耗氯气的量是(设乙烯为1 mol,反应 产物中的有机物只有四氯乙烷)( ) A. 取代,4 mol Cl2 B. 加成,2 mol Cl2 C. 加成、取代,2 mol Cl2 D. 加成、取代,3 mol Cl2 【解析】乙烯分子中含有一个碳碳双键,1 mol乙烯先与1 mol Cl2发生加成反应,然后再与2 mol Cl2发生取代反应生成四氯乙 烷。 【答案】D 【例3】 如图中的实验装置可用于制取乙炔。 请填空: (1)图中,A管的作用是______________________________,制 取乙炔的化学方程式是__________________。 ( 2 ) 乙 炔 通 入 酸 性 K M n O 4 溶 液 中 观 察 到 的 现 象 是 ______________,乙炔发生了________反应。 (3)乙炔通入溴的CCl4溶液中观察到的现象是______________, 乙炔发生了________反应。 (4)为了安全,点燃乙炔前应______________,乙炔燃烧时的实 验现象是________________________。 【答案】(1)调节水面高度以控制反应的发生和停止 CaC2+ 2H2O―→Ca(OH)2+C2H2↑ (2)酸性KMnO4溶液褪色 氧化 (3)溴的CCl4溶液褪色 加成 (4)检验乙炔的纯度 火焰明亮并伴有浓烈的黑烟 (3)收集方法:排水集气法 (4)实验说明 ①乙醇与浓硫酸的体积比约为1∶ 3,先加入乙醇,再沿器壁慢 慢加入浓硫酸,边加边冷却或搅拌。 ②浓H2SO4的作用是催化剂与脱水剂。 ③碎瓷片的作用是防止反应液暴沸。 ④温度计水银球的位置应插入液面以下又不与烧瓶底接触, 作用是测量反应液的温度,以便控制反应的进行。 ⑤反应温度要迅速升高至170℃,目的是为了减少副反应的发生 (减少生成乙醚)。 ⑥在反应过程中,有黑色的炭颗粒和CO2、SO2气体产生: 2. 乙炔的实验室制法 ( 1 ) 反 应 原 理 : C a C 2 + 2H2O―→Ca(OH)2+C2H2↑ (2)发生装置:固+液―→气 (3)收集方法:排水集气法 (4)实验说明 ①制H2、CO2、H2S可用启普发生器,但制乙炔不能用。 ②制取乙炔时,应在导气管附近塞入少量棉花。 ③为了得到比较平稳的乙炔气流,可用饱和食盐水代替水与 CaC2反应。 ④在点燃乙炔前必须先检验纯度,否则易出现爆炸事故。 ⑤制得的乙炔有臭味是因为含H2S、PH3,除杂宜用CuSO4溶液。 ⑥用分液漏斗控制滴水速度来控制乙炔气流。 【知识关联】乙烯和乙炔的实验室制法与有关仪器的使用、排 水量气法的操作、样品纯度的测定等联系。 3. 在室温和大气压强下,用下图所示的装置进行实验,测得a g 含CaC2 90%的样品与水完全反应产生的气体体积为b L。现欲在 相同条件下,测定某电石试样中CaC2的质量分数,请回答下列 问题: (1)CaC2和水反应的化学方程式是____________________。 (2)若反应刚结束时,观察到的实验现象如图所示,这时不能立 即取出导气管,理由是_____________________________。 (3)如果电石试样的质量为c g,测得气体体积为dL,则电石试样 中CaC2的质量分数的计算式w(CaC2)=________。(杂质所生成 的气体体积忽略不计) 【解析】(1)CaC2与水反 应生成Ca(OH)2和放出乙 炔气体,反应方程式为 C a C 2 + 2 H 2 O ― → C a ( O H ) 2 + C2H2↑。 (2)实验结束时,要冷却 至室温才能将导气管移出, 否则,量筒内气体的压强 与外界气压不相等,无法 准确计量产生气体的体积。 (3)因a×90% g CaC2能产 生b L C2H2,则产生d L C2H2时需要 CaC2的质量为×a×90% g,CaC2的质量分数为: 【 答 案 】 ( 1 ) C a C 2 + 2 H 2 O ― → C a ( O H ) 2 + C2H2↑ (2)因为装置内气体的温 度没有恢复到室温,气体 压强还不等 于大气压强 (3) 1. (2010高考·山东基本能力卷,16)某小区,有人在化粪池的顶 盖上燃放鞭炮,导致池内泄露的某种气体与空气混合后遇火爆 炸。这种气体是( ) A. 乙烯 B. 氨气 C. 氮气 D. 甲烷 【解析】化粪池中的物质在反应过程中会产生沼气,沼气的主 要成分是甲烷。在燃放鞭炮时,甲烷被点燃发生爆炸。 【答案】D 2. 由两种烃组成的混合物,无论以何种比例混合,只要混合物 的总质量一定,完全燃烧生成CO2的质量也一定,则此两种烃 一定满足( ) A. 互为同分异构体 B. 最简式相同 C. 为同系物 D. 符合同一通式 【解析】由题意可知两种烃中碳元素的质量分数相同,因烃仅 含C、H两种元素,则H的质量分数也应相同,从而可推知它们 的最简式相同。 【答案】B 3. 有a L乙烯和乙炔的混合气体在催化剂存在的条件下与足量H2 发生加成反应消耗1.25a L H2,乙烯和乙炔的体积比为( ) A. 1∶ 1 B. 2∶ 1 C. 3∶ 1 D. 4∶ 1 4. 既可以用来鉴别乙烷与乙烯,又可以用来除去乙烷中乙烯以得 到纯净乙烷的方法是( ) A. 通过足量的NaOH溶液 B. 通过足量的溴水 C. 在Ni催化、加热条件下通入H2 D. 通过足量的酸性KMnO4溶液 【解析】(性质判定法)乙烷是饱和烃,不与溴水及酸性KMnO4 溶液反应(不能使它们褪色,而乙烯能)。乙烯通过溴水与Br2发 生加成反应生成1,2二溴乙烷(液态)留在溴水中,B方法可行。而 乙烯通过酸性KMnO4溶液被氧化生成CO2,这样乙烷中混入了 CO2,D法不可行。C法也不可取,因为通入的H2的量不好控制, 而且反应条件要求高。乙烯与NaOH溶液不反应,A法不可取。 【答案】B 5. (2010·重庆八中模拟)如图所示,U形管的左端被水和胶塞封 闭有甲烷和氯气(体积比为1∶ 4)的混合气体,假定氯气在水中 的溶解度可以忽略。将封闭有甲烷和氯气的混合气体的装置放 置在有光亮的地方,让混合气体缓慢地反应一段时间。 (1)假设甲烷与氯气反应充分,且只产生一种有机物,请写出化 学方程式_________________________________________。 (2)经过几个小时的反应后,U形管右端的玻璃管中的水柱____。 A. 升高 B. 降低 C. 不变 D. 无法确定 (3)U形管左端的气柱________。 A. 体积增大 B. 体积减小直至消失 C. 不变 ( 4 ) 试 解 释 U 形 管 右 端 的 玻 璃 管 中 水 柱 变 化 的 原 因 : ______________________________________________________ _____________________________________________________。 【解析】甲烷与氯气在光照条件下可能发生的反应有①CH4+ Cl2→HCl+CH3Cl;②CH3Cl+Cl2→CH2Cl2+HCl;③CH2Cl2 +Cl2→CHCl3+HCl;④CHCl3+Cl2→CCl4+HCl。根据题意反 应充分,(1)只写④的反应即可。由于氯化氢易溶于水,CH2Cl2、 CHCl3和CCl4是液体,所以甲烷与氯气反应后气体体积是减小 的,故U形管两边液差减小,右端玻璃管中的水柱降低,左端的 气柱体积减小,直至消失。 【答案】(1)CH4+4Cl2 CCl4+4HCl (2)B (3)B (4)由发生反应的化学方程式可知,此反应中气体的物质的量减 少,且生成的HCl能够溶解于水,所以U形管左端压强减小至零, 故右端玻璃管中的水柱降低 光照查看更多