- 2021-04-24 发布 |
- 37.5 KB |
- 6页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学考前三个月专题练习17无机知识与化学原理的综合
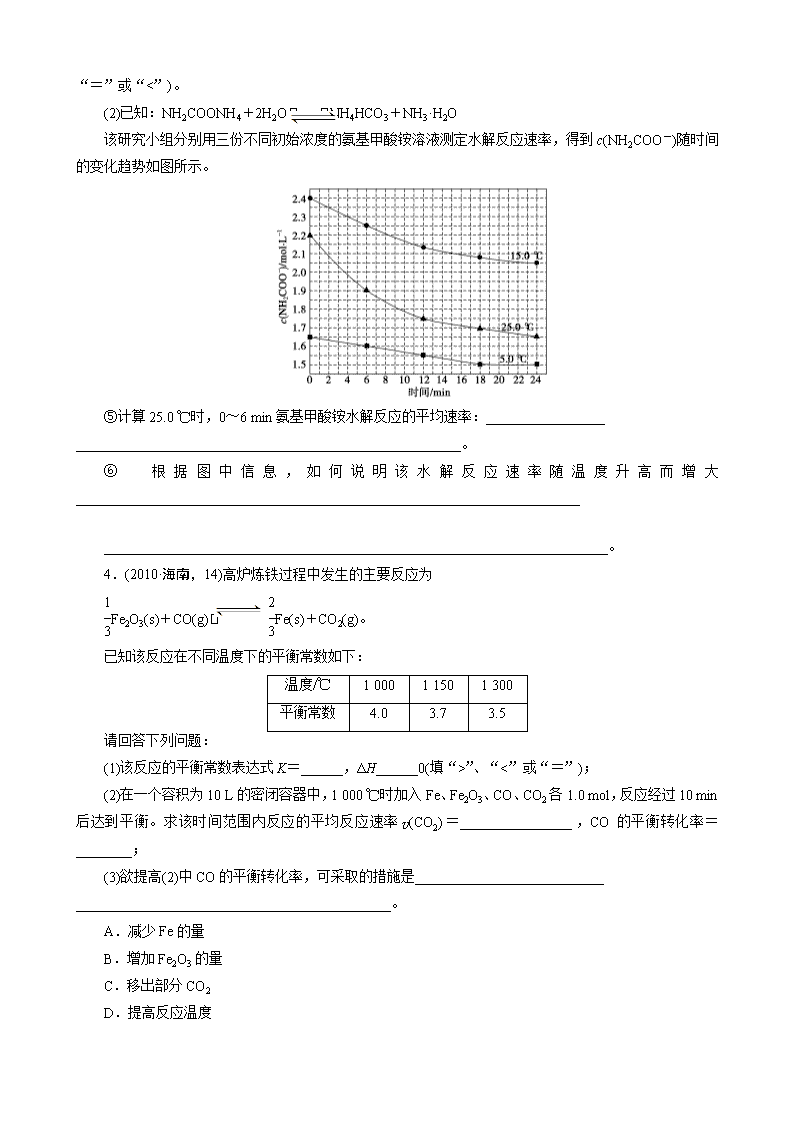
2013届高考化学复习卷-专练17 无机知识与化学原理的综合 1.(2010·天津理综,10)二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。 请回答下列问题: (1)煤的气化的主要化学反应方程式为__________________________________________。 (2)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为____________________________________。 (3)利用水煤气合成二甲醚的三步反应如下: ①2H2(g)+CO(g) CH3OH(g) ΔH=-90.8 kJ·mol-1 ②2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ·mol-1 ③CO(g)+H2O(g) CO2(g)+H2(g) ΔH=-41.3 kJ·mol-1 总反应3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)的ΔH=________; 一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是______(填字母代号)。 a.高温高压 b.加入催化剂 c.减少CO2的浓度 d.增加CO的浓度 e.分离出二甲醚 (4)已知反应②2CH3OH(g) CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下: 物质 CH3OH CH3OCH3 H2O 浓度/mol·L-1 0.44 0.6 0.6 ①比较此时正、逆反应速率的大小:v正________v逆(填“>”、“<”或“=”)。 ②若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH)=__________________;该时间内反应速率v(CH3OH)=________________。 2.(2011·山东理综,28)研究NO2、SO2、CO等大气污染气体的处理具有重要意义。 (1)NO2可用水吸收,相应的化学反应方程式为_____________________________ ________________________________________________________________________。 利用反应6NO2+8NH37N2+12H2O也可处理NO2 。当转移1.2 mol电子时,消耗的NO2在标准状况下是________L。 (2)已知:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1 2NO(g)+O2(g) 2NO2(g) ΔH=-113.0 kJ·mol-1 则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH=________ kJ·mol-1。 一定条件下,将NO2与SO2以体积比1∶ 2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是________。 a.体系压强保持不变 b.混合气体颜色保持不变 c.SO3和NO的体积比保持不变 d.每消耗1 mol SO3的同时生成1 mol NO2 测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=________。 (3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图所示。该反应ΔH________0(填“>”或“<”)。实际生产条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是_______________________ ________________________________________________________________________。 3.(2011·浙江理综,27)某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定。 (1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡: NH2COONH4(s) 2NH3(g)+CO2(g) 实验测得不同温度下的平衡数据列于下表: 温度/℃ 15.0 20.0 25.0 30.0 35.0 平衡总压强/kPa 5.7 8.3 12.0 17.1 24.0 平衡气体总浓度/mol·L-1 2.4×10-3 3.4×10-3 4.8×10-3 6.8×10-3 9.4×10-3 ①可以判断该分解反应已经达到平衡的是________。 A.2v(NH3)=v(CO2) B.密闭容器中总压强不变 C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变 ②根据表中数据,列式计算25.0 ℃时的分解平衡常数:__________________。 ③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0 ℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量________(填“增加”、“减少”或“不变”)。 ④氨基甲酸铵分解反应的焓变ΔH________0(填“>”、“=”或“<”),熵变ΔS________0(填“>”、 “=”或“<”)。 (2)已知:NH2COONH4+2H2O NH4HCO3+NH3·H2O 该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间的变化趋势如图所示。 ⑤计算25.0 ℃时,0~6 min氨基甲酸铵水解反应的平均速率:_________________ _______________________________________________________。 ⑥根据图中信息,如何说明该水解反应速率随温度升高而增大________________________________________________________________________ ________________________________________________________________________。 4.(2010·海南,14)高炉炼铁过程中发生的主要反应为 Fe2O3(s)+CO(g) Fe(s)+CO2(g)。 已知该反应在不同温度下的平衡常数如下: 温度/℃ 1 000 1 150 1 300 平衡常数 4.0 3.7 3.5 请回答下列问题: (1)该反应的平衡常数表达式K=______,ΔH______0(填“>”、“<”或“=”); (2)在一个容积为10 L的密闭容器中,1 000 ℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过10 min后达到平衡。求该时间范围内反应的平均反应速率v(CO2)=________________,CO的平衡转化率=________; (3)欲提高(2)中CO的平衡转化率,可采取的措施是___________________________ _____________________________________________。 A.减少Fe的量 B.增加Fe2O3的量 C.移出部分CO2 D.提高反应温度 E.减小容器的容积 F.加入合适的催化剂 5.(2011·重庆理综,29)臭氧是一种强氧化剂,常用于消毒、灭菌等。 (1)O3与KI溶液反应生成的两种单质是__________和________。(填分子式) (2)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如下表所示。已知:O3的起始浓度为0.021 6 mol·L-1。 pH Tmin T℃ 3.0 4.0 5.0 6.0 20 301 231 169 58 30 158 108 48 15 50 31 26 15 7 ①pH增大能加速O3分解,表明对O3分解起催化作用的是________。 ②在30 ℃、pH=4.0条件下,O3的分解速率为________mol·L-1·min-1。 ③据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为________。(填字母代号) a.40 ℃、pH=3.0 b.10 ℃、pH=4.0 c.30 ℃、pH=7.0 (3)O3可由臭氧发生器(原理如图)电解稀硫酸制得。 ①图中阴极为________(填“A”或“B”),其电极反应式为_________________ _______________________________________________________。 ②若C处通入O2,则A极的电极反应式为____________________________________。 ③若C处不通入O2,D、E处分别收集到x L和y L气体(标准状况),则E处收集的气体中O3所占的体积分数为________。(忽略O3的分解) 6.新华社2009年10月15日报道:全国农村应当在“绿色生态—美丽多彩—低碳节能—循环发展”的理念引导下,更好更快地发展“中国绿色村庄”,参与“亚太国际低碳农庄”建设。可见“低碳循环”已经引起了国民的重视,试回答下列问题: (1)煤的气化和液化可以提高燃料的利用率。 已知25 ℃,101 kPa时:C(s)+O2(g)===CO(g) ΔH=-126.4 kJ·mol-1 2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1 H2O(g)===H2O(l) ΔH=-44 kJ·mol-1 则在25 ℃、101 kPa时:C(s)+H2O(g)===CO(g)+H2(g) ΔH=______________。 (2)高炉炼铁是CO气体的重要用途之一,其基本反应为FeO(s)+CO(g)Fe(s)+CO2(g) ΔH>0,已知在1 100 ℃时,该反应的化学平衡常数K=0.263。 ①温度升高,化学平衡移动后达到新的平衡,此时平衡常数K值________(填“增大”、“减小”或“不变”); ②1 100℃时测得高炉中,c(CO2)=0.025 mol·L-1,c(CO)=0.1 mol·L-1,则在这种情况下,该反应是否处于化学平衡状态?________(填“是”或“否”),其判断依据是________________________________________________________________________。 (3)目前工业上可用CO2来生产燃料甲醇,有关反应为CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。现向体积为1 L的密闭容器中充入1 mol CO2和3 mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。 ①从反应开始到平衡,氢气的平均反应速率v(H2)= ; ②下列措施能使增大的是 (填符号)。 A.升高温度 B.再充入H2 C.再充入CO2 D.将H2O(g)从体系中分离 E.充入He(g),使体系压强增大 答案 1.(1)C+H2O(g) CO+H2 (2)H2S+Na2CO3===NaHS+NaHCO3 (3)-246.4 kJ·mol-1 ce (4)①> ②0.04 mol·L-1 0.16 mol·L-1·min-1 2.(1)3NO2+H2O===2HNO3+NO 6.72 (2)-41.8 b 2.67或 (3)< 在1.3×104 kPa下,CO转化率已较高,再增大压强,CO转化率提高不大,而生产成本增加,得不偿失 3.(1)①BC ②K=c2(NH3)·c(CO2)=(c)2·(c)=×(4.8×10-3 )3=1.64×10-8 ③增加 ④> > (2)⑤0.05 mol·L-1·min-1 ⑥25.0 ℃时反应物的起始浓度比15.0 ℃时的小,但0~6 min的平均反应速率(曲线的斜率)仍比15.0 ℃时的大。 4.(1) < (2)0.006 mol·L-1·min-1 60% (3)C 5.(1)I2 O2 (2)①OH- ②1.00×10-4 ③b、a、c (3)①A 2H++2e-===H2↑ ②O2+4H++4e-===2H2O ③(x-2y)/y 6.(1)115.4 kJ·mol-1 (2)①增大 ②否 因为Qc==0.25查看更多
相关文章
- 当前文档收益归属上传用户
- 下载本文档