- 2021-04-23 发布 |
- 37.5 KB |
- 4页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
中考化学综合实验学案
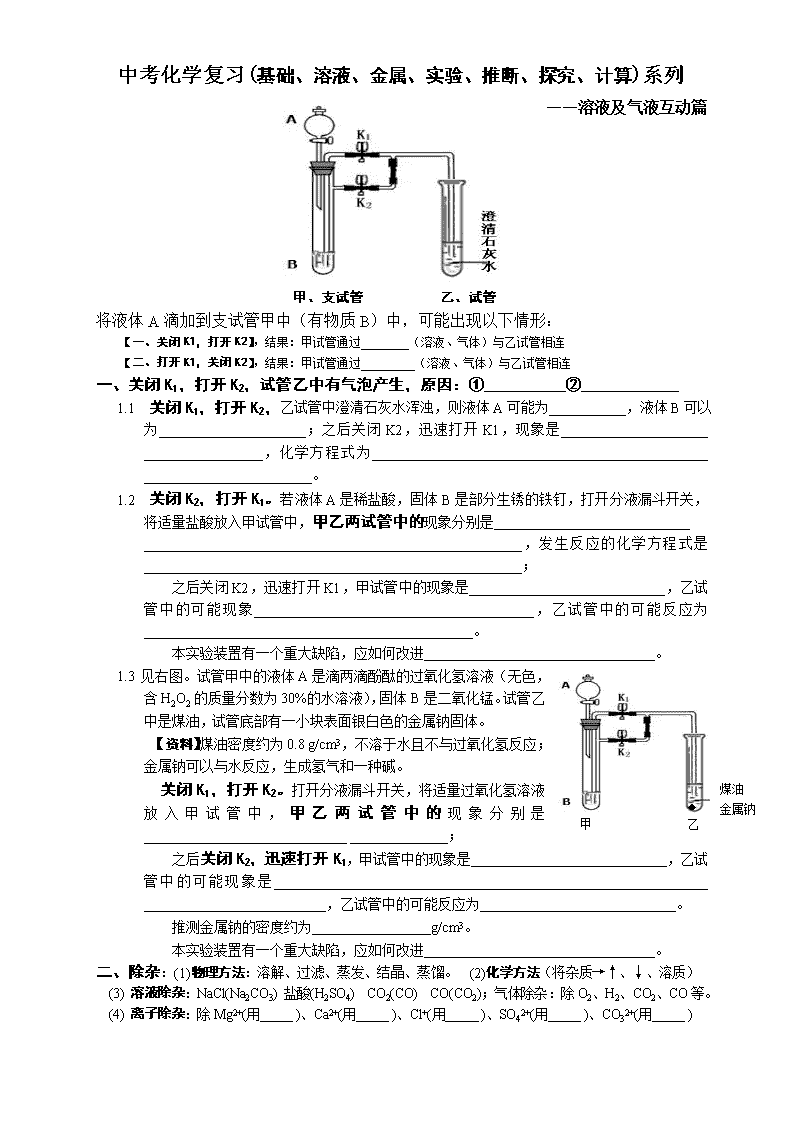
中考化学复习(基础、溶液、金属、实验、推断、探究、计算)系列 ——溶液及气液互动篇 甲、支试管 乙、试管 将液体A滴加到支试管甲中(有物质B)中,可能出现以下情形: 【一、关闭K1,打开K2】,结果:甲试管通过________(溶液、气体)与乙试管相连 【二、打开K1,关闭K2】,结果:甲试管通过_________(溶液、气体)与乙试管相连 一、 关闭K1,打开K2,试管乙中有气泡产生,原因:①__________②____________ 1.1 关闭K1,打开K2,乙试管中澄清石灰水浑浊,则液体A可能为___________,液体B可以为_____________________;之后关闭K2,迅速打开K1,现象是_____________________ _________________,化学方程式为________________________________________________ ________________________。 1.2 关闭K2,打开K1。若液体A是稀盐酸,固体B是部分生锈的铁钉,打开分液漏斗开关,将适量盐酸放入甲试管中,甲乙两试管中的现象分别是____________________________ ______________________________________________________,发生反应的化学方程式是______________________________________________________; 之后关闭K2,迅速打开K1,甲试管中的现象是____________________________,乙试管中的可能现象________________________________________,乙试管中的可能反应为_______________________________________________。 本实验装置有一个重大缺陷,应如何改进_________________________________。 煤油 金属钠 ◆ 甲 乙 1.3 见右图。试管甲中的液体A是滴两滴酚酞的过氧化氢溶液(无色,含H2O2的质量分数为30%的水溶液),固体B是二氧化锰。试管乙中是煤油,试管底部有一小块表面银白色的金属钠固体。 【资料】煤油密度约为0.8 g/cm3,不溶于水且不与过氧化氢反应;金属钠可以与水反应,生成氢气和一种碱。 关闭K1,打开K2。打开分液漏斗开关,将适量过氧化氢溶液放入甲试管中,甲乙两试管中的现象分别是_____________________________ ______________; 之后关闭K2,迅速打开K1,甲试管中的现象是____________________________,乙试管中的可能现象是______________________________________________________________ __________________________,乙试管中的可能反应为____________________________。 推测金属钠的密度约为_________________g/cm3。 本实验装置有一个重大缺陷,应如何改进_________________________________。 二、除杂:(1)物理方法:溶解、过滤、蒸发、结晶、蒸馏。 (2)化学方法(将杂质→↑、↓、溶质) (3) 溶液除杂:NaCl(Na2CO3) 盐酸(H2SO4) CO2(CO) CO(CO2);气体除杂:除O2、H2、CO2、CO等。 (4) 离子除杂:除Mg2+(用_____ )、Ca2+(用_____ )、Cl+(用_____ )、SO42+(用_____ )、CO32+(用_____ ) 三、空气中氧气含量的测定 1、拉瓦锡测氧气: 将银白色的汞在密封的空气中加热12天,有红色固体产生。 2、红磷燃烧法:【红磷燃烧、水倒吸法】监测空气中的氧气含量。 3、装置要点________ 操作要点_________________________________。 4、测定结果:装置正确,操作准确,测定的O2体积总是____1/5(填“>、=或<”)。 5、对测定结果的影响因素: ①红磷不足 ②红磷稍过量 ③木炭代替红磷 ④燃烧后未降到室温 ⑤装置漏气 ⑥放入燃烧的红磷速度过慢 ⑦红磷燃烧后未摇晃 ⑧瓶底未放水 ⑨止水夹不太紧 以上因素,使O2含量偏高的是______________; 使结果偏低的是________;无影响的是_____。 改进方法:___________________________________________________。 6、红磷燃烧法成功的原因有________________________________________________________。 7、红磷燃烧之后,要把集气瓶晃动两下的原因是______________________________________。 8、如何得到氧气含量不同的氧气(O2的体积百分数,从21%到100%) (1)用5个同样大小的集气瓶,分别盛放占集气瓶容积10%、20%、30%、40%、50%的水(瓶子其余部分为空气),盖好,倒扣在水槽中。 (2)分别向以上5个瓶子中通入氧气,到瓶中水排完。 (3)分别将带火星的木条插入这5个瓶中,观察到带火星的木条: 瓶子编号 1 2 3 4 5 看到现象 微亮 亮 很亮 复燃 _________ (4) 根据实验,能使带火星木条复燃所需氧气最小体积分数在____号瓶到____号瓶间; (5) 上面用排水法收集到的氧气,4号瓶中氧气的体积分数约为______。 9、设计【木炭燃烧法】测定空气中的氧气含量,烧杯中可以用________________。 10、红磷燃烧-水倒吸法测定氧气含量成功的原因是______________________________________。 11、木炭燃烧法测定氧气含量可以成功的原因是________________________________________。 四、混合溶液中溶质的判定 4.1、溶液的酸碱性,决定溶质的种类 以稀盐酸、石灰水、纯碱溶液三者混合之后的滤液为例: (1)如果滤液是酸性,如何通过实验判定__________________现象为____________________,可能的溶质为_________________________________; (2)如果滤液为中性,如何通过实验判定______________________________________________,现象为______________________________________________,可能的溶质为______________ ______________________________________; (3)如果滤液为碱性,如何通过实验判定_________ ___________________________________,现象 为____________________________________, 可能的溶质为_________________________________________。 4.2、变质烧碱溶液的溶质判定 猜想:①NaOH ②Na2CO3 ③NaOH和Na2CO3 ④ 操作:_____________________________________________________________。 (1)NaOH判定_______________________________________________________________。 (2)Na2CO3判定____________________________________________________________。 (3)NaOH、Na2CO3混合固体判定________________________________________________。 4.3、石灰水、烧碱混合溶液的溶质判定 猜想:①NaOH ②Ca(OH)2 ③NaOH和Ca(OH)2 操作:___________________________________________________________________。 (1)NaOH判定__________________________________________________________。 (2)Ca(OH)2____________________________________________________________。 (3)NaOH、Ca(OH)2混合固体判定________________________________________________。 4.4、苏打、小苏打、苏打/小苏打混合溶液的溶质判定 猜想:①Na2CO3 ②NaOH ③Na2CO3 和NaHCO3 ④NaHCO3 操作:___________________________________________________________________。 (1)NaOH判定_________________________________________________。 (2)Na2CO3判定_______________________________________________________。 (3)NaHCO3____________________________________________________________。 (4)Na2CO3、Na2CO3混合固体判定________________________________________________。 五、固体的判定 5.1、稀盐酸、石灰水、纯碱溶液混合后的滤渣 猜想:①CaCO3 ②Ca(OH)2 ③CaCO3 和Ca(OH)2 操作:_____________________________________________________________。 (1)CaCO3判定__________________________________________________________。 (2)Ca(OH)2判定__________________________________________________________。 (3)CaCO3、Ca(OH)2混合固体判定________________________________________________。 5.2、红色固体粉末的判定 猜想:①Cu ②Fe2O3 ③Cu和Fe2O3 ④Cu3O 操作:_____________________________________________________________。 操作要点:_____________________________________________________________。 (1)Fe2O3判定__________________________________________________________。 溶解性口诀 1、 盐:钾、钠、铵、硝皆可溶 2、 碱:钾、钠、铵、钙、钡 其余都不溶。 3、 硫酸盐:CuSO4不溶,钙微溶 4、 氯化物:AgCl不溶。 其余都溶。 (2)Cu判定________________________________________________。 (3)Fe2O3、CuO混合粉末判定________________________________。 (4)Cu2O判定______________________________________________。 5.3、黑色固体粉末的判定 猜想:①Fe ②CuO ③Fe和CuO ④Fe3O4 操作:____________________________________________________。 操作要点:________________________________________________。 (1)Fe粉的判定______________________________________________。 (2)CuO判定________________________________________________。 (3)Fe3O4判定_______________________________________________。 (4)C粉的判定______________________________________________。 (5)Fe、CuO判定_____________________________________________。 (5)MnO2判定________________________________________________。 5.4、白色固体的判定 操作:_____________________________________________________________。 操作要点:_____________________________________________________________。 (1)NaOH固体的判定________________________________________________。 (2)Ca(OH)2判定____________________________________________________。 (3)Na2CO3判定____________________________________________________。 (4)NaHCO3判定____________________________________________________。 (5)NaCl判定____________________________________________________。 (6)CaCO3判定____________________________________________________。 (7)KClO3判定____________________________________________________。 33.(7分) 化学小组对金属钠产生了浓厚的兴趣,在老师的帮助下,提出了“金属钠能否置换出硫酸铜溶液中的铜?”、“金属钠是否能在二氧化碳中燃烧?”等问题。请你参与他们的探究,并回答相应的问题: 【查阅资料】:①金属Na性质活泼,常温下,它极易与氧气反应生成白色固体氧化钠,氧化钠溶于水生成氢氧化钠。②金属钠还可以与水剧烈反应放出氢气。③ 碱性的Na2CO3溶液与中性的CaCl2溶液发生复分解反应。 【实验探究】 实验1:探究金属钠是否能置换出硫酸铜溶液中的铜 实验操作 实验现象 结论与解释 ①用镊子从煤油中取出一小块金属钠,用滤纸吸干表面煤油后投入硫酸铜溶液中 出现蓝色沉淀,但没有红色的物质析出 金属钠 (填“能”或“不能”)置换出硫酸铜溶液中的铜 ②同上,将金属钠投入水中,待反应结束后滴加酚酞溶液 溶液变红 钠与水反应的化学方程式是____ __________________。 实验2:探究金属钠是否能在二氧化碳中燃烧? 实验操作 实验现象 结论与解释 将燃烧的钠迅速伸入盛有CO2的集气瓶中 钠在CO2中继续燃烧,冷却,瓶内附着黑色颗粒,并粘附着白色物质. 产物中一定有 。 实验3:探究白色物质是什么? 实验操作 实验现象 结论与解释 ①取该样品少量于试管里,加入适量的水,振荡,过滤,向滤液中加入无色酚酞试液。 溶液变成红色 产物中一定还 有 ②取该样品少量于试管里,滴加足量稀盐酸。 有气泡冒出 ③取该样品少量于试管里,加入适量的水,振荡,过滤,向滤液中加入过量的氯化钙溶液,出现白色沉淀,然后过滤,再向溶液里滴加无色酚酞试液 无明显现象 实验反思:(1)金属钠保存在煤油中的原因是 。 (2) 实验3中③“向滤液中加入过量的氯化钙溶液” 的原因是 。 钠容易与 氧气、水反应变质,如果钠发生火灾,该如何处理? 。查看更多