- 2021-04-22 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020年高考化学真题模拟题专项汇编__04氧化还原反应(原卷版)
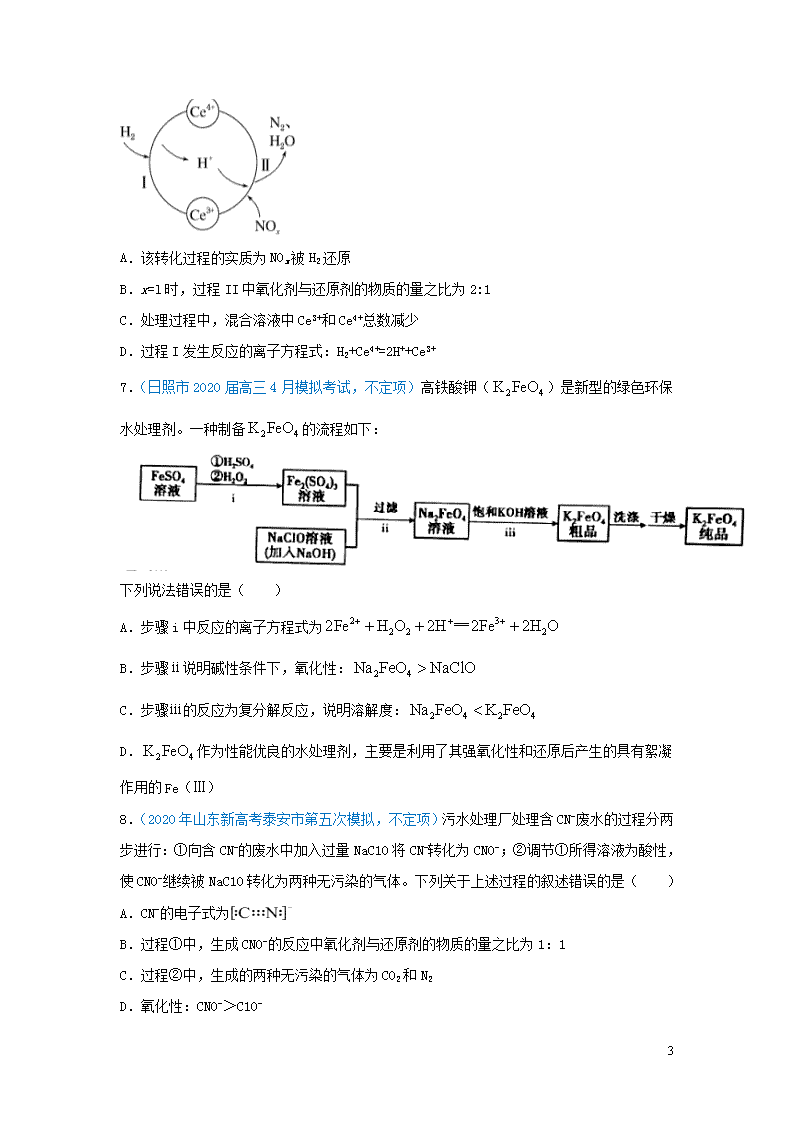
专题04 氧化还原反应 2020年高考真题 1.【2020年7月浙江选考】反应中,氧化产物与还原产物的物质的量之比是( ) A.1:2 B.1:1 C.2:1 D.4:1 2.【2020山东(新高考)】下列叙述不涉及氧化还原反应的是 A.谷物发酵酿造食醋 B.小苏打用作食品膨松剂 C.含氯消毒剂用于环境消毒 D.大气中NO2参与酸雨形成 2020届高考模拟试题 3.(浙江省金华十校2020届高三4月模拟考试)下列变化中,气体被还原的是 A.水蒸气使 CuSO4固体变蓝 B.氯气使浅绿色 FeC12 溶液变黄 C.H2使灼热CuO 固体变红 D.氨气使A1Cl3溶液产生白色沉淀 4.(北京市顺义区2020届高三第一次模拟)常温下,向溶液中滴加少量溶液,反应原理如图所示。关于该反应过程的说法正确的是 A.该反应过程中,是是 B.当有生成时,转移电子 C.在分解过程中,溶液的逐渐降低 D.的氧化性比强,还原性比弱 5.(2020届济南市实验中学高三下学期2月份阶段检测)已知酸性 K2Cr2O7 溶液可与 FeSO4 溶液反应生成 Fe3+和 Cr3+。现将硫酸酸化的 K2Cr2O7 溶液与 FeSO4 溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的 KI 的物质的量的变化关系如图所示,下列不正确的是 8 A.图中AB段的氧化剂为 K2Cr2O7 B.开始加入的 K2Cr2O7 为 0.25 mol C.图中 BC 段发生的反应为 2Fe3++2I-=2Fe2++I2 D.混合之前,K2Cr2O7 与 FeSO4的物质的量之比为1∶6 6.(聊城市2020年普通高中学业水平等级考试二模)某科研团队研究发现硼氢化钠(NaBH4)在催化剂Ru表面与水反应可生成H2,其反应机理如图所示: 根据以上信息判断,下列叙述错误的是 A.过程①至过程④中硼元素的化合价不变 B.X是H3BO3,H3BO3和BH3两分子中H的化合价相等 C.过程③和过程④各产生1molH2时转移的电子数不相等 D.0.25molNaBH4的还原能力与标准状况下22.4LH2的还原能力相当(还原能力即生成H+失去电子的量) 7.(青岛市2020届高三第三次模拟)向含有淀粉的 KIO3 酸性溶液滴加 NaHSO3 溶液,溶液先变蓝后褪色。下列说法错误的是 A.溶液先变蓝的原因:2IO+5HSO=I2+5SO+H2O+3H+ B.溶液恰好褪色时 n(KIO3):n(NaHSO3)=1:3 C.还原性 I-> HSO>I2 D.若向含有淀粉的 NaHSO3 溶液中滴加过量 KIO3 酸性溶液,则溶液变蓝不褪色 6.(天津市南开区2020届高三年级第二次模拟考试)硝酸厂的烟气中含有大量的氮氧化物(NOx),将烟气与H2的混合气体通入Ce(SO4)2与Ce2(SO4)3[Ce中文名“铈”]的混合溶液中实现无害化处理,其转化过程如图所示。下列说法正确的是 8 A.该转化过程的实质为NOx被H2还原 B.x=l时,过程II中氧化剂与还原剂的物质的量之比为2:1 C.处理过程中,混合溶液中Ce3+和Ce4+总数减少 D.过程I发生反应的离子方程式:H2+Ce4+=2H++Ce3+ 7.(日照市2020届高三4月模拟考试,不定项)高铁酸钾()是新型的绿色环保水处理剂。一种制备的流程如下: 下列说法错误的是( ) A.步骤i中反应的离子方程式为 B.步骤ⅱ说明碱性条件下,氧化性: C.步骤ⅲ的反应为复分解反应,说明溶解度: D.作为性能优良的水处理剂,主要是利用了其强氧化性和还原后产生的具有絮凝作用的Fe(Ⅲ) 8.(2020年山东新高考泰安市第五次模拟,不定项)污水处理厂处理含CN-废水的过程分两步进行:①向含CN-的废水中加入过量NaC1O将CN-转化为CNO-;②调节①所得溶液为酸性,使CNO-继续被NaC1O转化为两种无污染的气体。下列关于上述过程的叙述错误的是( ) A.CN-的电子式为 B.过程①中,生成CNO-的反应中氧化剂与还原剂的物质的量之比为1:1 C.过程②中,生成的两种无污染的气体为CO2和N2 D.氧化性:CNO->C1O- 8 9.(2020年山东新高考烟台市适应性练习一,不定项)《环境科学》刊发了我国科研部门采用零价铁活化过硫酸钠(Na2S2O8,其中S为+6价)去除废水中的正五价砷[As(V)]的研究成果,其反应机制模型如图所示(SO·、·OH表示自由基)。设阿伏加德罗常数的值为NA。下列叙述错误的是( ) A.过硫酸钠中-2价氧与-1价氧的个数比为3:1 B.若56gFe参加反应,共有1.5NA个S2O82−被还原 C.碱性条件下硫酸根自由基发生反应的方程式为SO4-·+OH-=SO42-+·OH D.pH越小,越有利于去除废水中的正五价砷 10.(2020年山东新高考烟台市适应性练习一,不定项)用KMnO4酸性溶液处理硫化亚铜(Cu2S)和二硫化亚铁(FeS2)的混合物时,发生的反应Ⅰ:+Cu2S+H+→Cu2+++Mn2++H2O(未配平)和反应Ⅱ:+FeS2+H+→Fe3+++Mn2++H2O(未配平)。下列说法正确的是( ) A.反应Ⅰ中Cu2S既是氧化剂又是还原剂 B.反应Ⅰ中每生成1mol,转移电子的物质的量为10mol C.反应Ⅱ中氧化剂与还原剂的物质的量之比为1:3 D.若反应Ⅰ和反应Ⅱ中消耗的KMnO4的物质的量相同,则反应Ⅰ和反应Ⅱ中消耗的还原剂的物质的量之比为3:2 11.(北京市海淀区2020届高三二模)金属铬常用于提升特种合金的性能。工业上以铬铁矿(主要成份为FeO·Cr2O3,含有少量Al2O3)为原料制备金属铬的流程如下图。下列说法不正确的是( ) 8 A.①中需持续吹入空气作氧化剂 B.②中需加入过量稀硫酸 C.③中发生了置换反应 D.溶液A为橙色 12.(山东省实验中学2020届高三下学期打靶模拟考试)高锰酸钾(KMnO4)是一种常用的氧化剂。不同条件下高锰酸钾可发生如下反应:+5e-+8H+→Mn2++4H2O;+3e-+2H2O→MnO2+4OH-;+e-→。高锰酸钾溶液与硫化亚铁有如下反应:FeS+KMnO4+H2SO4→K2SO4+MnSO4+Fe2(SO4)3+S+H2O(未配平)。下列有关说法正确的是 A.由上面的反应可知,高锰酸根离子()反应后的产物与溶液的酸碱性有关 B.高锰酸钾溶液可代替二氧化锰用来制取Cl2,氧化剂和还原剂物质的量之比为1:8 C.在高锰酸钾溶液与硫化亚铁的反应中,反应前后固体的质量减少了2.8g,则硫元素与高锰酸钾之间转移的电子数为0.15NA D.高锰酸钾溶液也可与双氧水发生反应,其中双氧水是氧化剂 13.(日照市2020届高三4月模拟考试)是一种红色固体,常用作示温涂料。制备反应为:。下列说法正确的是( ) A.上述反应的产物中,Hg的化合价为 B.上述反应中Hg元素与Cu元素均被还原 C.上述反应中生成时,转移的电子数为 D.由以上信息可推知:可发生反应 14.(山东师范大学附属中学2020届高三6月份模拟,不定项)氰化物是剧毒物质,传统生产工艺的电镀废水中含一定浓度的CN-,无害化排放时必须对这种废水进行处理。 可采用碱性条件下的Cl2氧化法处理这种废水,涉及两个反应:反应i,CN- +OH-+Cl2OCN- +Cl 8 -+H2O(未配平); 反应ii,OCN- + OH-+ Cl2X + Y + Cl-+ H2O(未配平)。 其中反应i中N元素的化合价没有变化,常温下,X、Y是两种无毒的气体。下列判断正确的是( ) A.反应i中氧化剂与还原剂的化学计量数之比为1: 1 B.X、Y是CO2、N2,且均为反应ii的氧化产物 C.该废水处理工艺过程中须采取措施,防止Cl2逸出到空气中 D.处理c(CN-) =0.000 1 mol·L-1的废水106 L,消耗标况下的Cl2 4.48×103L 15.(滨州市2020届高三第三次模拟考试)工业上用发烟HC1O4将潮湿的CrC13氧化为棕色的烟[CrO2(C1O4)2],来除去Cr(Ⅲ),HC1O4中部分氯元素转化为最低价态。下列说法错误的是( ) A.CrO2(C1O4)2中Cr元素显+6价 B.HC1O4属于强酸,该反应还生成了另一种强酸 C.该反应中,参加反应的氧化剂与氧化产物的物质的量之比为3:8 D.该反应离子方程式为19ClO+8Cr3++8OH-=8CrO2(ClO4)2+3C1-+4H2O 16.(湖北省2020届高三下学期6月供卷理综化学)我国科技工作者提出的一种OER(氧气析出反应) 机理如图所示。下列说法错误的是 A.物质M不能改变OER反应的趋势 B.每一步反应过程都是氧化还原反应 C.反应过程中只涉及极性键的断裂和形成 D.该总反应方程式为4OH--4e-2H2O+O2↑ 17.(2020年山东新高考化学全真模拟卷三,不定项)工业是制取高铁酸钾(K2FeO4 8 ),是先制取高铁酸钠,然后在低温下,往高铁酸钠溶液中加入KOH至饱和就可以析出高铁酸钾。湿法制备Na2FeO4的主要反应为:2Fe(OH)3+3ClO﹣+4OH﹣=2FeO42﹣+3Cl﹣+5H2O;干法备Na2FeO4的主要反应为:2FeSO4+6Na2O2=2Na2FeO4+2Na2SO4+O2↑。下列有关说法不正确的是( ) A.湿法和干法制备中,生成1molNa2FeO4转移电子数目相同 B.高铁酸钾在低温下的溶解度比高铁酸钠的溶解度小 C.干法制备的主要反应中Na2O2是氧化剂 D.K2FeO4处理水时,既能杀菌消毒,生成的Fe(OH)3胶体还能吸附水中的悬浮杂质 18.(日照市2020届高三校际联合考试化学试题,不定项)由一种阳离子与两种酸根阴离子组成的盐称为混盐。向混盐Na4S2O3中加入足量稀硫酸,发生反应:。下列说法正确的是( ) A.Na4S2O3的水溶液显碱性 B.1mol Na4S2O3中共含离子数为5NA C.上述反应中,每产生3molS,转移电子的物质的量为6mol D.CaOCl2也可称为混盐,向CaOCl2中加入足量稀硫酸会有Cl2产生 19.(泰安市肥城市2020届高三适应性训练,不定项)铅的冶炼大致过程如下: ①富集:将方铅矿(PbS)进行浮选;②焙烧:2PbS+3O22PbO+2SO2; ③制粗铅:PbO +CPb +CO↑;PbO+COPb+CO2。 下列说法错误的是( ) A.浮选法富集方铅矿的过程,属于物理变化 B.将lmolPbS冶炼成Pb,理论上至少需要12g碳 C.方铅矿焙烧反应中,PbS是还原剂,还原产物只有PbO D.焙烧过程中,每生成lmolPbO转移6mol电子 20.(山东省2020届普通高中学业水平等级考试模拟卷三,不定项)偏二甲肼[(CH3)2N—NH2]与 N2O4 是常用的火箭推进剂,火箭发射时常出现红棕色气体,发生的化学反应如下: ①(CH3)2N—NH2(1)+2N2O4(1) = 2CO2(g)+3N2(g)+4H2O(g) △H1<0 ②N2O4(1) 2NO2(g) △H2>0 下列说法不正确的是 ( ) A.反应①中,N2O4 为氧化剂 B.反应①中,生成1mo1CO2 时,转移16mo1e- 8 C.由反应②推断:加压、降温是获得液态 N2O4的条件 D.温度升高,反应①的化学反应速率减小、反应②的化学反应速率增大 8查看更多