- 2021-04-22 发布 |
- 37.5 KB |
- 27页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021高三化学人教版一轮学案:第九章 第二节 生活中两种常见的有机物 基本营养物质 Word版含解析
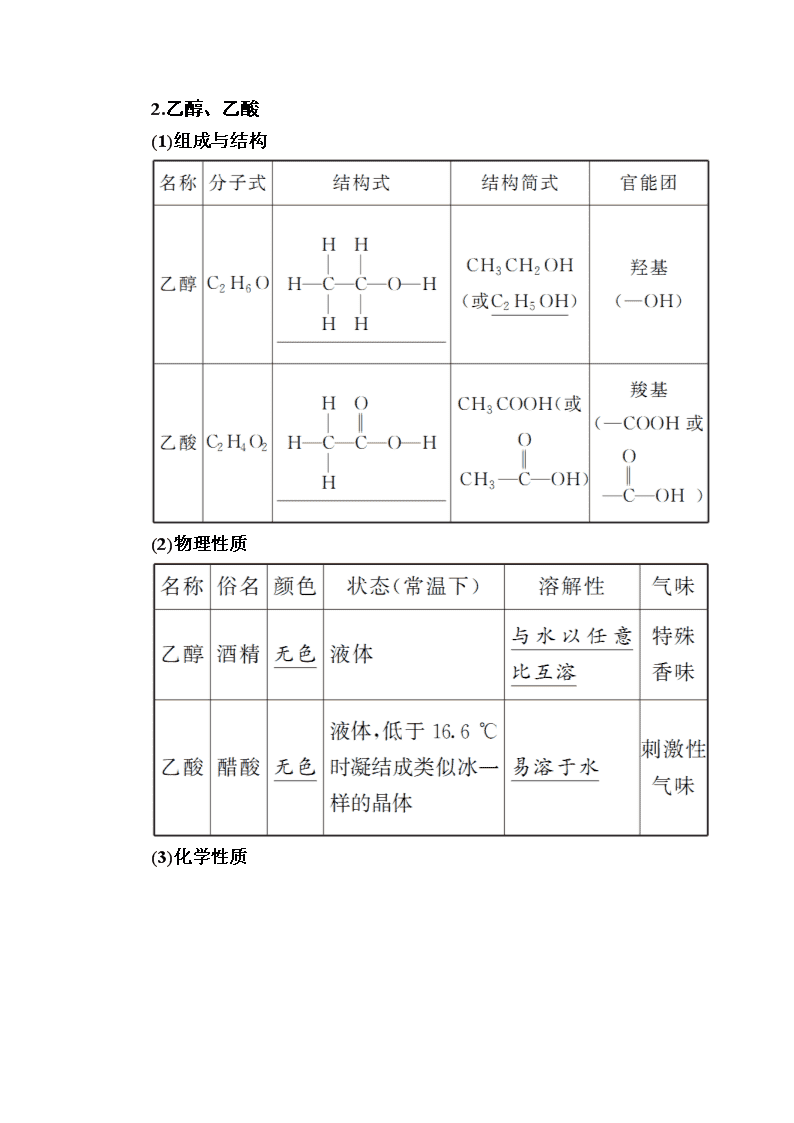
www.ks5u.com 第二节 生活中两种常见的有机物 基本营养物质 最新考纲:1.了解乙醇、乙酸的结构和主要性质及重要应用。2.了解糖类、油脂、蛋白质的组成和主要性质及重要应用。3.掌握常见有机反应类型。 核心素养:1.宏观辨识与微观探析:能从官能团角度认识乙醇、乙酸的组成、结构、性质和变化,形成“结构决定性质”的观念,并能从宏观和微观相结合的视角分析与解决实际问题。2.证据推理与模型认知:具有证据意识,能对乙醇、乙酸和基本的营养物质的组成、结构及其变化提出可能的假设,并能解释某些化学现象,揭示现象的本质和规律。3.科学精神与社会责任:通过高分子材料的合成等赞赏化学对社会发展的重大贡献;通过分析高分子材料的利弊建立可持续发展意识和绿色化学观念,并能对与此有关的社会热点问题作出正确的价值判断。 知识点一 乙醇、乙酸 1.烃的衍生物 (1)烃的衍生物:烃分子中的氢原子被其他原子或原子团所取代而生成的一系列化合物。 (2)官能团 ①概念:决定有机化合物的化学性质的原子或原子团。 ②常见几种官能团的名称和符号 2.乙醇、乙酸 (1)组成与结构 (2)物理性质 (3)化学性质 (4)用途 名称 用途 乙醇 燃料、饮料、化工原料;常用的溶剂;体积分数为75%时可作医用消毒 乙酸 化工原料,用于生产醋酸纤维、香料、染料、医药和农药等 3.乙醇的工业制法 (1)乙烯水化法 CH2===CH2+H2OCH3CH2OH(工业乙醇) 4.乙酸、水、乙醇、碳酸分子中羟基氢的活动性比较 判断正误(正确的打“√”,错误的打“×”) 1.制备乙酸乙酯时可用热的NaOH溶液收集产物以除去其中的乙酸( × ) 提示:乙酸乙酯在碱性条件下能水解。 2.可以用分液漏斗分离乙酸乙酯和乙醇 ( × ) 提示:乙醇与乙酸乙酯互溶。 3.乙酸和乙酸乙酯可用饱和Na2CO3溶液加以区别( √ ) 提示:乙酸与碳酸钠反应有气泡生成,乙酸乙酯与碳酸钠不反应。 4.乙醇与溴水或酸性高锰酸钾溶液反应生成乙酸( × ) 提示:乙醇不能与溴水发生氧化还原反应。 5.乙酸乙酯、油脂与NaOH溶液反应均有醇生成( √ ) 6.用食醋可除去热水壶内壁的水垢( √ ) 7.乙酸分子中含有羧基,可与NaHCO3溶液反应生成CO2( √ ) 8.由乙酸和乙醇制乙酸乙酯与由苯甲酸乙酯水解制苯甲酸和乙醇的反应类型相同( √ ) 1.工业乙醇含乙醇96%(体积分数),无水乙醇含乙醇99.5%(体积分数)以上,体积分数为75%的乙醇溶液可作医用酒精。 2.常用无水硫酸铜检验乙醇中是否含水,若无水硫酸铜变蓝则说明有水存在。 3.除去乙醇中少量水的方法:在乙醇中加入新制的生石灰再进行蒸馏。 4.乙醇的化学性质与羟基的关系 (1)与钠反应时,只断裂a处键。 (2)乙醇催化氧化时,断裂a和c两处键,形成碳氧双键。醇催化氧化时,与羟基相连的碳原子上含有两个氢原子时,生成醛;与羟基相连的碳原子上含有一个氢原子时,生成酮;不含有氢原子时,不能发生催化氧化反应。 (3)乙醇和乙酸发生酯化反应时只断裂a处键。 (4)乙醇生成乙烯时,断裂b和d两处键,形成碳碳双键。 5.—COOH的判断 能与NaHCO3或Na2CO3反应生成CO2的有机物分子中一定含有—COOH,反应关系为NaHCO3~—COOH~CO2或Na2CO3~2—COOH~CO2。 1.关于乙醇的下列说法正确的是( B ) A.同质量的乙醇和乙二醇()分别与足量的金属钠反应前者放出的氢气多 B.将铜片在酒精灯火焰上加热后插入到无水乙醇中,放置片刻,铜片质量最终不变 C.可以用乙醇从碘水中萃取单质碘 D.乙醇能与乙酸在一定条件下反应生成乙酸乙酯和水,说明乙醇具有碱性 解析:同质量的乙醇中羟基的物质的量比乙二醇少,放出的氢气也少,A错误;由于乙醇与水互溶,所以乙醇不能作为碘水的萃取剂,C错误;乙醇与乙酸的酯化反应,只能证明乙醇中有羟基并不能说明乙醇有碱性,D错误。 2.下列有关羧酸和酯的结构及性质的理解正确的是( B ) A.羧酸和酯的结构中均含有,故羧酸与酯性质相似 B.羧酸和酯均能发生取代反应 C.酯化反应中,羧酸断裂O—H键,水解反应中,酯断裂C—O键 D.羧酸和酯均易溶于水 解析:羧酸与酯结构相似,性质不同,A项错误;羧酸的酯化反应和酯的水解反应均为取代反应,B项正确;酯化反应和水解反应中,羧酸和酯均断裂C—O键,C项错误;酯一般难溶于水,D项错误。 3.(2020·山西临汾模拟)下列叙述不正确的是( B ) A.乙醇可以被氧化为乙酸,二者都能发生酯化反应 B.乙醇易燃烧,污染小,只能在实验室中作燃料 C.常在燃料乙醇中添加少量煤油用于区分食用乙醇和燃料乙醇,因为煤油具有特殊气味 D.除去乙醇中少量乙酸:加入足量生石灰蒸馏 解析:乙醇可以先氧化为乙醛,乙醛再氧化为乙酸,乙醇、乙酸都能发生酯化反应,A正确;乙醇易燃烧,污染小,乙醇除在实验室作燃料外,还可用于生产乙醇汽油,B错误;煤油有特殊气味,所以常在燃料乙醇中添加少量煤油用于区分食用乙醇和燃料乙醇,C正确;乙酸与CaO反应生成离子化合物醋酸钙,蒸馏时乙醇以蒸气形式逸出,得到纯净乙醇,故D正确。 4.(2020·青岛模拟)某有机物的结构简式如图所示,下列有关该有机物的说法中正确的是( D ) A.能和碳酸氢钠溶液反应的官能团有2种 B.1 mol该有机物最多能与2 mol H2发生加成反应 C.与互为同分异构体 D.既可以发生取代反应又可以发生氧化反应 解析:A项,能和碳酸氢钠溶液反应的官能团只有—COOH 1种;B项,—COOH中的碳氧双键不能和H2加成,1 mol该有机物最多只能与1 mol H2发生加成反应;C项,二者的分子式中氢原子个数不同,不是同分异构体;D项,该有机物中的醇羟基、羧基及饱和碳原子上的氢原子都可以发生取代反应,碳碳双键可以发生氧化反应。 5.(2020·河南名校考试)某有机物的结构如图所示,下列说法正确的是( C ) A.该有机物的分子式为C21H24O4 B.该有机物共有四种官能团,分别是:羟基、羧基、苯环、碳碳双键 C.该有机物最多消耗NaOH与NaHCO3的物质的量之比为1∶1 D.1 mol该有机物与足量金属钠反应,生成33.6 L氢气 解析:该有机物的不饱和度为9,该有机物的分子式为C21H26O4,A错误;该有机物中含有羟基、碳碳双键、羧基三种官能团,B错误;该有机物中只有—COOH能与NaOH和NaHCO3反应,该有机物最多消耗NaOH与NaHCO3物质的量之比为1∶1,C正确;该有机物中2个—OH和1个—COOH都能与金属Na反应,1 mol该有机物与足量金属Na反应生成1.5 mol H2,由于H2所处温度和压强未知,无法计算H2的体积,D错误。 6.(2020·河北三市联考)有机物M可用于合成香料,其结构简式如图所示。 下列有关说法不正确的是( C ) A.有机物M中有2种含氧官能团 B.1 mol有机物M可与1 mol NaOH发生反应 C.有机物M能与溴水发生加成反应 D.1 mol有机物M最多能与3 mol H2反应 解析:由题给有机物M的结构简式可知,M中含有羟基和酯基2种含氧官能团,A项正确;M中只有酯基能和NaOH发生反应,B项正确;M不能与溴水发生加成反应,C项错误;M中只有苯环能与氢气发生反应,故1 mol M最多能与3 mol氢气反应,D项正确。 7.乳酸的结构简式为。下列有关乳酸的说法不正确的是( B ) A.乳酸中能发生酯化反应的官能团有2种 B.1 mol乳酸可与2 mol NaOH发生中和反应 C.1 mol乳酸与足量金属Na反应可生成1 mol H2 D.有机物与乳酸互为同分异构体 解析:羧基(—COOH)与NaOH发生反应,醇羟基(—OH)与NaOH不反应,故1 mol乳酸可与1 mol NaOH发生中和反应。 素养 酯的实验室制备及拓展 1.组成和结构 2.性质 3.制备 (1)实验原理 该反应的特点如下: (2)实验装置 (3)实验步骤 在试管中加3 mL乙醇,然后边摇动试管边慢慢加入2 mL浓硫酸和2 mL冰醋酸。按(2)中图示连接实验装置。 用酒精灯小心均匀地加热试管3~5 min,产生的蒸气经导管通到饱和碳酸钠溶液的液面上。 (4)实验现象 饱和碳酸钠溶液的液面上有无色透明、有果香味的油状液体产生,并可闻到香味。 (5)注意事项 ①为防止试管中液体在受热时暴沸,盛反应液的试管要倾斜约45°,加热前在试管中加入几块碎瓷片或沸石。 ②玻璃导管的末端不要插入饱和Na2CO3溶液中,以防液体倒吸。 ③开始时要用小火均匀加热,加快反应速率,减少乙醇和乙酸的挥发;待有大量产物生成时,可大火加热,以便将产物蒸出。 ④装置中的长导管起导气兼冷凝作用。 ⑤饱和Na2CO3溶液的作用 挥发出的乙酸与Na2CO3 溶液反应生成易溶于水的盐,乙醇易溶于Na2CO3溶液,有利于乙酸乙酯与乙酸、乙醇的分离。另外乙酸乙酯在饱和Na2CO3溶液中的溶解度较小,与饱和Na2CO3溶液混合时易分层,可用分液法分离。 ⑥不能用NaOH溶液代替饱和Na2CO3溶液,因为NaOH溶液碱性很强,会使乙酸乙酯水解。 ⑦欲提高乙酸的转化率,可采取以下措施: a.用浓H2SO4吸水,使平衡向正反应方向移动; b.加热将酯蒸出; c.可适当增加乙醇的量,并加装冷凝回流装置。 4.有机实验中应注意的两大问题 (1)加热方面 ①用酒精灯加热:火焰温度一般在400~500 ℃,教材中的实验需要用酒精灯加热的有乙酸乙酯的制备、蒸馏石油的实验、石蜡的催化裂化实验。 ②水浴加热:乙酸乙酯的水解(70~80 ℃水浴)、蔗糖的水解(热水浴)。 (2)冷凝回流方向 当需要使被汽化的物质重新流回到反应容器中时,可通过在反应容器的上方添加一个长导管达到此目的(此时空气是冷凝剂),若需要冷凝的试剂沸点较低,则需要在容器的上方安装冷凝管,常选用球形冷凝管。 1.(2018·全国卷Ⅰ)在生成和纯化乙酸乙酯的实验过程中,下列操作未涉及的是( D ) 解析:A项装置用于制备乙酸乙酯,B项装置用于除去乙酸乙酯中的乙酸、乙醇(纯化),C项装置用于分离乙酸乙酯,D项装置用于蒸发浓缩或蒸发结晶。只有D项操作在制备和纯化乙酸乙酯的实验中未涉及。 2.1丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125 ℃,反应装置如右图,下列对该实验的描述错误的是( C ) A.不能用水浴加热 B.长玻璃管起冷凝回流作用 C.提纯乙酸丁酯需要经过水、氢氧化钠溶液洗涤 D.加入过量乙酸可以提高1丁醇的转化率 解析:该酯化反应需要的温度为115~125 ℃,水浴的最高温度为100 ℃,A项正确;长导管可以起到冷凝回流酸和醇的作用,B项正确;乙酸丁酯在氢氧化钠溶液中容易发生水解,C项错误;在可逆反应中,增加一种反应物的用量可以提高另一种反应物的转化率,D项正确。 3.如图所示为实验室制取少量乙酸乙酯的装置图。下列关于该实验的叙述中,不正确的是( A ) A.向试管a中先加入浓硫酸,然后边振荡试管边慢慢加入乙醇,再加入冰醋酸 B.试管b中导气管下端管口不能浸入液面以下的目的是防止实验过程中产生倒吸现象 C.实验时加热试管a的目的之一是及时将乙酸乙酯蒸出,使平衡向生成乙酸乙酯的方向移动 D.试管b中饱和Na2CO3溶液的作用是吸收随乙酸乙酯蒸出的少量乙酸和乙醇 解析:浓硫酸的密度大,与乙醇和乙酸混合时放出大量的热。三种物质混合顺序为将浓硫酸逐滴加入乙醇中,最后加入冰醋酸,故A不正确。 4.(2020·陕西咸阳模拟)某化学小组以苯甲酸为原料,制取苯甲酸甲酯,已知有关物质的相对分子质量和沸点如下表: 物质 甲醇 苯甲酸 苯甲酸甲酯 相对分子质量 32 122 136 沸点/℃ 64.7 249 199.6 Ⅰ.合成苯甲酸甲酯粗产品 在圆底烧瓶中加入12.2 g苯甲酸和20 mL甲醇(密度约为0.79 g·cm-3),再小心加入3 mL浓硫酸,混匀后投入几块碎瓷片,小心加热使反应完全,得苯甲酸甲酯粗产品。 (1)浓硫酸的作用是催化剂、吸水剂,若反应产物水分子中有同位素18O,写出能表示反应前后18O位置的化学方程式: C6H5CO18OH+CH3OHC6H5COOCH3+HO。 (2)该实验中甲醇过量的原因是甲醇比苯甲酸价廉,增加甲醇的量,平衡右移,可提高产率。 (3)甲和乙两位同学分别设计了如图所示的两套实验室合成苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去)。根据有机物的特点,最好采用甲(填“甲”或“乙”)装置。 Ⅱ.粗产品的精制 苯甲酸甲酯粗产品中往往含有少量甲醇、苯甲酸和水等,现拟用如图流程图进行精制。 (4)上述流程图中a、b所代表的实验操作名称分别为a:分液;b:蒸馏。 (5)通过计算,苯甲酸甲酯的产率为65%。 解析:(3)甲醇的沸点很低,为增大甲醇的利用率,故应采用冷凝回流装置。 (4)粗产品中有苯甲酸甲酯、苯甲酸、甲醇、水,用操作1可把混合物分离成水层、有机层,采用分液操作完成,有机层中根据沸点差异用蒸馏方法分离。 (5)12.2 g苯甲酸理论上完全转化时应生成13.6 g 苯甲酸甲酯,实际生成的是8.84 g,则转化率为×100%=65%。 知识点二 基本营养物质 1.糖类的性质 (1)葡萄糖(五羟基醛) (2)二糖(蔗糖、麦芽糖) 在稀酸催化下发生水解反应,如1 mol蔗糖水解生成1 mol葡萄糖和1 mol果糖,1 mol麦芽糖水解生成2 mol葡萄糖。 提醒:淀粉和纤维素都是天然高分子化合物。 2.油脂的性质 (1)油脂的水解 ①酸性条件下: ②碱性条件下: 油脂在碱性条件下的水解反应又叫皂化反应。 (2)油脂的氢化 油脂氢化在工业上用于生产硬化油,便于运输和储存。 3.蛋白质的性质 1.糖类物质在生产生活中的应用 葡萄糖 主要存在于水果、蔬菜和动物血液中,可用于食品加工、医疗输液、合成药物等 果糖 主要存在于水果、蔬菜中,可用于食品加工,医药生产等 蔗糖 主要存在于甘蔗和甜菜中,可用于制白糖、冰糖 麦芽糖 主要存在于麦芽中,可用于制甜味剂 淀粉 主要存在于植物的种子和块茎中,用于制葡萄糖和酒精等 纤维素 主要存在于植物的叶、茎和果皮中,可用于造纸、制造纤维素硝酸酯、纤维素乙酸酯、黏胶纤维、无烟火药、电影胶片的片基等 2.油脂在生产生活中的应用 (1)提供能量,保持体温和保护内脏器官。 (2)增加食物的风味。 (3)制肥皂和甘油。 3.蛋白质在生产生活中的应用 蛋白质不仅是重要的营养物质,在工业上也有广泛的用途,如纺织工业、制皮等。白明胶可用于照相,阿胶是一种药材。酪素是从牛奶中凝结出来的蛋白质,除用作食品外,还能跟甲醛合成酪素塑料,制生活用品。酶是一类特殊的蛋白质,是生物体内重要的催化剂。 判断正误(正确的打“√”,错误的打“×”) 1.木材纤维和土豆淀粉遇碘水均显蓝色( × ) 提示:木材纤维遇碘水不显蓝色。 2.淀粉和纤维素在酸催化下完全水解后的产物都是葡萄糖( √ ) 提示:淀粉与纤维素属于多糖,最终水解产物为葡萄糖。 3.葡萄糖、蛋白质都属于高分子化合物( × ) 提示:葡萄糖不属于高分子化合物。 4.糖类、油脂、蛋白质均可发生水解反应( × ) 提示:单糖不能发生水解反应。 5.纤维素在人体内可水解为葡萄糖,故可用作人类的营养物质( × ) 提示:人体中没有水解纤维素的酶,故纤维素不能作为人类的营养物质。 6.淀粉、纤维素和油脂都属于天然高分子化合物( × ) 提示:油脂不属于高分子化合物。 7.葡萄糖、果糖的分子式均为C6H12O6,二者互为同分异构体( √ ) 提示:葡萄糖与果糖互为同分异构体。 8.天然植物油常温下一般呈液态,难溶于水,有恒定的熔沸点( × ) 提示:植物油属于混合物,没有恒定的熔沸点。 1.油脂可在碱性条件下水解,厨房中可用热的纯碱溶液除油污。 2.油脂是混合物,没有固定的熔、沸点。 3.淀粉、纤维素和蛋白质属于天然高分子,而油脂不是。 4.淀粉和纤维素的分子通式均为(C6H10O5)n,但二者中的n值不同,二者不属于同分异构体。 5.书写糖类水解方程式时,要在反应物和生成物化学式下面注明其名称,如在C6H12O6分子式下面注明“葡萄糖”或“果糖”。 6.淀粉、蔗糖的水解实验是用稀硫酸作催化剂,而银镜反应或与新制Cu(OH)2悬浊液的反应必须在碱性条件下进行,所以检验淀粉或蔗糖的水解产物前应先加NaOH溶液调至碱性。而检验淀粉时,必须直接取淀粉水解后的溶液加入碘水,不能取加NaOH后的溶液,因为碘能与NaOH溶液反应。 7.蛋白质盐析和变性 (1)轻金属盐(或铵盐)溶液能使蛋白质发生盐析,蛋白质凝聚而从溶液中析出,盐析出来的蛋白质仍保持原有的性质和生理活性,盐析是物理过程,是可逆的。 (2)重金属盐溶液,不论是浓溶液还是稀溶液,均能使蛋白质变性,变性后的蛋白质不再具有原有的可溶性和生理活性,变化是化学过程,是不可逆的。 1.(2018·全国卷Ⅰ)下列说法错误的是( A ) A.蔗糖、果糖和麦芽糖均为双糖 B.植物油氢化过程中发生了加成反应 C.植物油含不饱和脂肪酸酯,能使Br2/CCl4褪色 D.淀粉和纤维素水解的最终产物均为葡萄糖 解析:果糖是单糖,A错误;植物油氢化是和氢气发生加成反应,B正确;不饱和高级脂肪酸酯中含有碳碳双键,可以和溴发生加成反应,C正确;淀粉和纤维素水解的最终产物都是葡萄糖,D正确。 2.(2017·全国卷Ⅲ)下列说法正确的是( A ) A.植物油氢化过程中发生了加成反应 B.淀粉和纤维素互为同分异构体 C.环己烷与苯可用酸性KMnO4溶液鉴别 D.水可以用来分离溴苯和苯的混合物 解析:植物油中含有不饱和键,可与氢气发生加成反应,俗称油脂的氢化或硬化,A项正确;淀粉和纤维素的化学式都为(C6H10O5)n,但二者的n值不同,不互为同分异构体,B项错误;环己烷和苯都不与酸性高锰酸钾溶液反应,且密度都小于酸性高锰酸钾溶液的密度,无法鉴别,C项错误;溴苯和苯互溶,且二者都不溶于水,故用水无法分离苯和溴苯,D项错误。 3.(2016·全国卷Ⅰ) 化学与生活密切相关。下列有关说法错误的是( D ) A.用灼烧的方法可以区分蚕丝和人造纤维 B.食用油反复加热会产生稠环芳烃等有害物质 C.加热能杀死流感病毒是因为蛋白质受热变性 D.医用消毒酒精中乙醇的浓度为95% 解析:A项,蚕丝属于蛋白质,灼烧时具有烧焦羽毛的气味,人造纤维是以天然纤维为原料经过溶解、纺丝加工制得的化学纤维,灼烧时没有烧焦羽毛的气味,正确;B项,食用油经过反复加热,可发生一系列复杂的化学变化,这些变化不仅使食用油的营养价值降低,还会产生对人们身体有毒害作用的不饱和脂肪酸聚合物、杂环胺和稠环芳烃等物质,正确;C项,病毒由遗传物质核酸和蛋白质外壳组成,加热可使蛋白质变性而杀死病毒,正确;D项,医用消毒酒精中乙醇的体积分数为75%,错误。 4.(2017·全国卷Ⅲ)下列说法不正确的是( B ) A.油脂的皂化反应属于取代反应 B.木材纤维和土豆淀粉遇碘水均显蓝色 C.用灼烧的方法鉴别纤维制品和蚕丝制品 D.果糖不含醛基,葡萄糖含醛基,但二者不能用新制Cu(OH)2悬浊液鉴别 解析:油脂的皂化反应是在碱性条件下的水解反应,属于取代反应,A正确;纤维素遇碘水不显蓝色,B错误;蚕丝属于蛋白质,灼烧后有烧焦的羽毛气味,C正确;果糖不含醛基,但仍能发生银镜反应,也能被新制Cu(OH)2悬浊液氧化,这是因为在碱性条件下,果糖可异构化为葡萄糖,D正确。 5.下列关于营养物质的说法正确的是( D ) A.淀粉液加稀H2SO4后加热,然后水解液加NaOH溶液中和,再加碘液,若溶液变蓝,证明淀粉没水解 B.鉴别矿物油和植物油的正确的方法是加水振荡,观察是否有分层现象 C.纤维素在人体内最终水解为葡萄糖之后被细胞利用 D.腐败的鱼、肉、蛋有硫化氢气体产生,说明蛋白质中含有硫元素 解析:淀粉可能部分水解,没水解的淀粉也与碘液反应使溶液变蓝,A错误;植物油与矿物油都不溶于水、密度都比水小,分层油层在上层,现象相同,无法区别,B错误;人体不能消化纤维素,C错误;因蛋白质中含有硫元素,腐败的蛋白质有H2S气体产生,D正确。 6.(2020·郑州高三模拟)下列有关物质的性质和应用正确的是( A ) A.油脂在酸性条件下水解生成高级脂肪酸和甘油 B.福尔马林可防腐,可用它保存海鲜产品 C.乙醇、糖类和蛋白质都是人体必需的营养物质 D.合成橡胶与光导纤维都属于有机高分子材料 解析:A项,油脂是高级脂肪酸甘油脂,酸性条件下水解生成高级脂肪酸和甘油,正确;B项,福尔马林可防腐,可用于保存动物标本,但不能用于食物防腐,错误;C项,乙醇不属于人体必需的营养物质,错误;D项,光导纤维的主要成分是二氧化硅,不是有机高分子材料,错误。 7.(2020·湖南衡东一中月考)某学生设计了四种实验方案并得出了自己的结论,其中实验方案设计及结论均正确的是( C ) 解析:A项,方案正确,结论错误,因为当淀粉部分水解时,残留的淀粉也会使碘水变蓝色;B、D项,方案设计及结论均不对,因为当水解液呈酸性时,加入的Cu(OH)2(或银氨溶液)首先与硫酸发生中和反应而无法与葡萄糖作用。查看更多