- 2021-04-21 发布 |
- 37.5 KB |
- 34页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
人教版九年级化学下册题1常见的酸和碱
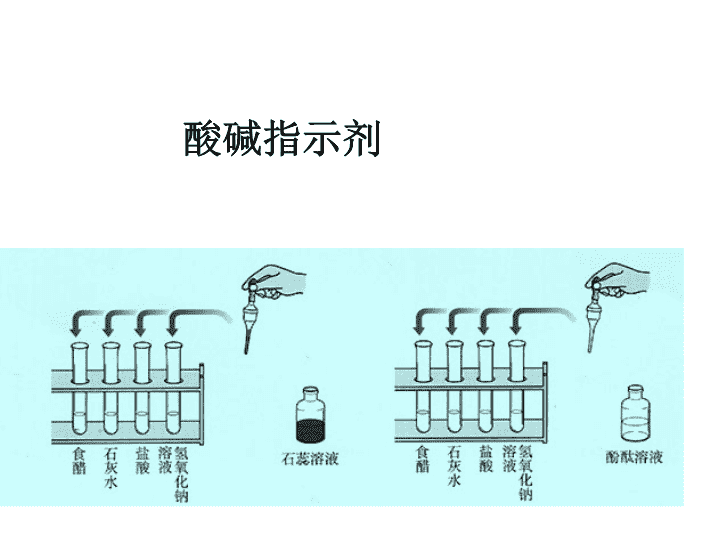
课 题 1 常 见 的 酸 和 碱 课题 1 常见的酸和碱 课 题 1 常 见 的 酸 和 碱 酸、甜、苦、辣 是我们生活中的味道,请问你们还知道哪些是具有酸味的物质吗? 这些物质中有很多存在一种很重要的物质:酸, 同时自然界还存在另一种物质:碱。 通过回忆说出你判断酸碱的方法? 1 、把二氧化碳通入 紫色石蕊 的试管中会看到什么现象?该现象说明了什么? 2 、在右图的实验中,可以看到什么 现象?这说明 酚酞试液 有什么性质? 紫色石蕊 遇碳酸 变红色 无色酚酞 遇浓氨水 变红色 酸碱指示剂 课 题 1 常 见 的 酸 和 碱 [ 实验 10-1] 加入紫色石蕊溶液后 的颜色变化 加入无色酚酞溶液后 的颜色变化 食 醋 石灰水 盐 酸 NaOH 溶液 变红色 变蓝色 变红色 变红色 变红色 变蓝色 不变色 不变色 结论: 1 、紫色石蕊溶液遇酸溶液变成红色, 遇碱溶液变成蓝色(即酸红碱蓝) 2 、酚酞遇酸溶液不变色 , 遇碱溶液变红色 指示剂 酸性溶液中的 颜色变化 中性溶液 中的颜色 碱性溶液中的 颜色变化 石蕊试液 酚酞试液 指示剂在不同溶液中的变色情况 无 色 无 色 变红色 变蓝色 变红色 紫 色 酸溶液 酸性溶液 ? NH 4 NO 3 溶液 Na 2 CO 3 溶液 酸溶液 酸性溶液 归 纳 与 分 析 课 题 1 常 见 的 酸 和 碱 1 、酸碱指示剂(指示剂)的概念 跟酸或碱的溶液起作用而显示 不同颜色 的物质。 2 、常用指示剂: 紫色石蕊溶液 和无色酚酞溶液 3 、变色规律 : 紫色石蕊溶液 遇酸溶液变成 红色 ,遇碱溶液变成 蓝色 (即 酸红 碱蓝 ) 无色酚酞溶液遇酸溶液不变色,遇碱溶液变成 红色 。 4 、指示剂的作用 : 能检验溶液的 酸碱性 5 、如何用酸碱指示剂检验溶液的酸碱性? 若溶液呈现红色,则说明该溶液为酸性溶液。 1 、取少量该溶液 2 、滴入几滴 石蕊 试液 若溶液呈现蓝色,则说明该溶液为碱性溶液。 课 题 1 常 见 的 酸 和 碱 讨论 :根据实验 10-1 的现象,试分析这 4 种物质中,哪些可能是酸溶液,哪些可能是碱溶液? 酸溶液: 碱溶液: 食醋、盐酸 石灰水、氢氧化钠溶液 练习 :有三瓶标签已失落的无色液体,它们分别是硫酸溶液、氢氧化钠溶液和蒸馏水,如何鉴别它们? 1 、用试管分别取三种溶液少量并编号( A 、 B 、 C ); 现象: 结论: 2 、分别滴入几滴紫色石蕊试液,观察颜色变化。 步骤: A 为 蓝色 , B 没有变化, C 为 红色 A 为氢氧化钠溶液, B 为蒸馏水, C 为硫酸溶液 课 题 1 常 见 的 酸 和 碱 指示剂 (汁液) 在不同溶液中的颜色变化 食 醋 石灰水 盐 酸 氢氧化钠 牵牛花 红色 蓝色 红色 蓝色 月季花 红色 草绿色 红色 草绿色 紫卷心菜 红色 绿色 红色 绿色 万寿菊 黄色 黄色 黄色 黄色 活动与探究步骤: 1 、取一种花( 月季花 )的花瓣,在研钵中捣烂,加入酒精(乙醇与水的体积比为 1∶1 )浸泡; 2 、用纱布将浸泡出的汁液过滤或挤出,得到指示剂; 3 、试验指示剂在上述 4 种溶液中和颜色变化; 4 、根据在溶液中的颜色变化是否明显来判断,能否作为指示剂使用。 课 题 1 常 见 的 酸 和 碱 许多植物的果实和花瓣中含有色素。现提取几种植物的果实或花瓣的汁液,用稀酸、稀碱和水逐一检验,现象记录如下表。 汁液 酸溶液 水 碱溶液 牵牛花 红色 紫色 蓝色 万寿菊 黄色 黄色 黄色 胡萝卜 橙色 橙色 橙色 玫瑰 浅红色 浅红色 绿色 (2) 手工制作一朵纸玫瑰花,用 pH=12 的某种溶液浸泡后晾干,用所提取的玫瑰的汁液均匀的涂在纸玫瑰花上,纸花会变成 色。 (3) 与实验中常用的指示剂石蕊的变色原理相似的是 ( 填植物的名称 ) (1) 上述植物的汁液不能用来区别稀硫酸和氢氧化钠溶液的是 、 。 ( 填植物的名称 ) 万寿菊 胡萝卜 绿 牵牛花 【 实验 】 如图所示,分别试验盐酸、硫酸、氢氧化钠溶液、氢氧化钙溶液、蒸馏水和乙醇的导电性。 能导电的溶液有 ( 灯亮 ) 不能导电的溶液有 ( 灯不亮 ) 盐酸 硫酸 氢氧化钠溶液 氢氧化钙溶液 蒸馏水 乙醇 HCl = H + + Cl - H 2 SO 4 =2H + +SO 4 2- 酸 =H + + 酸根离子 NaOH = Na + + OH - Ca(OH) 2 =Ca 2+ +2OH - 碱 = 金属离子 +OH - 在不同的酸溶液中都含有相同的 H + ,所以酸有一些相似的性质。 在不同的碱溶液中都含有相同的 OH — ,所以,碱也有一些相似的性质。 课 题 1 常 见 的 酸 和 碱 为什么不同的酸都能使紫色石蕊溶液变红色、无色酚酞溶液不变色?为什么不同的碱都能使紫色石蕊溶液变蓝色、无色酚酞溶液变红色?你知道其中的原因吗? 导电的物质: 盐酸、硫酸、氢氧化钠溶液、氢氧化钙溶液 说明上述四种溶液中存在着自由移动的粒子。 H Cl = H + + Cl - H 2 SO 4 = 2H + + SO 4 2- Na OH = Na + + OH - Ca( OH ) 2 = Ca 2+ + 2OH - 酸在溶液中能离解出 H + 和酸根离子 。在不同的酸溶液中都含有 H + 。 碱在溶液中能离解出 OH - 和金属离子 。在不同的碱溶液中都含有 OH - 。 酸 ( H + 酸根 ) 名称:某酸; 化学式: H 排头 (H 2 O 、 H 2 O 2 ) 碱 ( 金属 + OH ) 名称:氢氧化某; 化学式: OH 断后( C 2 H 5 OH ) 1. 常见的酸有盐酸( HCl )、硫酸 ( H 2 SO 4 ) 、碳酸( H 2 CO 3 )、醋酸( CH 3 COOH )等。从名称上判断最后一个字都是“酸”,即“某酸”;从结构上看都含有氢元素。 2 . 常见的碱有氢氧化钠( NaOH )、氢氧化钙 (Ca(OH) 2 ) 、氢氧化铝 (Al(OH) 3 ) 、一水合氨( NH3.H2O )等。除一水合氨,从名称上看都叫“氢氧化某”;从结构上看都含有氢氧根( OH )。 根据实验现象完成表格 浓盐酸 浓硫酸 颜色、状态 打开瓶盖后的现象 气味 无色、液体 无色、粘稠油状液体 无味 瓶口有白雾产生 无明显现象 ( 难挥发 ) 原因 : 浓盐酸挥发出 HCl 气体与空气中水蒸气结合形成盐酸的小液滴。 说明盐酸易挥发 有刺激性气味 1. 如何区分浓盐酸和浓硫酸 浓盐酸 特性 : 挥发性 2. 分别盛放浓盐酸和浓硫酸的两个试剂瓶,敞口放置一段时间后(不考虑水分的蒸发),两瓶酸的质量、质量分数各有何变化? 溶质质量 溶剂质量 溶质质量分数 浓盐酸 浓硫酸 减少 减小 增加 减小 不变 不变 密封保存 应如何保存? 3 、浓硫酸的特性: (做干燥剂:不能干燥 NH 3 ) (脱水性) ( 2 )腐蚀性: ( 1 )吸水性: 原因 : 浓硫酸可以夺取纸张、木材、布料、皮肤里的水分(脱去 H 、 O 两种元素结合成水),生成黑色的炭。 (炭化) (物理性质) (化学性质) 浓硫酸 特性 1 : 吸水性 用途: 做某些气体的干燥剂 —— 酸性干燥剂 通入液面下 H 2 、 H 2 O H 2 哪些气体能用 浓硫酸 来干燥?哪些不能用? 注意:长管进,短管出 (长进短出) 洗气瓶 能干燥 不能干燥: 碱性气体: NH 3 中性气体: H 2 、 O 2 酸性气体: CO 2 、 SO 2 、 HCl 4 、浓硫酸的稀释: 一定要把 浓硫酸 沿着烧杯的内壁慢慢注入 水 中,并用 玻璃棒 不断搅拌。 切不可将水倒入浓硫酸中 。 2. 盐酸和硫酸的用途: 用 途 盐 酸 重要化工产品。用于金属表面除锈、制药等;人体胃液中含有盐酸,可帮助消化。 硫 酸 重要化工原料。用于生产化肥、农药、火药、染料以及冶炼金属、冶炼石油和金属除锈等。 浓硫酸有吸水性,在实验室中常用它做干燥剂 (如 CO2 、 H2 、 O2 等) 但不能用来干燥氨气 。 思考 1: 如果不慎将浓硫酸沾到皮肤或衣服上,应怎样处理呢 ? 思考 2 : 如果将稀硫酸沾到皮肤或衣服上,是否也要进行这样的处理?为什么? 立即用大量水冲洗,然后涂上 3% ~ 5% 的碳酸氢钠溶液 。 浓盐酸 浓硫酸 性质 ① 纯净的浓盐酸是无色、有 刺激性气味、有酸味的液体; ②有强腐蚀性;③易挥发, 打开瓶口有白雾 ① 无色无味油状的液体;② 有强腐蚀性;③吸水性,可 作干燥剂;④脱水性 保存 因具有挥发性,需密封保存 因具有吸水性,需密封保存 [ 典例 ] ( 双选 ) 下列说法错误的是 ( ) A .浓盐酸和浓硫酸都应密封保存,因为它们都有挥发性 B .人的胃液中含有少量盐酸,可以促进食欲,帮助消化 C .浓盐酸和浓硝酸打开瓶口都有白雾 D .稀释浓硫酸时,应用玻璃棒引流将浓硫酸慢慢注入水中, 并不断搅拌 酸的化学性质 盐酸 (HCl) 稀硫酸 (H 2 SO 4 ) 与指示剂反应 紫色石蕊变 ________ ,酚酞 ________ 与金属单 质反应 ( 镁、锌、铁 ) Mg + 2HCl===MgCl 2 + H 2 ↑ ; ________________________ ; _________________________ Mg + H 2 SO 4 ===MgSO 4 + H 2 ↑ ; _________________________ ; __________________________ 现象 有 ________ 冒出,固体 ________ ,溶液 ________ 与金属氧化物 反应 _________________________ __________________________ 现象 固体 ________ ,溶液 ________________ Fe 2 O 3 + 6HCl===2FeCl 3 + 3H 2 O Fe 2 O 3 + 3H 2 SO 4 ===Fe 2 (SO 4 ) 3 + 3H 2 O 溶解 由无色变为黄色 1 . 石蕊遇酸变 __ ______ ,酚酞遇酸 ________ 。 2 . 金属单质+酸 ===__ ______ + ________( 金属的活泼性在 H 前面 ) 3 . 金属氧化物+酸 == = ________ + ________( 各元素化合价 反应前后无变化 ) 。 常见的碱 1 .几种常见的碱 (一)、氢氧化钠 (NaOH) 实验 现象 分析 观察氢氧化钠的颜色和状态 将氢氧化钠放在表面皿上,放置一会儿 将氢氧化钠放入盛有少量水的试管里,并用手触摸试管外壁 白色、固体 表面潮湿、溶解 吸收水份而潮解 感到较热 溶于水放出大量热 讨论: 氢氧化钠应如何保存?为什么? ① 物理性质: 氢氧化钠是白色固体,易溶于水,并放出大量热。 氢氧化钠在空气中易潮解 —— 可作某些气体的干燥剂 。 (是一种固态干燥剂),装置如图所示: ② 腐蚀性: 氢氧化钠有强烈的 腐蚀性, 所以,它的俗名叫做 苛性钠 、 火碱 或 烧碱 。 如果不慎将碱液沾到皮肤上,要用较多的水冲洗,再涂上硼酸溶液。 小结: 注意! 在使用氢氧化钠时必须十分小心,防止眼睛、皮肤、衣服被它腐蚀。实验时最好戴防护眼镜。 ③ 用途: 氢氧化钠是一种重要的化工原料,广泛应用于肥皂、石油、造纸、纺织和印染等工业。氢氧化钠能与油脂反应,在生活中可以用来去除油污,如炉具清洁剂中就含有氢氧化钠。 (二)、氢氧化钙 [Ca(OH) 2 ] 检验二氧化碳用的是什么试剂呢? 石灰水,它就是氢氧化钙的水溶液。 它可由生石灰 (CaO) 与水反应得到: CaO + H 2 O = Ca(OH) 2 反应中放出大量热。 [ 小结 ] : Ca(OH) 2 是一种白色粉末,俗称熟石、消石灰,微溶于水,其水溶液俗称为石灰水,有腐蚀性和涩味。 氢氧化钙的制取: 故: CaO 可作干燥剂(是一种常见的食品干燥剂) 蓝色 蓝色 红色 红色 碱的化学性质 ⑴ 碱与指示剂反应: 滴入紫色 石蕊 溶液后 滴入无色 酚酞 溶液后 氢氧化钠 溶液 氢氧化钙 溶液 碱 溶液 能使紫色石蕊溶液变 蓝色 ; 能使无色酚酞溶液变 红色 。 注: 不溶性碱不能形成溶液,故不能使指示剂变色。 [ 讨论 ] : 氢氧化钠溶液中能使指示剂变色,是什么粒子改变了指示剂的颜色?请提出你的猜想,并设计实验来验证你的猜想。 假设猜想: 猜想一:使酚酞变红的可能是 NaOH 溶液中的 水分子 ; 猜想二:使酚酞变红的可能是 NaOH 溶液中的 ; 猜想三:使酚酞变红的可能是 NaOH 溶液中的 ; 设计实验: 1 、取 2mL 蒸馏水,滴入几滴酚酞溶液。现象:溶液呈无色。说明猜 想 不正确; 2 、取 2mL 氯化钠,滴入几滴酚酞溶液。现象:溶液呈无色。说明猜 想 不正确; 实验结论: NaOH 溶液中滴入 使酚酞溶液变红,说明使酚酞变红的粒 子是 。 反思: 有人认为实验 1 不必做,理由是: 钠离子 氢氧根离子 一 二 氢氧根离子 实验 2 中氯化钠溶液中有水,若呈无色,可说明猜想一不正确。 ⑵ Ca(OH) 2 +CO 2 = CaCO 3 ↓+H 2 O ① 回忆:二氧化碳使澄清石灰水变浑浊 ② 氢氧化钠在空气中不仅吸收水分而潮解,还会与空气中的二氧化碳发生反应而变质: 2NaOH+CO 2 = Na 2 CO 3 +H 2 O 应用: 氢氧化钙能与空气中的二氧化碳反应,生成坚硬的碳酸钙。将氢氧化钙粘土和沙子混凝,用来做建筑材料,就是利用氢氧化钙的这一性质 。 所以,氢氧化钠必须密封保存。 讨论:上面两个反应有什么共同之处?三氧化硫、二氧化硫与碱的反应与上面的两个反应类似,试写出有关反应的化学方程式及应用: _________________________________ 碱与某些非金属氧化物反应生成盐和水 2NaOH+SO 3 = Na 2 SO 4 +H 2 O Ca(OH) 2 +SO 2 = CaSO 3 +H 2 O 用 NaOH 、 Ca(OH) 2 可用来除去工业废气中的 SO 2 、 SO 3 想想:如何检验是否变质? [ 讨论 ] : 怎样来设计实验来证明氢氧化钠和二氧化碳能之间发生了反应呢? [ 实验方案 ] : 盛氢氧化钠溶液 红墨水 ( 1 ): ( 2 ): 装 CO 2 水 NaOH+CO 2 ( 3 ):在反应后的剩余物质中加入稀盐酸,看有无汽泡产生(对生成物进行检验)。 [ 想一想 ] :上述实验方案是根据什么原理来验证明了它们之间发生了反应的? 实验 1 、 2 是利用在密闭容器内二氧化碳与氢氧化钠反应后,容器内的气压减小,使外界气压大于容器内的气压,从而产生一些现象。实验 3 是通过对生成物的检验来证明是否发生反应。 小结: 碱的化学性质 1 ,碱溶液能使紫色石蕊试液变蓝,使无色酚酞试液 变红。 2 ,碱 + 某些非金属氧化物 —— 化合物 + 水 1 .鉴别石灰水和氢氧化钠溶液可选用的试剂是 ( ) A 、酚酞溶液 B 、二氧化碳 C 、 CuO D 、稀盐酸 2 .纯净的氢氧化钠是一种 _______ 色固体,由于在空气里它不仅能吸收 _______ 而潮解,还能跟空气里的 ___________ 起反应而变质。所以,氢氧化钠必须 ________ 保存。写出有关反应的化学方程式: ______________________________ 。 向 变质的氢氧化钠 中加入足量的盐酸,可观察到的现象是 ______________________ ,写出所发生反应的化学方程式: _______________________________ _____________________________ 。 生石灰变质分析 ①取固体溶于水,有放热现象,溶液变浑浊, 则固体中含有 ②向①中混合液中滴加稀盐酸,若有气体产生,固体中含有 结论:固体中一定有 可能含有 2. ① 取固体溶于水,没有放热现象,则固体中没有 ②取①中混合液滴加酚酞,若溶液变红,则固体中含有 ③向②中反应液滴加稀盐酸,有气泡产生,则固体中含有 结论:固体中一定含有 一定没有 CaO CaCO 3 CaO Ca(OH) 2 CaCO 3 CaO 、 CaCO 3 Ca(OH) 2 Ca(OH) 2 、 CaCO 3 CaO 3. 某同学取生石灰样品,加水,再滴加无色酚酞,变红色,该同学得出:样品中一定含有 Ca(OH) 2 ,该说法是否正确,为什么? 不正确。生石灰和水反应会生成 Ca(OH) 2 ,也能使无色酚酞变红查看更多