2020届高考化学一轮复习(浙江) 微观结构与物质的多样性学案
专题七 微观结构与物质的多样性
挖命题
【考情探究】
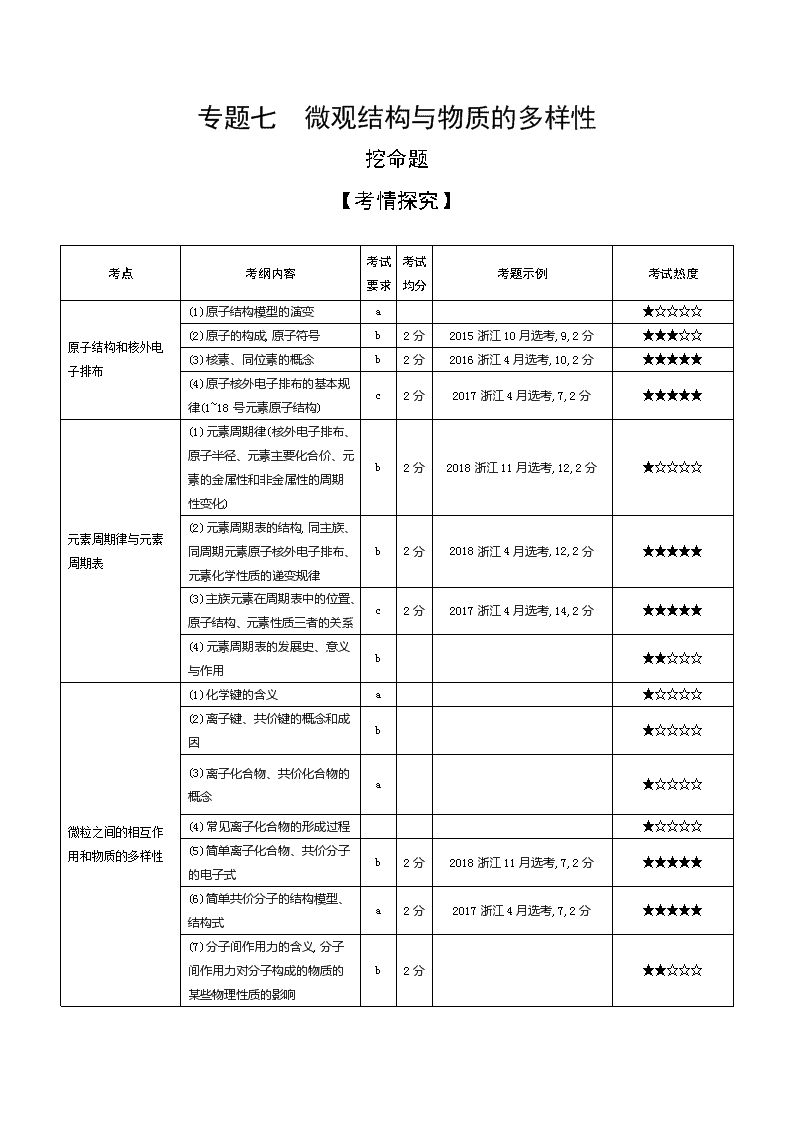
考点
考纲内容
考试
要求
考试
均分
考题示例
考试热度
原子结构和核外电子排布
(1)原子结构模型的演变
a
★☆☆☆☆
(2)原子的构成,原子符号
b
2分
2015浙江10月选考,9,2分
★★★☆☆
(3)核素、同位素的概念
b
2分
2016浙江4月选考,10,2分
★★★★★
(4)原子核外电子排布的基本规律(1~18号元素原子结构)
c
2分
2017浙江4月选考,7,2分
★★★★★
元素周期律与元素周期表
(1)元素周期律(核外电子排布、原子半径、元素主要化合价、元素的金属性和非金属性的周期性变化)
b
2分
2018浙江11月选考,12,2分
★☆☆☆☆
(2)元素周期表的结构,同主族、同周期元素原子核外电子排布、元素化学性质的递变规律
b
2分
2018浙江4月选考,12,2分
★★★★★
(3)主族元素在周期表中的位置、原子结构、元素性质三者的关系
c
2分
2017浙江4月选考,14,2分
★★★★★
(4)元素周期表的发展史、意义与作用
b
★★☆☆☆
微粒之间的相互作用和物质的多样性
(1)化学键的含义
a
★☆☆☆☆
(2)离子键、共价键的概念和成因
b
★☆☆☆☆
(3)离子化合物、共价化合物的概念
a
★☆☆☆☆
(4)常见离子化合物的形成过程
★☆☆☆☆
(5)简单离子化合物、共价分子的电子式
b
2分
2018浙江11月选考,7,2分
★★★★★
(6)简单共价分子的结构模型、结构式
a
2分
2017浙江4月选考,7,2分
★★★★★
(7)分子间作用力的含义,分子间作用力对分子构成的物质的某些物理性质的影响
b
2分
★★☆☆☆
(8)简单共价分子的空间结构和键能
a
★☆☆☆☆
(9)氢键的概念、形成条件和原因,氢键对物质性质的影响
b
★☆☆☆☆
(10)同素异形体和同素异形现象
b
2分
2017浙江4月选考,11,2分
★★★★★
(11)NaCl、金刚石、足球烯、干冰、石英中微粒的空间排列方式及相互间作用力
a
2分
2018浙江4月选考,19,2分
★★★★☆
(12)离子晶体、分子晶体、原子晶体、金属晶体的形成方式
a
★☆☆☆☆
(13)离子晶体、分子晶体、原子晶体、金属晶体的主要特性
a
★☆☆☆☆
分析解读 本专题知识是高考的热点,每年必考,常以选择题的形式出现。本专题知识考查点主要有三个方面:一是原子、分子的组成和结构,重点考查核素、核外电子的排布、分子结构模型、电子式的书写等知识;二是元素周期律和元素周期表,包括元素在周期表中位置的确定、元素种类的推断、元素性质的比较等;三是微粒间的相互作用,涉及离子键和共价键的比较及判断、几种常见晶体的组成和结构等。除考查元素周期律和元素周期表的试题有一定难度外,其余试题难度不大。预计本专题内容仍是今后高考考查的重点。
【真题典例】
破考点
【考点集训】
考点一 原子结构和核外电子排布
1.(2019届浙江温州瑞安中学学考模拟,7)下列有关化学用语的表示方法中正确的是( )
A.硫原子的结构示意图:
B.次氯酸的结构式:H—Cl—O
C.原子核内有10个中子的氧原子:818O
D.用电子式表示氯化氢分子的形成过程:H×+·O····:
答案 C
2.(2018浙江6月学考,9,2分)下列说法正确的是( )
A.1H2和2H2互为同素异形体
B.CH3Cl和CH2Cl2互为同系物
C.C60和C70互为同位素
D.C2H6和C3H8均不存在同分异构现象
答案 D
3.(2019届浙江温州乐清中学单元检测,4)关于26Al和10Be的说法不正确的是( )
A.10Be和9Be是中子数不同、质子数相同的不同原子
B.10Be的原子核内中子数比质子数多
C.5.2 g 26Al3+中所含的电子数约为1.2×1023
D.26Al和26Mg的质子数、中子数和核外电子数都不相同
答案 C
考点二 元素周期律与元素周期表
1.(2018天津理综,2,6分)下列有关物质性质的比较,结论正确的是( )
A.溶解度:Na2CO3
Y>W
B.简单阴离子的还原性:Z> W
C.气态氢化物的稳定性:W>Y
D.氧化物对应水化物的酸性:Z>Y
答案 D
考点三 微粒之间的相互作用和物质的多样性
1.(2018浙江6月学考,19,2分)下列说法不正确的是( )
A.液溴易挥发,是因为Br2分子间的作用力较小
B.熔点为112.8 ℃的硫晶体,硬度较小,属于原子晶体
C.氯化钠和氧化镁晶体所含化学键的类型相同
D.乙炔分子中碳原子的最外电子层具有8电子稳定结构
答案 B
2.(2019届浙江金华十校选考模拟,19)下列说法不正确的是( )
A.氯化钠熔化时离子键被破坏
B.HBr比HCl的热稳定性差,说明HBr的分子间作用力比HCl的弱
C.H2SO4、CCl4、NH3均属于共价化合物
D.石英熔化和干冰升华所破坏的作用力不相同
答案 B
3.(2019届浙江绍兴鲁迅中学单元检测,7)近年来,科学家合成了一系列具有独特化学性质的氢铝化合物(AlH3)n,常用作还原剂。已知,最简单的氢铝化合物的化学式为Al2H6,它的熔点为150 ℃且熔融状态不能导电,燃烧时放出大量的热量。Al2H6的球棍模型如图所示。下列说法正确的是( )
A.Al2H6中Al为-3价,H为+1价
B.Al2H6中含有离子键和极性共价键
C.Al2H6为离子化合物
D.Al2H6在空气中完全燃烧,产物为氧化铝和水
答案 D
炼技法
【方法集训】
方法 推断元素的思路和方法
1.(2018课标Ⅰ,12,6分)主族元素W、X、Y、Z的原子序数依次增加,且均不大于20。W、X、Z最外层电子数之和为10;W与Y同族;W与Z形成的化合物可与浓硫酸反应,其生成物可腐蚀玻璃。下列说法正确的是( )
A.常温常压下X的单质为气态
B.Z的氢化物为离子化合物
C.Y和Z形成的化合物的水溶液呈碱性
D.W与Y具有相同的最高化合价
答案 B
2.(2018江苏单科,8,2分)短周期主族元素X、Y、Z、W原子序数依次增大,X是地壳中含量最多的元素,Y原子的最外层只有一个电子,Z位于元素周期表ⅢA族,W与X属于同一主族。下列说法正确的是( )
A.原子半径:r(W)>r(Z)>r(Y)
B.由X、Y组成的化合物中均不含共价键
C.Y的最高价氧化物的水化物的碱性比Z的弱
D.X的简单气态氢化物的热稳定性比W的强
答案 D
3.(2019届浙江宁波镇海中学单元检测,13)叶蜡石是一种重要的化工原料,化学式为X2(Y4Z10)(ZW)2,X、Y、Z、W均为短周期元素,X与Y为同一周期相邻元素,Y的最外层电子数为次外层的一半,X为地壳中含量最多的金属元素,X的离子与(ZW)-含有相同的电子数。下列说法正确的是( )
A.原子半径:Y>X>Z>W
B.最简单氢化物的沸点:Y>Z
C.X与W形成的(XW4)-具有较强的还原性
D.可用NaOH溶液分离X、Y的最高价氧化物的混合物
答案 C
过专题
【五年高考】
A组 自主命题·浙江卷题组
考点一 原子结构和核外电子排布
1.(2018浙江11月选考,7,2分)下列表示不正确的是( )
A.Na+结构示意图
B.乙烷的比例模型
C.乙醛的结构简式CH3CHO
D.氯化钙的电子式[:Cl····:]-Ca2+[:Cl····:]-
答案 B
2.(2017浙江4月选考,7,2分)下列表示不正确的是( )
A.CO2的电子式 O····: :C::O····
B.Cl2的结构式Cl—Cl
C.CH4的球棍模型
D.Cl-的结构示意图
答案 C
3.(2017浙江4月选考,11,2分)下列说法正确的是( )
A.金刚石和石墨互为同素异形体,熔点和硬度都很高
B.氕、氘、氚是氢元素的三种核素,质子数都是1
C.乙醇和二甲醚(CH3—O—CH3)互为同系物
D.C6H14的一氯取代物只有一种
答案 B
4.(2016浙江4月选考,10,2分)下列说法不正确的是( )
A.612C和 614C是同一种核素
B.红磷和白磷互为同素异形体
C.CH3COOCH2CH3和CH3CH2COOCH3是不同种物质
D.CH3CH2OH可看成是由—C2H5和—OH两种基团组成的
答案 A
5.(2015浙江10月选考,9,2分)下列说法不正确的是( )
A.核素 12H的中子数是0
B.12C和14C互为同位素
C.金刚石、石墨和富勒烯互为同素异形体
D.CH3CH2OH和CH3OCH3互为同分异构体
答案 A
考点二 元素周期律与元素周期表
6.(2018浙江11月选考,12,2分)元素X、Y、Z和Q在周期表中的位置如图所示,其中元素Q位于第四周期,X、Y、Z原子的最外层电子数之和为17,下列说法不正确的是( )
X
Y
Z
Q
A.原子半径(r):r(Q)>r(Y)>r(Z)
B.元素X有-4、+2、+4等多种价态
C.Y、Z的氧化物对应的水化物均为强酸
D.可以推测H3QO4是Q的最高价氧化物的水化物
答案 C
7.(2018浙江6月学考,11,2分)五种主族元素X、Y、Z、M和N在周期表中的位置如图所示。下列说法正确的是( )
X
Y
Z
M
N
……
A.M的原子半径比N小
B.Y和Z既可形成Z2Y,也可形成Z2Y2
C.X2M的热稳定性比X2Y强
D.M和N的氧化物的水化物均为强酸
答案 B
8.(2017浙江4月选考,14,2分)W、X、Y、Z四种短周期元素,它们在周期表中位置如图所示,下列说法不正确的是( )
W
X
Y
Z
A.Z、Y、X的原子半径依次减小,非金属性依次降低
B.Z、Y、W的最高价氧化物的水化物的酸性依次降低
C.WH4与Z元素的单质在一定条件下可发生化学反应
D.W的位置是第2周期、第ⅣA族
答案 A
9.(2016浙江10月选考,14,2分)W、X、Y、Z四种短周期元素,它们在周期表中的位置如图所示,下列说法不正确的是( )
X
W
Y
Z
A.W、Y、X三种元素的原子半径依次减小
B.Z元素的气态氢化物的热稳定性比Y的高
C.W元素与氢元素可能会形成W2H6
D.Y元素的单质能从NaZ溶液中置换出Z元素的单质
答案 D
10.(2016浙江理综,9,6分)短周期主族元素X、Y、Z、W的原子序数依次增大,X原子核外最外层电子数是其电子层数的2倍,X、Y的核电荷数之比为3∶4。W-的最外层为8电子结构。金属单质Z在空气中燃烧生成的化合物可与水发生氧化还原反应。下列说法正确的是( )
A.X与Y能形成多种化合物,一般条件下都能与Z的最高价氧化物的水化物发生反应
B.原子半径大小:XW
C.化合物Z2Y和ZWY3都只存在离子键
D.Y、W的某些单质或两元素之间形成的某些化合物可作水的消毒剂
答案 D
11.(2016浙江4月选考,14,2分)现有W、X、Y、Z、M、N六种主族元素,它们在周期表中的位置如图所示,下列说法不正确的是 ( )
W
X
Y
Z
M
……
N
A.原子半径:Y>Z>W
B.单质的还原性:X>Y
C.Br与元素M同主族,最高价氧化物的水化物的酸性Br比M的强
D.元素N位于金属与非金属的分界线附近,可以推断N元素的单质可作半导体材料
答案 C
12.(2015浙江10月选考,6,2分)硅元素在周期表中的位置是( )
A.第二周期ⅣA族 B.第三周期ⅣA族
C.第三周期ⅥA族 D.第二周期ⅥA族
答案 B
13.(2015浙江10月选考,23,2分)右图为元素周期表中短周期主族非金属元素的一部分,下列说法不正确的是( )
A.W的原子序数可能是Y的两倍
B.Z的原子半径比X的大
C.Y元素的非金属性比Z元素的强
D.Z的最高价氧化物对应水化物的酸性比W的强
答案 D
考点三 微粒之间的相互作用和物质的多样性
14.(2018浙江11月选考,8,2分)下列说法正确的是( )
A.CaO与水反应过程中,有共价键的断裂和形成
B.H2O的热稳定性比H2S强,是由于H2O的分子间作用力较大
C.KCl、HCl、KOH的水溶液都能导电,所以它们都属于离子化合物
D.葡萄糖、二氧化碳和足球烯(C60)都是共价化合物,它们的晶体都属于分子晶体
答案 A
15.(2018浙江6月学考,8,2分)下列表示正确的是( )
A.硅原子的结构示意图:
B.四氯化碳的结构式:CCl4
C.氢气的比例模型:
D.氨基的电子式:H:NH ···
答案 A
16.(2018浙江4月选考,19,2分)下列说法正确的是( )
A.CaCl2中既有离子键又有共价键,所以CaCl2属于离子化合物
B.H2O汽化成水蒸气、分解为H2和O2,都需要破坏共价键
C.C4H10的两种同分异构体因为分子间作用力大小不同,因而沸点不同
D.水晶和干冰都是共价化合物,均属于原子晶体
答案 C
17.(2017浙江11月选考,20,2分)下列说法不正确的是( )
A.Mg2+和S2-的最外电子层都形成了8个电子的稳定结构
B.石英和金刚石都是原子间通过共价键结合形成的原子晶体
C.浓H2SO4和H2O混合时放出热量与微粒之间的作用力有关
D.H2O2易分解是因为H2O2分子间作用力弱
答案 D
18.(2017浙江4月选考,20,2分)下列说法正确的是( )
A.干冰和石英晶体中的化学键类型相同,熔化时需克服微粒间的作用力类型也相同
B.化学变化发生时,需要断开反应物中的化学键,并形成生成物中的化学键
C.CH4和CCl4中,每个原子的最外层都具有8电子稳定结构
D.NaHSO4晶体溶于水时,离子键被破坏,共价键不受影响
答案 B
19.(2016浙江10月选考,7,2分)下列表示正确的是( )
A.氯化钠的电子式:Na:Cl····:
B.二氧化碳的结构式:O—C—O
C.S2-的结构示意图:
D.葡萄糖的分子式:C6H12O6
答案 D
20.(2016浙江10月选考,20,2分)下列说法不正确的是( )
A.Cl2、Br2、I2的分子间作用力依次减小
B.石英是由硅原子和氧原子构成的原子晶体,加热熔化时需破坏共价键
C.氢氧化钠在熔融状态下离子键被削弱,形成自由移动的离子,具有导电性
D.水电解生成氢气和氧气,有化学键的断裂和形成
答案 A
21.(2016浙江4月选考,7,2分)下列表示正确的是( )
A.CO2的电子式::O····::C::O····:
B.乙炔的结构式:
C.CH4的球棍模型:
D.Cl-的结构示意图:
答案 D
22.(2016浙江4月选考,20,2分)下列说法正确的是( )
A.MgF2晶体中的化学键是共价键
B.某物质在熔融态能导电,则该物质中一定含有离子键
C.N2和Cl2两种分子中,每个原子的最外层都具有8电子稳定结构
D.干冰是分子晶体,其溶于水生成碳酸的过程只需克服分子间作用力
答案 C
23.(2015浙江10月选考,7,2分)下列化学用语表述正确的是( )
A.水分子的结构式:
B.氯化钠的电子式:Na:Cl····:
C.氯气的比例模型:
D.硫原子的结构示意图:
答案 A
24.(2015浙江10月选考,15,2分)下列说法正确的是( )
A.HCl属于共价化合物,溶于水能电离出H+和Cl-
B.NaOH是离子化合物,该物质中只含有离子键
C.HI气体受热分解的过程中,只需克服分子间作用力
D.石英和干冰均为原子晶体
答案 A
B组 统一命题、省(区、市)卷题组
考点一 原子结构和核外电子排布
1.(2018江苏单科,2,2分)用化学用语表示NH3+HCl NH4Cl 中的相关微粒,其中正确的是( )
A.中子数为8 的氮原子:78N B.HCl 的电子式:H+[:Cl····:]-
C.NH3的结构式: D.Cl-的结构示意图:
答案 C
2.(2017北京理综,7,6分)2016年IUPAC命名117号元素为Ts(中文名“”,tián),Ts的原子核外最外层电子数是7。下列说法不正确的是( )
A.Ts是第七周期第ⅦA族元素
B.Ts的同位素原子具有相同的电子数
C.Ts在同族元素中非金属性最弱
D.中子数为176的Ts核素符号是 117176Ts
答案 D
3.(2016课标Ⅱ,9,6分)a、b、c、d为短周期元素,a的原子中只有1个电子,b2-和c+离子的电子层结构相同,d与b同族。下列叙述错误的是( )
A.a与其他三种元素形成的二元化合物中其化合价均为+1
B.b与其他三种元素均可形成至少两种二元化合物
C.c的原子半径是这些元素中最大的
D.d与a形成的化合物的溶液呈弱酸性
答案 A
考点二 元素周期律与元素周期表
4.(2018课标Ⅲ,13,6分)W、X、Y、Z均为短周期元素且原子序数依次增大,元素X和Z同族。盐YZW与浓盐酸反应,有黄绿色气体产生,此气体同冷烧碱溶液作用,可得到含YZW的溶液。下列说法正确的是( )
A.原子半径大小为Wc>b>a
B.4种元素中b的金属性最强
C.c的氧化物的水化物是强碱
D.d单质的氧化性比a单质的氧化性强
答案 B
6.(2017课标Ⅲ,12,6分)短周期元素W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21。下列关系正确的是( )
W
X
Y
Z
A.氢化物沸点:WW
C.化合物熔点:Y2X3b>a
B.a和其他3种元素均能形成共价化合物
C.d和其他3种元素均能形成离子化合物
D.元素a、b、c各自最高和最低化合价的代数和分别为0、4、6
答案 B
3.(2015江苏单科,2,2分)下列有关氯元素及其化合物的表示正确的是( )
A.质子数为17、中子数为20的氯原子:1720Cl
B.氯离子(Cl-)的结构示意图:
C.氯分子的电子式::Cl····:Cl····:
D.氯乙烯分子的结构简式:H3C—CH2Cl
答案 C
考点二 元素周期律与元素周期表
4.(2017课标Ⅰ,12,6分)短周期主族元素W、X、Y、Z的原子序数依次增大,W的简单氢化物可用作制冷剂,Y的原子半径是所有短周期主族元素中最大的。由X、Y和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气体产生。下列说法不正确的是( )
A.X的简单氢化物的热稳定性比W的强
B.Y的简单离子与X的具有相同的电子层结构
C.Y与Z形成化合物的水溶液可使蓝色石蕊试纸变红
D.Z与X属于同一主族,与Y属于同一周期
答案 C
5.(2016课标Ⅰ,13,6分)短周期元素W、X、Y、Z的原子序数依次增加。m、p、r是由这些元素组成的二元化合物。n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01 mol·L-1r 溶液的pH为2,s通常是难溶于水的混合物。上述物质的转化关系如图所示。下列说法正确的是( )
A.原子半径的大小WX>Y
C.Y的氢化物常温常压下为液态
D.X的最高价氧化物的水化物为强酸
答案 C
6.(2016江苏单科,4,2分)短周期主族元素X、Y、Z、W原子序数依次增大,X原子的最外层有6个电子,Y是迄今发现的非金属性最强的元素,在周期表中Z位于ⅠA族,W与X属于同一主族。下列说法正确的是( )
A.元素X、W的简单阴离子具有相同的电子层结构
B.由Y、Z两种元素组成的化合物是离子化合物
C.W的简单气态氢化物的热稳定性比Y的强
D.原子半径:r(X)Z>Y>X
B.最高价氧化物对应水化物的酸性:X>W>Z
C.最简单气态氢化物的热稳定性:Y>X>W>Z
D.元素X、Z、W的最高化合价分别与其主族序数相等
答案 A
8.(2015广东理综,23,6分)(双选)甲~庚等元素在周期表中的相对位置如表所示。己的最高价氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数。下列判断正确的是( )
A.丙与戊的原子序数相差28
B.气态氢化物的稳定性:庚<己<戊
C.常温下,甲和乙的单质均能与水剧烈反应
D.丁的最高价氧化物可用于制造光导纤维
答案 AD
9.(2015课标Ⅰ,12,6分)W、X、Y、Z均为短周期主族元素,原子序数依次增加,且原子核外L电子层的电子数分别为0、5、8、8,它们的最外层电子数之和为18。下列说法正确的是( )
A.单质的沸点:W>X
B.阴离子的还原性:W>Z
C.氧化物的水化物的酸性:YZ
C.Z、W均可与Mg形成离子化合物
D.最高价氧化物对应水化物的酸性:Y>W
答案 C
11.(2016天津理综,7,14分)下表为元素周期表的一部分。
碳
氮
Y
X
硫
Z
回答下列问题:
(1)Z元素在周期表中的位置为 。
(2)表中元素原子半径最大的是(写元素符号) 。
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是 。
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1 mol Y单质比1 mol S得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)X与Z两元素的单质反应生成1 mol X的最高价化合物,恢复至室温,放热687 kJ,已知该化合物的熔、沸点分别为-69 ℃和58 ℃。写出该反应的热化学方程式:
。
(5)碳与镁形成的1 mol化合物Q与水反应,生成2 mol Mg(OH)2和1 mol烃,该烃分子中碳氢质量比为9∶1,烃的电子式为 。Q与水反应的化学方程式为 。
(6)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由上表中两种元素组成,气体的相对分子质量都小于50。为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1 L 2.2 mol·L-1 NaOH溶液和1 mol O2,则两种气体的分子式及物质的量分别为 ,生成硫酸铜物质的量为 。
答案 (14分)(1)第三周期,ⅦA族
(2)Si
(3)ac
(4)Si(s)+2Cl2(g) SiCl4(l) ΔH=-687 kJ·mol-1
(5)H:C⋮⋮C:C··HH··:H
Mg2C3+4H2O 2Mg(OH)2+C3H4↑
(6)NO 0.9 mol,NO2 1.3 mol 2 mol
12.(2015天津理综,7,14分)随原子序数递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。
根据判断出的元素回答问题:
(1)f在周期表中的位置是 。
(2)比较d、e常见离子的半径大小(用化学式表示,下同): > ;比较g、h的最高价氧化物对应水化物的酸性强弱: > 。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式: 。
(4)已知1 mol e的单质在足量d2中燃烧,恢复至室温,放出255.5 kJ热量,写出该反应的热化学方程式:
。
(5)上述元素可组成盐R:zx4f(gd4)2。向盛有10 mL 1 mol·L-1 R溶液的烧杯中滴加1 mol ·L-1 NaOH溶液,沉淀物质的量随NaOH溶液体积的变化示意图如下:
①R溶液中,离子浓度由大到小的顺序是 。
②写出m点反应的离子方程式: 。
③若在R溶液中改加20 mL 1.2 mol·L-1 Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为 mol。
答案 (14分)(1)第三周期ⅢA族
(2)r(O2-) r(Na+) HClO4 H2SO4
(3)H:N··H ··:H(或H:O····:O····:H H:C⋮⋮C:H等其他合理答案均可)
(4)2Na(s)+O2(g) Na2O2(s) ΔH=-511 kJ·mol-1
(5)①c(SO42-)>c(NH4+)>c(Al3+)>c(H+)>c(OH-)
②NH4++OH- NH3·H2O ③0.022
考点三 微粒之间的相互作用和物质的多样性
13.(2016江苏单科,2,2分)下列有关化学用语表示正确的是( )
A.中子数为10的氧原子:810O
B.Mg2+的结构示意图:
C.硫化钠的电子式:Na:S····:Na
D.甲酸甲酯的结构简式:C2H4O2
答案 B
14.(2015上海单科,6,3分)将Na、Na2O、NaOH、Na2S、Na2SO4分别加热熔化,需要克服相同类型作用力的物质有( )
A.2种 B.3种 C.4种 D.5种
答案 C
15.(2015上海单科,11,3分)下列有关物质性质的比较,错误的是( )
A.溶解度:小苏打<苏打 B.密度:溴乙烷>水
C.硬度:晶体硅<金刚石 D.碳碳键键长:乙烯>苯
答案 D
【三年模拟】
一、选择题(每小题2分,共26分)
1.(2019届浙江诸暨中学高三阶段考试,7)下列表示正确的是( )
A.中子数为20的Ar原子:1820Ar
B.硝基苯的结构简式:
C.次氯酸的电子式:H:Cl····:O····:
D.CH4的比例模型:
答案 D
2.(2019届浙江衢州二中选考模拟,11)下列叙述正确的是( )
A.CH3CH2OH和CH3—O—CH3互为同分异构体
B.CH3—CH CH—CH3与C4H8互为同系物
C.金刚石、石墨互为同位素
D.3He和4He互为同素异形体
答案 A
3.(2018浙江宁波镇海中学高一期始,3)美国夏威夷联合天文中心的科学家发现了新型氢微粒,这种新微粒是由3个氕原子核(只含质子)和2个电子构成的,对于这种微粒,下列说法中正确的是( )
A.是氢的一种新的同素异形体
B.是氢的一种新的同位素
C.它的组成可用H3表示
D.它比一个普通H2分子多一个氢原子核
答案 D
4.(2018浙江宁波新高考选考适应性考试,20)下列说法正确的是 ( )
A.Na2SO4晶体中只含离子键
B.HCl、HBr、HI分子间作用力依次增大
C.金刚石是原子晶体,加热熔化时需克服共价键与分子间作用力
D.NH3和CO2两种分子中,每个原子的最外层都达到了8电子稳定结构
答案 B
5.(2018浙江名校协作体高三期始联考,20)下列说法正确的是( )
A.BF3和NCl3分子中,每个原子的最外层都达到了8电子稳定结构
B.干冰和石英晶体的物理性质差别很大的原因是所属的晶体类型不同
C.NaOH熔化的过程中,既破坏了离子键又破坏了共价键
D.常温常压下,H2O是液态,H2S是气态,说明H2O的热稳定性更好
答案 B
6.(2019届浙江诸暨中学高三阶段考试,20)下列说法正确的是( )
A.H2O的沸点比H2S高,所以H2O比H2S更稳定
B.干冰和石英晶体中的化学键类型相同,熔化时需克服微粒间的作用力类型也相同
C.N2和CCl4分子中,每个原子的最外层都具有8电子稳定结构
D.NaHCO3受热分解的过程中,只有离子键被破坏
答案 C
7.(2019届浙江宁波余姚中学单元检测,10)二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫
化剂,其分子结构如图所示。常温下,S2Cl2遇水易发生反应,并产生能使品红溶液褪色的
气体,下列说法中错误的是( )
A.S2Cl2的结构式为Cl—S—S—C l
B.S2Cl2与水反应时只有S—Cl键断裂
C.S2Br2分子中含有极性键和非极性键
D.S2Cl2与H2O反应的化学方程式可能为2S2Cl2+2H2O SO2↑+3S↓+4HCl
答案 B
8.(2018浙江名校协作体高三期始联考,13)下图为元素周期表的一部分,下列说法不正确的是( )
A.原子半径:X>Y
B.X、M的简单离子的电子层结构相同
C.M最高价氧化物的水化物酸性比N的强
D.W的简单氢化物比Z的简单氢化物稳定
答案 C
9.(2019届浙江名校协作体高三期始联考,12)如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子序数之和为46。下列说法正确的是( )
X
Y
W
Z
T
A.X、Y、Z三种元素最低价氢化物的沸点依次升高
B.原子半径(r)大小比较:r(Y)>r(X)
C.物质WY2、WZ4均有熔点高、硬度大的特性
D.T元素的单质具有半导体的特性,T与Y元素可形成化合物TY2
答案 D
10.(2019届浙江金华十校选考模拟,12)四种短周期元素X、Y、Z和W在周期表中的位置如图所示,这四种元素的原子最外层电子数之和为24。下列说法不正确的是( )
A.原子半径(r)大小比较r(X)>r(Y)
B.X和W可形成共价化合物XW3
C.W的非金属性比Z的强,所以W氢化物的沸点比Z的高
D.Z的最低价单核阴离子的失电子能力比Y的强
答案 C
11.(2018浙江衢州二中高一期末,13)被誉为“矿石熊猫”的香花石,由我国地质学家首次发现,它由前20号元素中的6种主族元素组成,其化学式可表示为Y2X3(ZWR4)3T2,其中X、Y、Z为金属元素,Z原子的最外层电子数与次外层电子数相等,X、Z位于同主族,Y、Z、R、T位于同周期,R原子最外层电子数是次外层电子数的3倍,T无正价,X与R的原子序数之和是W的2倍。下列说法错误的是( )
A.原子半径:Y>Z>R>T
B.气态氢化物的稳定性:WZ
D.XR2、WR2两种化合物中R的化合价相同
答案 D
12.(2018浙江宁波新高考选考适应性考试,13)X、Y、Z、M、R为五种短周期元素 ,其原子半径和最外层电子数之间的关系如图所示 ,其中R元素是短周期中除稀有气体元素之外原子半径最大的元素。下列说法正确的是( )
A.M元素在周期表中的位置是第 2周期第ⅥA族
B.元素的最高价氧化物对应水化物的酸性:ZQ+>R2+
D.Z与M的最高价氧化物对应水化物分别为强酸和弱酸
答案 B
二、非选择题(共24分)
14.(2019届浙江东阳中学单元检测,21)(12分)A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子;B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E同主族。
(1)B在周期表中的位置为第 周期第 族。
(2)E元素形成的氧化物对应的水化物的化学式为 。
(3)元素B、C、D、E形成的简单离子半径大小关系是 (用离子符号表示)。
(4)用电子式表示化合物D2C的形成过程: 。
(5)由A、B、C三种元素形成的离子化合物的化学式为 ,它与强碱溶液共热,发生反应的离子方程式是 。
(6)D2EC3在一定条件下可以发生分解反应生成两种盐,其中一种产物为无氧酸盐,则此反应的化学方程式为
(化学式用具体的元素符号表示)。
答案 (1)2 ⅤA (2)H2SO3、H2SO4
(3)S2->N3->O2->Na+
(4)
(5)NH4NO3 NH4++OH- NH3↑+H2O
(6)4Na2SO3Na2S+3Na2SO4
15.(12分)元素周期表的形式多种多样,下图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,并回答下列问题:
(1)若①~⑩分别代表十种元素,则⑩代表的元素处于常见元素周期表的位置是 。
(2)⑥、⑦为生活中两种常见的金属元素,其单质的熔点⑥ ⑦(填“>”“<”或“=”);比较元素⑧、⑨对应的常见单质氧化性的强弱,并用化学反应方程式阐明: 。
(3)写出一种由①、④、⑤三种元素形成的常见无机化合物(填化学式): ,该物质溶于水后对水的电离起 作用(填“抑制”“促进”或“不影响”),其原因是
。
(4) ①、③、⑤三种元素形成的18电子结构化合物是近年来燃料电池研究领域的新宠,写出用它作燃料,②的最高价氧化物对应的水化物作为电解质的燃料电池的负极反应:
(5) 。
(5)用电子式表示④的一种10电子结构氢化物的形成过程: 。
答案 (1)第4周期第Ⅷ族 (2)< 氯气的氧化性大于硫单质,Cl2+H2S 2HCl+S↓能够自发进行(其他合理答案也可) (3)HNO3 抑制 HNO3电离产生H+,抑制水的电离(或HNO2 抑制 HNO2电离产生H+,抑制水的电离;或NH3·H2O 抑制 NH3·H2O电离产生OH-,抑制水的电离;或NH4NO3 促进 NH4NO3电离产生的NH4+与水电离出的OH-结合生成NH3·H2O,促进水的电离) (4)CH3OH-6e-+8OH- CO32-+6H2O (5)3H·+·N···· H:N··H ··:H