- 2021-04-21 发布 |
- 37.5 KB |
- 7页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届浙江学考一轮复习考点精讲通用版考点65物质的制备与定量分析学案
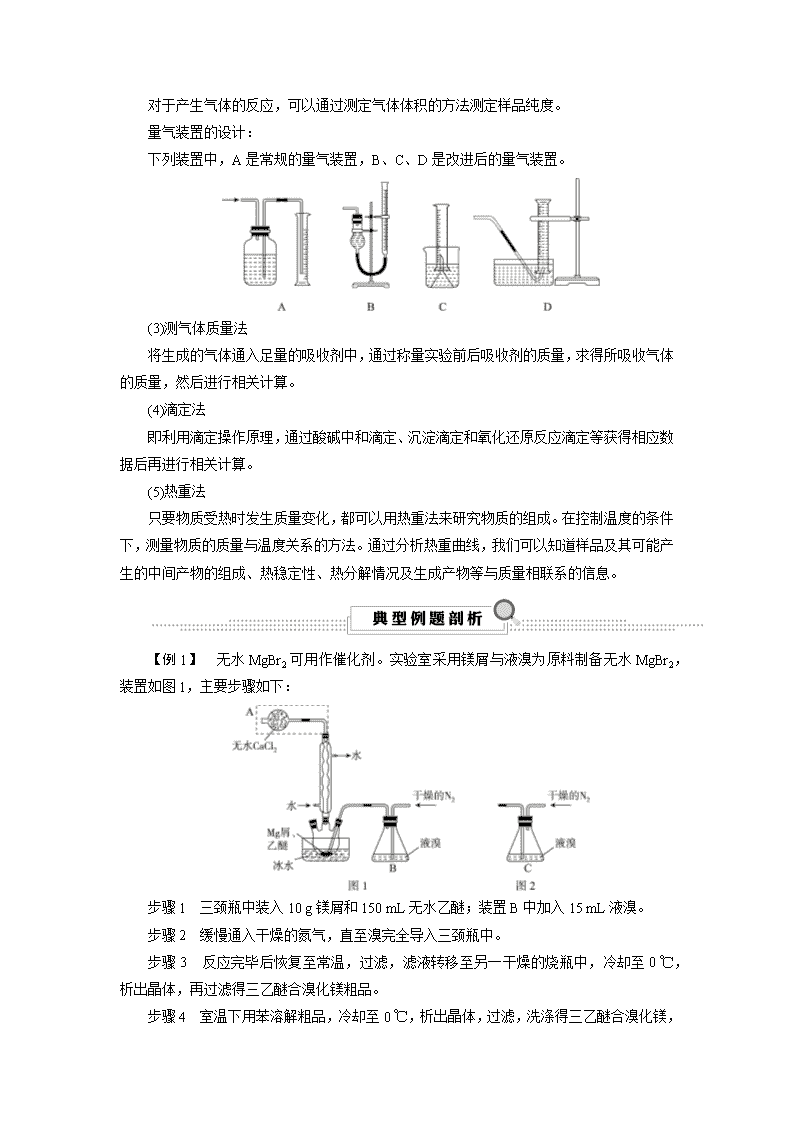
考点 65 物质的制备与定量分析 知识条目 必考要求 选考要求 1.硫酸亚铁铵的制备原理与操作方法 b 2.倾析法分离、洗涤固体物质 a 3.产率的计算方法 b 4.阿司匹林的合成原理、方法及流程 a 5.粗产品中杂质的检验 b 6.晶体的洗涤方法 b 7.移液管、滴定管的使用方法 b 8.中和滴定原理和基本操作 b 9.酸碱滴定中指示剂的选择方法 b 10.用滴定法测定液体样本中的总酸(或总碱) b 11.中和滴定实验的数据处理和误差的简单分析 c 12.电子天平的使用 a 13.镀锌铁皮锌镀层厚度测定的原理(与酸或碱反应)和操作流程 b 14.实验数据的处理和测定过程中产生误差的原因分析 c 一、物质的制备与合成 1.硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]的制备流程 2.阿司匹林的合成流程: Error! ― ― →水浴加热 催化剂 乙酰水杨酸 ― ― →抽滤 乙酰水杨酸晶体 ― ― →提纯 乙酰水杨酸 ― ― →检验 杂质(水杨酸) 3.制备实验的设计思路及一般方法 二、物质的定量分析 1.食醋总酸含量的测定 (1)移液管的使用 吸取液体时,左手拿洗耳球,右手将移液管插入溶液中吸取,当溶液吸至标线以上时, 立刻用食指将管口堵住,将管尖离开液面,稍松食指使液面平稳下降,至凹液面最低处与标 线相切。将移液管垂直放入稍倾斜的容器中,并使管尖与容器接触,流出液体。 (2)实验操作 ①将食醋溶液稀释 10 倍 ②把滴定样品溶液装入酸式滴定管 ③把标准 NaOH 溶液装 入碱式滴定管 ④取待测食醋溶液 25 mL 左右 ⑤用 NaOH 标准溶液滴定待测食醋溶液 ⑥ 记录数据 ⑦数据处理 2.镀锌铁皮镀锌层厚度的测定 实验终点的判断:到反应速率突然减小时(原电池反应消失,产生气泡的速率变得极慢) 计算公式:h=(m1-m2)/2ρS[ρ 为锌的密度,S 为镀锌层单侧面积,(m1-m2)为镀锌层 的质量] 3.定量测定数据的常用方法 (1)沉淀法 先将某种成分转化为沉淀,然后称量纯净、干燥的沉淀的质量,再进行相关计算。 (2)测气体体积法 对于产生气体的反应,可以通过测定气体体积的方法测定样品纯度。 量气装置的设计: 下列装置中,A 是常规的量气装置,B、C、D 是改进后的量气装置。 (3)测气体质量法 将生成的气体通入足量的吸收剂中,通过称量实验前后吸收剂的质量,求得所吸收气体 的质量,然后进行相关计算。 (4)滴定法 即利用滴定操作原理,通过酸碱中和滴定、沉淀滴定和氧化还原反应滴定等获得相应数 据后再进行相关计算。 (5)热重法 只要物质受热时发生质量变化,都可以用热重法来研究物质的组成。在控制温度的条件 下,测量物质的质量与温度关系的方法。通过分析热重曲线,我们可以知道样品及其可能产 生的中间产物的组成、热稳定性、热分解情况及生成产物等与质量相联系的信息。 【例 1】 无水 MgBr2 可用作催化剂。实验室采用镁屑与液溴为原料制备无水 MgBr2, 装置如图 1,主要步骤如下: 步骤 1 三颈瓶中装入 10 g 镁屑和 150 mL 无水乙醚;装置 B 中加入 15 mL 液溴。 步骤 2 缓慢通入干燥的氮气,直至溴完全导入三颈瓶中。 步骤 3 反应完毕后恢复至常温,过滤,滤液转移至另一干燥的烧瓶中,冷却至 0 ℃, 析出晶体,再过滤得三乙醚合溴化镁粗品。 步骤 4 室温下用苯溶解粗品,冷却至 0 ℃,析出晶体,过滤,洗涤得三乙醚合溴化镁, 加热至 160 ℃分解得无水 MgBr2 产品。 已知:①Mg 和 Br2 反应剧烈放热;MgBr2 具有强吸水性。 ②MgBr2+3C2H5OC2H5 MgBr2·3C2H5OC2H5 请回答:(1)仪器 A 的名称是________。实验中不能用干燥空气代替干燥 N 2,原因是 ________________________________________________________________________ ________________________________________________________________________。 (2) 如 将 装 置 B 改 为 装 置 C( 图 2) , 可 能 会 导 致 的 后 果 是 ________________________________________________________________________ ________________________________________________________________________。 (3)步骤 3 中,第一次过滤除去的物质是________。 (4)有关步骤 4 的说法,正确的是________。 A.可用 95%的乙醇代替苯溶解粗品 B.洗涤晶体可选用 0 ℃的苯 C.加热至 160 ℃的主要目的是除去苯 D.该步骤的目的是除去乙醚和可能残留的溴 (5)为测定产品的纯度,可用 EDTA(简写为 Y4-)标准溶液滴定,反应的离子方程式:Mg2 ++Y4-===MgY2-。 ① 滴 定 前 润 洗 滴 定 管 的 操 作 方 法 是 ________________________________________________________________________ ________________________________________________________________________。 ②测定时,先称取 0.250 0 g 无水 MgBr2 产品,溶解后,用 0.050 0 mol·L-1 的 EDTA 标 准溶液滴定至终点,消耗 EDTA 标准溶液 26.50 mL,则测得无水 MgBr2 产品的纯度是 ________(以质量分数表示)。 【解析】 (1)仪器 A 为干燥管。本实验要用镁屑和液溴反应生成无水溴化镁,所以装 置中不能有与镁反应的气体,例如氧气,所以不能用干燥的空气代替氮气。(2)将装置 B 改 为装置 C,当通入干燥的氮气,会使气压变大,将液溴快速压入三颈烧瓶,反应过快大量放 热而存在安全隐患。而装置 B 是利用干燥的氮气将溴蒸汽带入三颈烧瓶中,反应可以控制, 防止太快。(3)步骤 3 过滤除去的是不溶于水的镁屑。(4)A.95%的乙醇中含有水,溴化镁有 强烈的吸水性,错误;B.加入苯的目的是除去乙醚和溴,洗涤晶体用 0 ℃的苯,可以减少产 品的溶解,正确;C.加热至 160 ℃的主要目的是分解三乙醚合溴化镁得到溴化镁,不是为了 除去苯,错误;D.该步骤的目的是除去乙醚和可能残留的溴,正确。 (5)①滴定前润洗滴定管时需要从滴定管上口加入少量待装液,倾斜着转动滴定管,使 液体润湿内壁,然后从下部放出,重复 2~3 次。②根据方程式分析,溴化镁的物质的量为 0.050 0×0.026 50=0.001 325 mol,则溴化镁的质量为 0.001 325×184=0.243 8 g,溴化镁的 产品的纯度=0.243 8/0.250 0=97.5%。 【答案】 (1)干燥管 防止镁屑与氧气反应,生成的 MgO 阻碍 Mg 与 Br2 的反应 (2) 会将液溴快速压入三颈瓶,反应过快大量放热而存在安全隐患 (3)镁屑 (4)BD (5)①从滴 定管上口加入少量待装液,倾斜着转动滴定管,使液体润湿内壁,然后从下部放出,重复 2~3 次 ②97.5% 【提炼】 洗涤:1.洗涤沉淀的目的是什么? ①除去沉淀表面吸附的溶液(含有杂质),提高产品纯度 ②除去沉淀表面吸附的溶液(含 有产品),提高产率。 2.常见洗涤剂的选择:水洗(热水、冰水);无水酒精洗——酒精水溶液洗——有机溶 剂;饱和溶液;其他溶液洗。 3.洗涤沉淀的方法:应关小水龙头,使洗涤剂缓慢通过沉淀物。 4.怎样判断沉淀是否洗净:取最后一次洗涤液少许于试管中,滴加……,没有出 现……,说明沉淀已洗涤干净。 【例 2】 凯氏定氮法是测定蛋白质中氮含量的经典方法,其原理是用浓硫酸在催化剂 存在下将样品中有机氮转化成铵盐,利用如图所示装置处理铵盐,然后通过滴定测量。已知: NH3+H3BO3===NH3·H3BO3;NH3·H3BO3+HCl===NH4Cl+H3BO3。 回答下列问题: (1)a 的作用是_______________________________________________________。 (2)b 中放入少量碎瓷片的目的是_______________________________。 f 的名称是________。 (3)清洗仪器:g 中加蒸馏水;打开 k1,关闭 k2、k3,加热 b,蒸气充满管路;停止加热, 关闭 k1,g 中蒸馏水倒吸进入 c,原因是_____________________________________; 打开 k2 放掉水,重复操作 2~3 次。 (4)仪器清洗后,g 中加入硼酸(H3BO3)和指示剂。铵盐试样由 d 注入 e,随后注入氢氧 化钠溶液,用蒸馏水冲洗 d,关闭 k3,d 中保留少量水。打开 k1,加热 b,使水蒸气进入 e。 ①d 中保留少量水的目的是________________________________________。 ②e 中主要反应的离子方程式为______________________________________, e 采用中空双层玻璃瓶的作用是________________________________________。 (5)取某甘氨酸(C2H5NO2)样品 m g 进行测定,滴定 g 中吸收液时消耗浓度为 c mol·L -1 的盐酸 V mL,则样品中氮的质量分数为________%。 【解析】 (1)a 中导管与大气相连,所以作用是平衡气压,以避免 b 中压强过大。 (2)b 中放入少量碎瓷片的目的是防止暴沸,f 的名称是直形冷凝管。 (3)由于 c、e 及其所连接的管道内水蒸气冷凝为水后,气压远小于外界大气压,在大气 压的作用下,因此锥形瓶内的蒸馏水被倒吸入 c 中。 (4)①氨气是气体,因此 d 中保留少量水的目的是液封,防止氨气逸出。②e 中主要反应 是铵盐与碱在加热条件下的反应,离子方程式为 NH+4 +OH- =====△ NH3↑+H2O;e 采用中 空双层玻璃的作用是保温减少热量的损失,有利于铵根转化为氨气逸出。 (5)取某甘氨酸(C2H5NO2)样品 m g 进行测定,滴定 g 中吸收液时消耗浓度为 c mol·L -1 的盐酸 V mL,根据反应 NH3·H3BO3+HCl===NH4Cl+H3BO3,可以求出样品中 n(N)=n(HCl) =c mol·L -1×V×10-3L=0.001cV mol,则样品中氮的质量分数为 0.001 cV × 14 g·mol-1 m g ×100%=1.4cV m %。 【答案】 (1)避免 b 中压强过大 (2)防止暴沸 冷凝管 (3)c 中温度下降,管路中形 成负压 (4)①液封,防止氨气逸出 ②NH+4 +OH- =====△ NH3↑+H2O 保温使氨完全蒸出 (5)1.4cV m 【提炼】 明确相关物质的性质和实验原理是解答的关键,注意掌握解答综合性实验设 计与评价题的基本流程:原理→反应物质→仪器装置→现象→结论→作用意义→联想。具体 分析为:(1)实验是根据什么性质和原理设计的?实验的目的是什么?(2)所用各物质名称、 状态、代替物根据实验目的和相关的化学反应原理,进行全面的分析比较和推理,并合理选 择。(3)有关装置:性能、使用方法、适用范围、注意问题、是否有替代装置可用、仪器规 格等。(4)有关操作:技能、操作顺序、注意事项或操作错误的后果。(5)实验现象:自下而 上,自左而右全面观察。(6)实验结论:直接结论或导出结论。实验方案的设计要点:①题 目有无特殊要求;②题给的药品、装置的数量;③注意实验过程中的安全性操作;④会画简 单的实验装置图;⑤注意仪器的规格;⑥要防倒吸、防爆炸、防燃烧、防暴沸、防氧化,防 吸水,冷凝、冷却、水浴加热时采取相应措施;⑦同一仪器在不同位置的相应作用等;⑧要 严格按照“操作(实验步骤)+现象+结论”的格式叙述。查看更多