- 2021-04-21 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学实验知识点归纳及典型例题
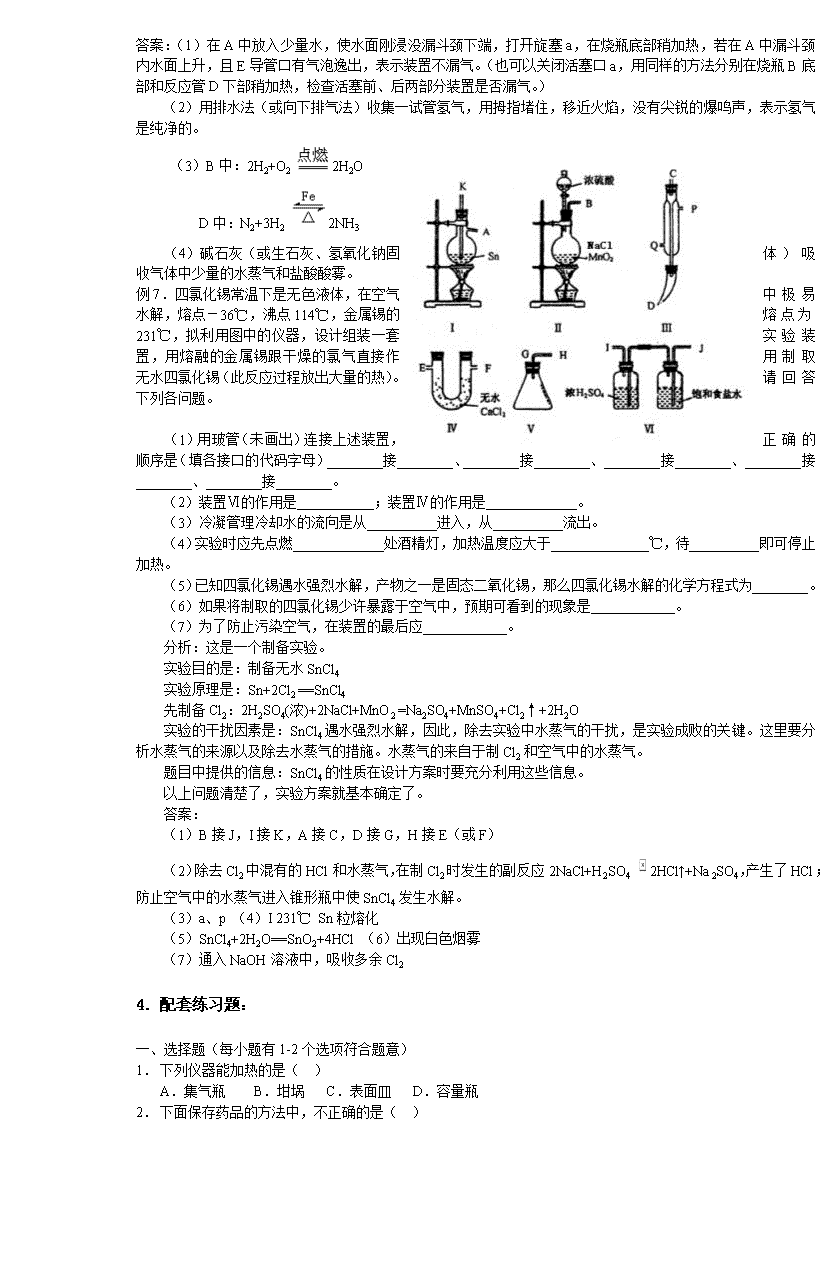
高考化学实验知识点归纳及典型例题 一、实验基础知识 1. 常用化学仪器 (1)应用要点:熟悉常用仪器结构特点、用途和应用注意事项,主要有加热容器、分离仪器、计量仪器等。 (2)注意事项:加热容器要区分是直接加热还是隔石棉网加热;分离仪器要区分是用于分液、过滤还是蒸馏;计量仪器要特别注意零刻度的位置及读数的精度要求。 2. 常用试剂的使用与贮存 (1)应用要点:着重了解露置在空气中易变质的试剂、见光或受热易分解的试剂、易挥发的试剂、易燃试剂、不宜用玻璃试剂瓶盛放的试剂等。 (2)注意事项:试剂的使用和贮存方法是由试剂的物理性质和化学性质所决定的。易与空气中氧气、水蒸气和二氧化碳反应的试剂不能长时露置在空气中;见光易分解的试剂应存放在棕色瓶中,置于冷暗处;受热易分解的试剂和易挥发的试剂应存放在冷暗处;能与玻璃中的二氧化硅反应生成硅酸钠的试剂,如NaOH、Na2CO3等不宜放在磨口玻璃试剂瓶中。 3. 气体制备与净化 (1)应用要点:掌握常见气体的制备反应、制备装置、收集方法、尾气吸收等。 (2)注意事项:气体的制备装置的选择主要根据反应物的状态和是否需要加热;收集方法的选择主要看气体的水溶性和密度,以及是否与空气中的氧气反应;尾气吸收时要注意防止倒吸。 4. 物质的检验、分离和提纯 (1)应用要点:要注意区分检验、分离、提纯的区别;掌握常见离子检验的检验方法;掌握分离和提纯的试剂选择依据和分离操作方法。 (2)注意事项:要注意三者在目的上的不同。检验是对物质进行鉴别或鉴定;分离是将混合物中各组分分开;提纯是除去混合物中的杂质。由于目的不同,所选试剂及分离方法也要相应地变化。 5. 定量实验 (1)应用要点:掌握四个定量实验(中和滴定、配制一定物质的量浓度的溶液、中和热的测定、硫酸铜晶体中结晶水含量的测定)的实验原理、主要仪器和装置、操作要点、数据处理和误差分析等。 (2)注意事项:要在熟悉仪器构造的前提下掌握操作方法和读数方法;在深入理解原理的基础上掌握数据处理和误差分析方法。 二、综合实验 (1)应用要点:能够根据实验目的选择仪器和装置、确定装置的接口顺序;能够设计简装实验;能够对实验原理、仪器、操作等的进行评价。 (2)注意事项:要注意区分洗气瓶长进短出和短进长出时的不同用途;。实验设计要遵循科学性、安全性、可行性和简约性四个基本原则;在掌握好实验基础知识的前提下才有可能正确地评价实验。 1. 典型例题: 例1.某同学在实验报告中写有以下操作和实验数据,其中合理的是_________________(填编号) ①用托盘天平称取11.7g食盐 ②用量筒取5.62mL某浓度的盐酸 ③用pH试纸测得某溶液的pH值为3.5 ④滴定某未知浓度的盐酸用去23.15mLNaOH标准溶液 ⑤用500mL容量瓶配制250mL 0.1mol/L Na2SO4溶液 ⑥用酸式滴定管量取25.00mL已知浓度的KMnO4溶液 答案:①④⑥ 例2.如图是一套实验室制气装置,用于发生、干燥和收集气体。下列各物质中能利用这套装置进行实验的是 A.铜屑和稀硝酸 B.二氧化猛和浓盐酸 C.电石和水 D.碳酸钙和稀盐酸 E.硫化亚铁和稀硝酸 答案:D 例3.下列仪器的瓶塞不能用磨口玻璃塞的的是( ) A. 盛放溴水的试剂瓶 B. 配制苛性钠溶液时所用的容量瓶 C. 盛放偏铝酸钠溶液的试剂瓶 D. 盛放水玻璃的试剂瓶 答案:C、D 例4.下列各组混合物的分离或提纯方法正确的是( ) A.用过滤法分离Fe(OH)3胶体和FeCl3溶液的混和物 B.用结晶法提纯NaCl和KNO3的混合物中KNO3 C.用蒸馏法分离乙醇和乙酸的混合物 D.用加热法分离碘和氯化铵的混合物 答案:B、C 例5.(1)某学生在中和滴定实验中用已知物质的量浓度的NaOH溶液滴定未知物质的量浓度的HCl溶液,其实验过程如下: A.取一支酸式滴定管,用蒸馏水洗净,即加入已知物质的量浓度的NaOH溶液;B.调节好后记下液面刻度读数;C.用已润洗过的酸式滴定管精确放出一定量的待测酸液,置于未经待测酸液润洗的洁净锥形瓶中;D.加入酚酞试液2滴,摇匀;E.滴定时,边滴边摇匀,注视滴定管内液面变化;F.当小心滴到溶液由无色变成粉红色时,即停止滴定,并立即记下液面刻度读数;G.根据两次滴定消耗的NaOH溶液体积数的平均值进行计算。 (1)指出上述实验过程中操作的错误之处____________(字母表示,多选要倒扣分) (2)某学生准备用质量分37%,密度为1.19g·cm-3的浓盐酸配制0.10mol/L的稀盐酸500mL。 请回答下列问题 ①量取浓盐酸的体积为______________mL,应选用量筒的规格为______________mL。 ②配制时应选用容量瓶的规格为___________。 ③配制时除容量瓶外,还需选用_____________、___________、____________和试剂瓶等仪器。 答案:(1)A E F (2)①4.1,5 ②500mL ③烧杯 胶头滴管 玻璃棒 例6.有实验装置图(见图) 示意图中A是简易的氢气发生器,B是大小适宜的圆底烧瓶,C是装有干燥剂的U型管。a是旋转活塞,D是装有还原铁粉的反应管,E是装有酚酞试液的试管。 实验前先检查实验装置的气密性。实验开始时,先关闭活塞a,并取下烧瓶B,向A中加入一定量浓度适当的盐酸,发生氢气。经必要的“操作”[见问题(2)]后,在导管出口处点燃氢气,然后如图所示套上烧瓶B,塞瓶塞,气体在烧瓶中继续燃烧。用酒精灯加热反应管D中的还原铁粉,待B中氢气的火焰熄灭后,打开活塞a,气体通过反应管D进入试管E中,使酚酞试液呈红色。请回答下列问题。 (1)实验前如何检查装置的气密性?______________。 (2)点燃氢气前必须进行___________操作,进行该操作的方法是___________。 (3)写出B、D中分别发生反应的化学方程式。 B中______________________________ D中______________________________ (4)C中所盛干燥剂的名称是_________;该干燥剂的作用是______________________。 答案:(1)在A中放入少量水,使水面刚浸没漏斗颈下端,打开旋塞a,在烧瓶底部稍加热,若在A中漏斗颈内水面上升,且E导管口有气泡逸出,表示装置不漏气。(也可以关闭活塞口a,用同样的方法分别在烧瓶B底部和反应管D下部稍加热,检查活塞前、后两部分装置是否漏气。) (2)用排水法(或向下排气法)收集一试管氢气,用拇指堵住,移近火焰,没有尖锐的爆鸣声,表示氢气是纯净的。 (3)B中:2H2+O2 2H2O D中:N2+3H2 2NH3 (4)碱石灰(或生石灰、氢氧化钠固体)吸收气体中少量的水蒸气和盐酸酸雾。 例7.四氯化锡常温下是无色液体,在空气中极易水解,熔点-36℃,沸点114℃,金属锡的熔点为231℃,拟利用图中的仪器,设计组装一套实验装置,用熔融的金属锡跟干燥的氯气直接作用制取无水四氯化锡(此反应过程放出大量的热)。请回答下列各问题。 (1)用玻管(未画出)连接上述装置,正确的顺序是(填各接口的代码字母)________接________、________接________、________接________、________接________、________接________。 (2)装置Ⅵ的作用是___________;装置Ⅳ的作用是_____________。 (3)冷凝管理冷却水的流向是从__________进入,从__________流出。 (4)实验时应先点燃_____________处酒精灯,加热温度应大于______________℃,待__________即可停止加热。 (5)已知四氯化锡遇水强烈水解,产物之一是固态二氧化锡,那么四氯化锡水解的化学方程式为________。 (6)如果将制取的四氯化锡少许暴露于空气中,预期可看到的现象是____________。 (7)为了防止污染空气,在装置的最后应____________。 分析:这是一个制备实验。 实验目的是:制备无水SnCl4 实验原理是:Sn+2Cl2 ==SnCl4 先制备Cl2:2H2SO4(浓)+2NaCl+MnO2 =Na2SO4+MnSO4+Cl2↑+2H2O 实验的干扰因素是:SnCl4遇水强烈水解,因此,除去实验中水蒸气的干扰,是实验成败的关键。这里要分析水蒸气的来源以及除去水蒸气的措施。水蒸气的来自于制Cl2和空气中的水蒸气。 题目中提供的信息:SnCl4的性质在设计方案时要充分利用这些信息。 以上问题清楚了,实验方案就基本确定了。 答案: (1)B接J,I接K,A接C,D接G,H接E(或F) (2)除去Cl2中混有的HCl和水蒸气,在制Cl2时发生的副反应2NaCl+H2SO4 2HCl↑+Na2SO4,产生了HCl;防止空气中的水蒸气进入锥形瓶中使SnCl4发生水解。 (3)a、p (4)I 231℃ Sn粒熔化 (5)SnCl4+2H2O==SnO2+4HCl (6)出现白色烟雾 (7)通入NaOH溶液中,吸收多余Cl2 4.配套练习题: 一、选择题(每小题有1-2个选项符合题意) 1. 下列仪器能加热的是( ) A.集气瓶 B.坩埚 C.表面皿 D.容量瓶 2. 下面保存药品的方法中,不正确的是( ) A. 金属钠、钾应保存在洒精里 B. 烧碱溶液应保存在带橡胶塞的试剂瓶内 C. 少量白磷应保存在冷水里 D. 溴水应保存在带玻璃塞的试剂瓶内 3.实验室制取下列气体时,为防止污染空气,尾气需用碱液吸收的是( ) A.Cl2 B.CO2 C.CO D.SO2 4.除去二氧化碳中混有的少量二氧化硫气体,可选用的试剂是( ) A.高锰酸钾溶液 B.饱和碳酸钠溶液 C.饱和小苏打溶液 D.石灰水 5.为了除去粗盐中Ca2+、Mg2+、SO及泥沙,将粗盐溶于水,然后进行下列五项操作:①过滤 ②加过量的NaOH溶液 ③加适量盐酸 ④加过量Na2CO3 ⑤加过量BaCl2溶液。正确的操作顺序( ) A.①④②⑤③ B.④①②⑤③ C.②⑤④①③ D.⑤②④①③ 6.某同学设计下列方法对A盐的水溶液进行鉴定。 由此得出的以下结论中,错误的是 A.D溶液中可能存在Fe(SCN)2+ B.C溶液中有Fe3+ C.B为AgBr浅黄色沉淀 D.A一定为无氧酸盐FeBr3 7.某混合气体可能含有CO、CO2、NH3、HCl、H2和水蒸气中的一种或几种,当依次通过澄清石灰水(无浑浊现象)、氢氧化钡溶液(有浑浊现象)、浓硫酸、灼热的氧化铜(变红)和无水CuSO4(变蓝),则可断定该混合气一定有( ) A.HCl、CO2、H2 B.CO、H2、H2O C.CO、H2、NH3 D.HCl、CO、H2O 8.下列各组溶液中,不用其他化学试剂,而用物质间两两混合的方法不可能鉴别开的是( ) A. NaOH、AlCl3、盐酸、Na2CO3 B. BaCl2、AgNO3、Na2CO3、CaCl2 C. 淀粉、淀粉-KI、KI、溴水 D. Na2S、稀硫酸、Na2SiO3、Na2S2O3 9.下列各组物质仅用溴水即可鉴别的是( ) A.苯、己烷、己烯 B.己烷、己烯、己炔 C.苯、四氯化碳、苯酚 D.溴苯、四氯化碳、己烯 10.为确定下列置于空气中的物质是否变质,所选检验试剂(括号内物质)不能达到目的的是( ) A.Na2SO3溶液(BaCl2) B.FeCl2溶液(KSCN) C.KI(淀粉溶液) D.HCHO溶液(石蕊试液) 二、填空题 11.如图所示①②③④分别是几种常见漏斗的上部,A、B、C、D是实际操作应用时,各漏斗的下部插入容器中的示意图。请指出A、B、C、D分别与①②③④相匹配的组合:A与__________;B与__________;C与_____________;D与______________。 12.下面a~e是中学化学实验中常见的几种定量仪器: a量筒 b容量瓶 c 滴定管 d托盘天平 e温度计 (1) 其中标示出温度计使用温度的是__________ (1) 能够用以精确量取液体体积的是__________ (2) 下列由于错误操作,使得到的数据比正确数据偏小的是__________ (a)用量筒量取一定量液体时,俯视液面读数 (b)中和滴定达终点时俯视滴定管内液面读数 (c)使用容量瓶配制溶液定容时,俯视凹液面最低处 13.用如图所示装置可以收集以下气体:H2、Cl2、CH3、HCl、NH3、NO、SO3。 (1)若集气瓶是干燥的,气体从A进入,可收集的气体有________,气体从B进入,可收集气体________。 (2)若将集气瓶盛满水,收集气体并测量气体的体积,可以收集并测量体积的气体有___________;此时气体应由__________管进入,由___________管通向量筒。 14.浓硝酸有时呈黄色,这是由于______________________,因此浓硝酸在贮存时应_______瓶中,并放置________处。工业盐酸往往也呈黄色,这是由于___________________的缘故。浓盐酸由于具有____________性,贮存时应__________,并放置在_________。 15.某固体混合物可能由KNO3、K2SO4、KI、KCl、NaCl、CuCl2、CaCl2、和Na2CO3中一种或几种组成,依次进行下列五步实验,观察到的现象记录如下: ① 混合物加水得无色透明溶液。 ② 向上述溶液中滴加BaCl2溶液,有白色沉淀生成,将该沉淀滤出,并将滤液分成两份。 ③ 上述白色沉淀可完全溶于稀硝酸。 ④ 将两份滤液中的一份,滴加氯水并加入CCl4,振荡后静置,CCl4层无色。 ⑤ 将另一份滤液中加入AgNO3溶液,有白色沉淀生成,该沉淀不溶于稀硝酸。 根据以上实验,可以判断混合物中肯定含有____________;不能判断是否含有_________________。 16.一瓶溶液含有Cl-、CO32-、SO42-、Na+、NH4+、Al3+、Mg2+七种离子中的某几种。 ① 加入适量NaOH溶液产生白色沉淀; ② 再加过量NaOH溶液白色沉淀不溶解; ③ 将①所得溶液加热,放出使湿润的红色石蕊试纸变蓝的气体; ④ 原溶液加BaCl2溶液不产生沉淀 则溶液中一定含有______________,一定不含_______________离子。 17. 下图是课外活动小组同学设计的尾气吸收装置。 → c → → f → g → h → i → a b → d → e ① 从实验安全和保护环境的角度出发,若用于吸收HCl,气体(装置中液体为水,固体为碱石灰),应选用的装置是_______________。 ② 若用于吸收NH3,在上述已选用装置中,宜采用的是____________________,原因是_____________ ________________________________________________________________________________。 ③ 若用于吸收Cl2,(装置中液体为碱液)。你认为上述已选用的装置中不宜采用的是__________,原因是 ________________________________________________________________。 18.为了测定工业纯碱中碳酸钠的质量分数(纯碱中常含少量NaCl),某学生设计了实验装置如图 (1)准确称取盛有碱石灰的干燥管的质量(设为W1) (2)准确称取一定量纯碱样品(设为W0),并放入烧瓶中。从分液漏斗缓缓滴入稀硫酸,待不再发生气体后。称干燥管的总质量(设为W2)。设学生导出的计算公式为: Na2CO3的质量分数= ×100% 试回答: ①W2-W1表示什么? ②如果不计称量误差,该生的实验结果有无明显误差?如有,是偏大还是偏小?请简要说明根据并提出补救措施 19.实验室中用浓盐酸与MnO2制Cl2,再用Cl2和Ca(OH)2反应制少量漂白粉,已知Cl2和Ca(OH)2制漂白粉是放热反应,温度稍高即发生副反应: 6Cl2+6Ca(OH)2=Ca(ClO3)2+5CaCl2+6H2O,现有三位同学设计的三套装置如图(U形管中放有玻璃纤维,可使气体顺利通过): (1) 请从以下六方面对上述甲、乙、丙三套装置的优缺点进行评价,将适当的选项序号填于下表内(错选、漏选、多选均倒扣分) a.不易控制反应速率 b.容易控制反应速率 c.有副反应发生 d.可防止副反应发生 e.容易污染环境 f.可防止污染环境 1 优点 缺点 甲装置 1 1 乙装置 1 1 丙装置 1 1 (2)请从甲、乙、丙三装置中,选取合理的组成部分(A、B、C、D、E、F、G),组装一套你认为更完善的实验装置,连接顺序(按气流左到右方向)为_____________,在此装置及甲、乙、丙三装置中,你认为是否还缺少必要的装置,说明原因_____________________。 分析:这是一道评价实验方案的题。该题从是否有副反应发生,是否易控制反应速率,是否防止污染,是否干扰反应产物等方面进行评价。 20.某工厂的废液经测定主要含有乙醇,其中还溶有丙酮、乙酸乙酯。根据各物质的性质,确定通过下列步骤回收乙醇和乙酸。 物质 丙酮 乙酸乙酯 乙醇 乙酸 沸点/℃ 56.2 77.06 78 117.9 a. 向废液中加入烧碱溶液,调整pH =10; b. 将混合液放入蒸镏器中缓缓加热; c. 收集温度在70℃~85℃时的镏出物; d. 排出蒸馏器中的残液,冷却后,向其中加浓硫酸(过量),然后再放入耐酸蒸馏器中进行蒸馏,回收镏出物。 据此回答下列问题: ① 实验中b、c用蒸馏方法分离和提纯该混合物,除了蒸馏烧瓶、冷凝管、锥形瓶、自来水外,尚缺少的实验仪器和用品是_____________________________________。 ② 加入烧碱溶液,调整pH = 10 的目的是______________________________________。 ③ 在70℃~85℃时,馏出物的主要成分是___________________________________。 ④ 在步聚d中,加过量浓硫酸的目的是(用化学方程式表示)____________________________________,回收馏出物的温度控制在85℃~125℃,这时残馏液中的主要成分是_____________。 习题答案 1B 2A 3AD 4AC 5CD 6D 7A 8B 9C 10A 11.A与③;B与②;C与①;D与④ 12.(1)abc (2)c (3) b 13.1)从A口进入:Cl2、HCl、SO2,收集比空气重的气体,但不能用排空气法收集NO;(2)从B口进入:H2、CH4、NH3,收集比空气轻的气体。 (2)H2、CH4、NO,由B口进入,由A口通到量筒中 14.浓硝酸分解产生的NO2溶于其中;棕色;冷暗;溶有Fe3+;挥发;冷暗。 15.NaNO3;KNO3 KCl NaCl 16.Mg2+、NH4+、Cl-;CO32-、SO42-、Al3+ 17.① a h d e ② h;氨气是碱性气体,不能被碱石灰吸收。③ a ;Cl2溶于碱液的速率较小,若通入Cl2过快,则Cl2容易逸出,污染空气。 18.①(W2-W1)g为表示CO2的质量 ②产生误差的原因(即干扰因素)有烧瓶的CO2不能都被碱石灰吸收,实验值偏低。CO2气体混有的水蒸气和空气中的水蒸气被碱石灰吸收,使实验值偏高,两个因素综合考虑,CO2的影响是主要的,所以实验值偏低。补救的办法:如图 ①将蒸馏烧瓶改为集气瓶,利于排出CO2。 ②向集气瓶中通入(已除去CO2)空气,用空气将烧瓶中Cl2尽量排出去。 ③在干燥管前连接盛有浓H2SO4的试管,以除去水蒸气; ④在U型管中装有碱石灰,以吸收空气中的CO2气体,经过这些补救措施,实验误差可以降低。 19. (1)优点 缺点 甲装置d a、e 乙装置f a、c 丙装置b e、c (2)F~B~E 在Cl2中混有HCl,应在烧瓶和凹形管之间连接一个盛有饱和食盐水的试管,以除去HCl气体。 20.① 温度计、牛角管、沸石、酒精灯、石棉网、火柴。 ② 中和乙酸,并使乙酸乙酯完全水解生成乙酸钠和乙醇。 ③ 乙醇 ④ CH3COONa + H2SO4(浓)==NaHSO4 +CH3COOH↑ NaHSO4查看更多