- 2021-04-20 发布 |
- 37.5 KB |
- 43页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
江苏省2020高考化学二轮复习题型三综合实验探究与定量计算教案含解析
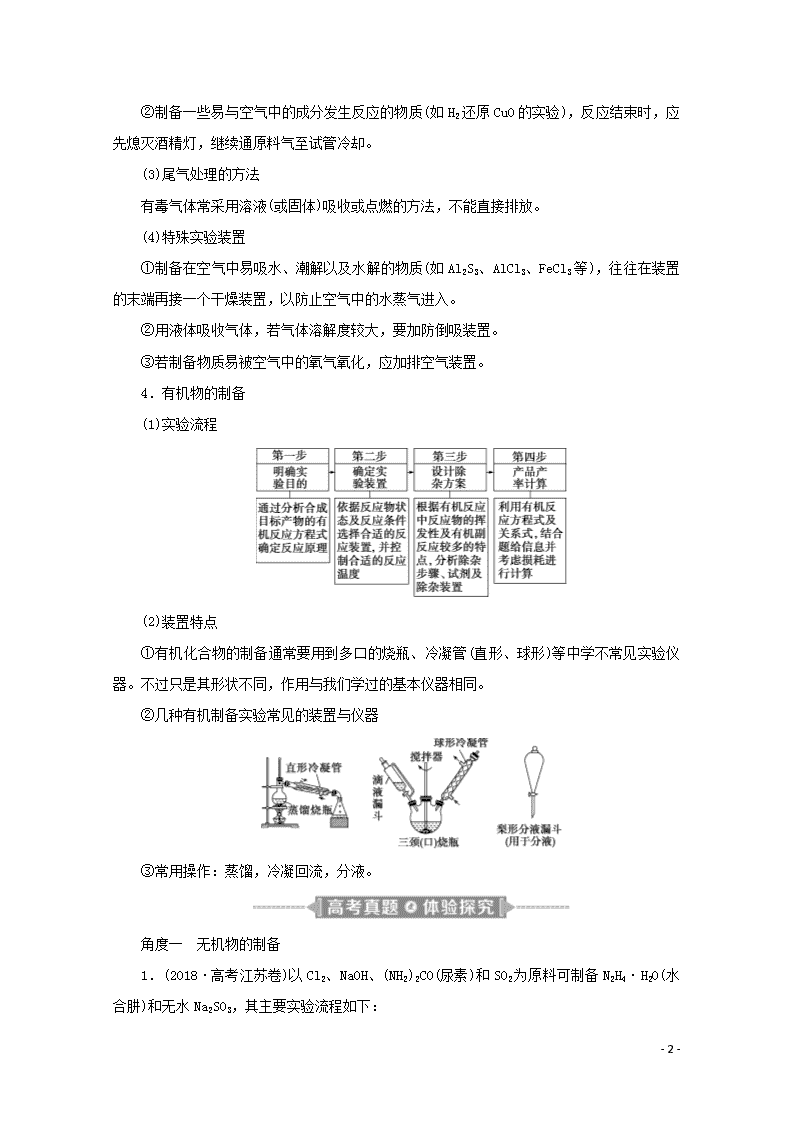
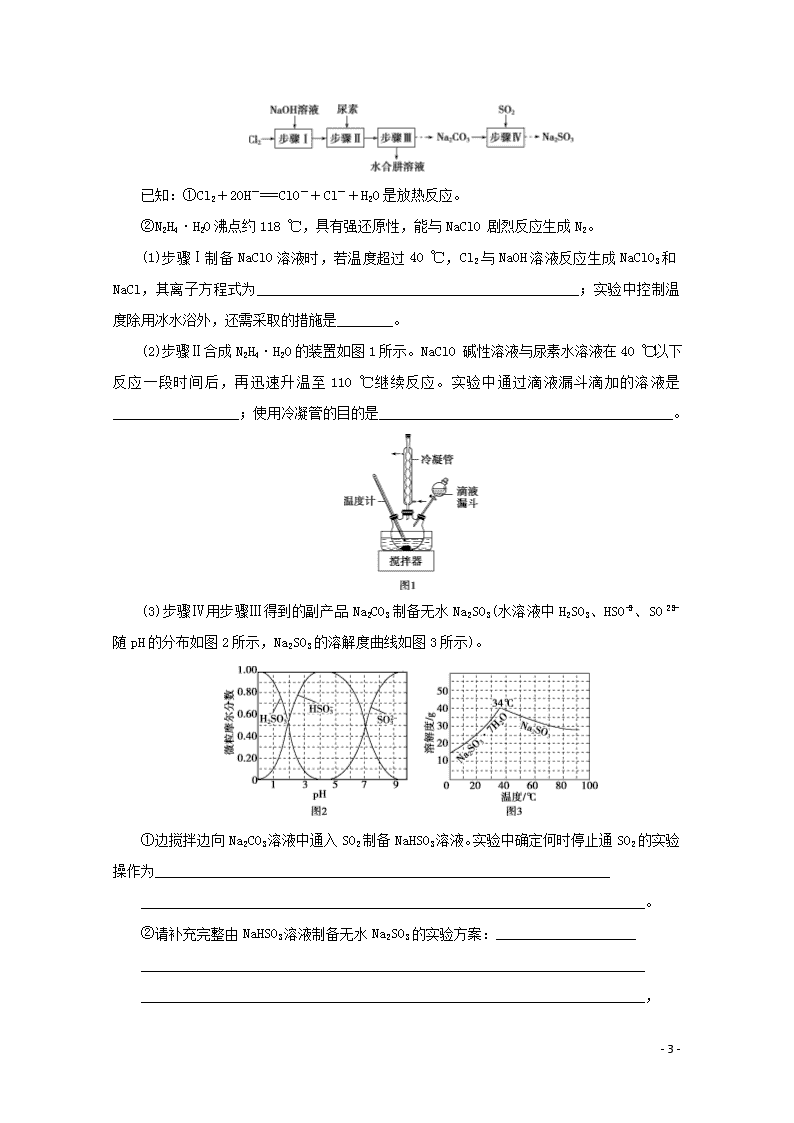
题型三 综合实验探究与定量计算 物质制备类综合实验 1.题型剖析 (1)无机物制备题的常考方向 (2)有机物制备题的常考问题 涉及有机物制备的综合实验,重点考查物质分离中的蒸馏、分液操作,反应条件的控制,产率的计算等问题。 2.制备实验方案设计的原则 (1)无机物制备实验方案应遵循下列原则 ①原料廉价易得,用料最省即原料利用率高。 ②所选用的实验装置或仪器不复杂。 ③实验操作简便安全,对环境不造成污染或污染较小。 (2)有机物制备实验方案应遵循下列原则 ①原料廉价易得,用料最省。 ②副反应、副产品少,反应时间短,产品易分离提纯。 ③反应实验步骤少,实验操作方便安全。 (3)仪器装置的选择要根据反应物的状态和反应条件。 3.有气体参与的制备实验的注意事项 (1)操作顺序问题 与气体有关的实验操作顺序:装置选择与连接→气密性检查→装入固体药品→加液体药品→按程序进行实验→拆卸仪器。 (2)加热操作的要求 ①使用可燃性气体(如H2、CO、CH4等),先用原料气排尽系统内的空气,再点燃酒精灯加热,以防止爆炸。 - 43 - ②制备一些易与空气中的成分发生反应的物质(如H2还原CuO的实验),反应结束时,应先熄灭酒精灯,继续通原料气至试管冷却。 (3)尾气处理的方法 有毒气体常采用溶液(或固体)吸收或点燃的方法,不能直接排放。 (4)特殊实验装置 ①制备在空气中易吸水、潮解以及水解的物质(如Al2S3、AlCl3、FeCl3等),往往在装置的末端再接一个干燥装置,以防止空气中的水蒸气进入。 ②用液体吸收气体,若气体溶解度较大,要加防倒吸装置。 ③若制备物质易被空气中的氧气氧化,应加排空气装置。 4.有机物的制备 (1)实验流程 (2)装置特点 ①有机化合物的制备通常要用到多口的烧瓶、冷凝管(直形、球形)等中学不常见实验仪器。不过只是其形状不同,作用与我们学过的基本仪器相同。 ②几种有机制备实验常见的装置与仪器 ③常用操作:蒸馏,冷凝回流,分液。 角度一 无机物的制备 1.(2018·高考江苏卷)以Cl2、NaOH、(NH2)2CO(尿素)和SO2为原料可制备N2H4·H2O(水合肼)和无水Na2SO3,其主要实验流程如下: - 43 - 已知:①Cl2+2OH-===ClO-+Cl-+H2O是放热反应。 ②N2H4·H2O沸点约118 ℃,具有强还原性,能与NaClO 剧烈反应生成N2。 (1)步骤Ⅰ制备NaClO溶液时,若温度超过40 ℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为______________________________________________;实验中控制温度除用冰水浴外,还需采取的措施是________。 (2)步骤Ⅱ合成N2H4·H2O的装置如图1所示。NaClO 碱性溶液与尿素水溶液在40 ℃以下反应一段时间后,再迅速升温至110 ℃继续反应。实验中通过滴液漏斗滴加的溶液是__________________;使用冷凝管的目的是__________________________________________。 (3)步骤Ⅳ用步骤Ⅲ得到的副产品Na2CO3制备无水Na2SO3(水溶液中H2SO3、HSO、SO随pH的分布如图2所示,Na2SO3的溶解度曲线如图3所示)。 ①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定何时停止通SO2的实验操作为_________________________________________________________________ ________________________________________________________________________。 ②请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案:____________________ ________________________________________________________________________ ________________________________________________________________________, - 43 - 用少量无水乙醇洗涤,干燥,密封包装。 解析:(1)由题给条件,反应物为Cl2和NaOH,生成物为NaClO3、NaCl、H2O,根据离子方程式书写规则、原子守恒、电荷守恒以及得失电子守恒得该离子反应为3Cl2+6OH-5Cl-+ClO+3H2O;Cl2与碱反应放热,所以要控制温度,还需采取的措施是控制通入氯气的速度。(2)步骤Ⅱ是尿素和次氯酸钠反应合成水合肼,由题给信息水合肼能与次氯酸钠剧烈反应,所以滴液漏斗中盛装的是次氯酸钠碱性溶液,由水合肼沸点约为118 ℃,题给实验反应温度为110 ℃,故使用冷凝管的目的是减少水合肼的挥发。(3)①由题图2所给pH与各粒子摩尔分数关系可知,在pH约为4时,溶液中HSO浓度最大,此时可停止通SO2气体;②由NaHSO3制备Na2SO3是向NaHSO3溶液中加入NaOH溶液,由题图2可知在pH约为10时,SO浓度最大,此时停止加入NaOH,再由Na2SO3的溶解度曲线可知,过滤温度应高于34 ℃。实验方案为边搅拌边向NaHSO3溶液中滴加NaOH溶液,测量溶液pH,pH约为10时,停止滴加NaOH溶液,加热浓缩溶液至有大量晶体析出,在温度高于34 ℃条件下趁热过滤。 答案:(1)3Cl2+6OH-5Cl-+ClO+3H2O 缓慢通入Cl2 (2)NaClO碱性溶液 减少水合肼的挥发 (3)①测量溶液的pH,若pH约为4,停止通SO2 ②边搅拌边向NaHSO3溶液中滴加NaOH溶液,测量溶液pH,pH约为10时,停止滴加NaOH溶液,加热浓缩溶液至有大量晶体析出,在高于34 ℃条件下趁热过滤 2.(2016·高考江苏卷)焦亚硫酸钠(Na2S2O5)是常用的抗氧化剂,在空气中、受热时均易分解。实验室制备少量Na2S2O5的方法:在不断搅拌下,控制反应温度在40 ℃左右,向Na2CO3过饱和溶液中通入SO2,实验装置如下图所示。 当溶液pH约为4时,停止反应,在20 ℃左右静置结晶。生成Na2S2O5的化学方程式为 2NaHSO3===Na2S2O5+H2O (1)SO2与Na2CO3溶液反应生成NaHSO3和CO2,其离子方程式为________________ ________________________________________________________________________。 (2)装置Y的作用是________________________________________________________。 - 43 - (3)析出固体的反应液经减压抽滤、洗涤、25~30 ℃干燥,可获得Na2S2O5固体。 ①组成减压抽滤装置的主要仪器是布氏漏斗、________和抽气泵。 ②依次用饱和SO2水溶液、无水乙醇洗涤Na2S2O5固体。用饱和SO2水溶液洗涤的目的是___________________________________________________________________________ ________________________________________________________________________。 (4)实验制得的Na2S2O5固体中含有一定量的Na2SO3和Na2SO4,其可能的原因是 ________________________________________________________________________ ________________________________________________________________________。 解析:(1)该离子方程式为2SO2+H2O+CO===2HSO+CO2。(2)装置Y的作用是防止倒吸。 (3)①减压抽滤装置的主要仪器有布氏漏斗、吸滤瓶和抽气泵。②用饱和SO2水溶液洗涤的目的是减少Na2S2O5在水中的溶解。(4)根据提供信息,Na2S2O5在空气中、受热时均易分解,在制备过程中Na2S2O5分解生成Na2SO3,部分Na2SO3被氧化为Na2SO4,因此含有一定量的Na2SO3、Na2SO4。 答案:(1)2SO2+CO+H2O===2HSO+CO2 (2)防止倒吸 (3)①吸滤瓶 ②减少Na2S2O5在水中的溶解 (4)在制备过程中Na2S2O5分解生成Na2SO3,Na2SO3被氧化生成Na2SO4 3.(2014·高考江苏卷)磷酸铁(FePO4·2H2O,难溶于水的米白色固体)可用于生产药物、食品添加剂和锂离子电池的正极材料。实验室可通过下列实验制备磷酸铁。 (1)称取一定量已除去油污的废铁屑,加入稍过量的稀硫酸,加热、搅拌,反应一段时间后过滤。反应加热的目的是________________________________________________。 (2)向滤液中加入一定量H2O2氧化Fe2+。为确定加入H2O2的量,需先用K2Cr2O7标准溶液滴定滤液中的Fe2+,离子方程式如下: Cr2O+6Fe2++14H+===2Cr3++6Fe3++7H2O ①在向滴定管中注入K2Cr2O7标准溶液前,滴定管需要检漏、________________和________________。 ②若滴定x mL滤液中的Fe2+,消耗a mol·L—1 K2Cr2O7标准溶液b mL,则滤液中c(Fe2+)=________ mol·L—1。 ③为使滤液中的Fe2+完全被H2O2氧化,下列实验条件控制正确的是________(填序号)。 A.加入适当过量的H2O2溶液 - 43 - B.缓慢滴加H2O2溶液并搅拌 C.加热,使反应在较高温度下进行 D.用氨水调节溶液pH=7 (3)将一定量的Na2HPO4溶液(溶液显碱性)加入含有Fe3+的溶液中,搅拌、过滤、洗涤、干燥得到FePO4·2H2O。若反应得到的FePO4·2H2O固体呈棕黄色,则磷酸铁中混有的杂质可能为________。 解析:(1)温度越高反应速率越快,因此加热可以加快反应的速率。(2)①滴定管要先用蒸馏水洗涤,再用待装液体润洗。②根据题给离子方程式可知,n(Fe2+)=6n(Cr2O),c(Fe2+)=== mol·L-1。③加入过量的H2O2,可以使Fe2+充分被氧化;缓慢滴加H2O2并搅拌,可以使反应更充分;加热会使H2O2发生分解;加入氨水会使Fe2+转化为沉淀。故答案为AB。(3)因为碱性溶液中Fe3+反应生成红褐色的 Fe(OH)3沉淀,从而使得到的FePO4·2H2O固体呈棕黄色。 答案:(1)加快铁与稀硫酸反应速率 (2)①用蒸馏水洗涤 用K2Cr2O7标准溶液润洗2~3次 ② ③AB (3)Fe(OH)3(或氢氧化铁) 角度二 有机物的制备 4.(2019·高考江苏卷)丙炔酸甲酯(CH≡C—COOCH3)是一种重要的有机化工原料,沸点为103~105 ℃。实验室制备少量丙炔酸甲酯的反应为 CH≡C—COOH+CH3OH CH≡C—COOCH3+H2O 实验步骤如下: 步骤1:在反应瓶中,加入14 g丙炔酸、50 mL甲醇和2 mL浓硫酸,搅拌,加热回流一段时间。 步骤2:蒸出过量的甲醇(装置如图)。 - 43 - 步骤3:反应液冷却后,依次用饱和NaCl溶液、5% Na2CO3溶液、水洗涤。分离出有机相。 步骤4:有机相经无水Na2SO4干燥、过滤、蒸馏,得丙炔酸甲酯。 (1)步骤1中,加入过量甲醇的目的是__________________________________________。 (2)步骤2中,如图所示的装置中仪器A的名称是__________;蒸馏烧瓶中加入碎瓷片的目的是________________________________________________________________________。 (3)步骤3中,用5% Na2CO3溶液洗涤,主要除去的物质是________;分离出有机相的操作名称为________。 (4)步骤4中,蒸馏时不能用水浴加热的原因是_____________________________________ __________________________________________________________________________。 解析:(1)甲醇可作为溶剂,同时增加一种反应物的用量,可提高另一种反应物的转化率。(2)蒸馏时用到的仪器A为直形冷凝管,蒸馏烧瓶中加入碎瓷片的目的是防止暴沸。(3)Na2CO3可以与丙炔酸反应。丙炔酸甲酯在Na2CO3溶液中的溶解度较小,故可以用分液法分离有机相和无机相。(4)丙炔酸甲酯的沸点比水高,若用水浴加热,则不能将丙炔酸甲酯蒸出来。 答案:(1)作为溶剂、提高丙炔酸的转化率 (2)(直形)冷凝管 防止暴沸 (3)丙炔酸 分液 (4)丙炔酸甲酯的沸点比水的高 5.(2018·高考江苏卷)3,4亚甲二氧基苯甲酸是一种用途广泛的有机合成中间体,微溶于水,实验室可用KMnO4氧化3,4亚甲二氧基苯甲醛制备,其反应方程式为 实验步骤如下: 步骤1:向反应瓶中加入3,4亚甲二氧基苯甲醛和水,快速搅拌,于70~80 ℃滴加KMnO4溶液。反应结束后,加入KOH溶液至碱性。 步骤2:趁热过滤,洗涤滤饼,合并滤液和洗涤液。 - 43 - 步骤3:对合并后的溶液进行处理。 步骤4:抽滤,洗涤,干燥,得3,4亚甲二氧基苯甲酸固体。 (1)步骤1中,反应结束后,若观察到反应液呈紫红色,需向溶液中滴加NaHSO3溶液,HSO转化为__________(填化学式);加入KOH溶液至碱性的目的是________________________________________________________________________。 (2)步骤2中,趁热过滤除去的物质是________(填化学式)。 (3)步骤3中,处理合并后溶液的实验操作为___________________________________。 (4)步骤4中,抽滤所用的装置包括________、吸滤瓶、安全瓶和抽气泵。 解析:(1)反应结束后,溶液仍呈紫红色,说明KMnO4溶液过量,需加NaHSO3溶液进行还原,HSO则被氧化为SO。题干信息提示3,4亚甲二氧基苯甲酸微溶于水,而其盐溶于水,所以反应结束后加KOH溶液至碱性是将反应生成的酸转化为可溶性的钾盐。(2)产物中的MnO2不溶于水,所以趁热过滤除去MnO2。(3)合并后的溶液中含3,4亚甲二氧基苯甲酸钾,需将其转化为微溶的酸,所以,处理合并后的溶液,可滴加盐酸,使有机酸逐渐从溶液中析出,因此,为使沉淀完全,可向溶液中滴加盐酸至水层不再产生沉淀。(4)抽滤装置包括布氏漏斗、吸滤瓶、安全瓶和抽气泵。 答案:(1)SO 将反应生成的酸转化为可溶性的盐 (2)MnO2 (3)向溶液中滴加盐酸至水层不再产生沉淀 (4)布氏漏斗 6.(2017·高考江苏卷)1溴丙烷是一种重要的有机合成中间体,沸点为71 ℃,密度为1.36 g·cm-3。实验室制备少量1溴丙烷的主要步骤如下: 步骤1:在仪器A中加入搅拌磁子、12 g正丙醇及20 mL水,冰水冷却下缓慢加入28 mL浓H2SO4;冷却至室温,搅拌下加入24 g NaBr。 步骤2:如图所示搭建实验装置,缓慢加热,直到无油状物馏出为止。 步骤3:将馏出液转入分液漏斗,分出有机相。 步骤4:将分出的有机相转入分液漏斗,依次用12 mL H2O、12 mL 5% Na2CO3溶液和12 mL - 43 - H2O洗涤,分液,得粗产品,进一步提纯得1溴丙烷。 (1)仪器A的名称是________________;加入搅拌磁子的目的是搅拌和________________。 (2)反应时生成的主要有机副产物有2溴丙烷和________________。 (3)步骤2中需向接收瓶内加入少量冰水并置于冰水浴中的目的是________________。 (4)步骤2中需缓慢加热使反应和蒸馏平稳进行,目的是________________。 (5)步骤4中用5% Na2CO3溶液洗涤有机相的操作:向分液漏斗中小心加入12 mL 5% Na2CO3溶液,振荡,____________________________________,静置,分液。 解析:(1)仪器A为蒸馏烧瓶,搅拌磁子的作用是搅拌和防止暴沸。(2)反应物中的正丙醇可能发生消去反应生成丙烯,也可能发生分子间脱水反应生成正丙醚。(3)向接收瓶内加入少量冰水并置于冰水浴中,降低了接收瓶内的温度,减少了1溴丙烷的挥发。(4)HBr易挥发,故需缓慢加热。(5)振荡后,要排出分液漏斗中的气体。 答案:(1)蒸馏烧瓶 防止暴沸 (2)丙烯、正丙醚 (3)减少1溴丙烷的挥发 (4)减少HBr挥发 (5)将分液漏斗下口向上倾斜、打开活塞排出气体 1.硫酸铁铵[NH4Fe(SO4)2·xH2O]是一种重要铁盐。为充分利用资源,变废为宝,在实验室中探究采用废铁屑来制备硫酸铁铵,具体流程如下: 回答下列问题: (1)步骤①的目的是去除废铁屑表面的油污,方法是________________。 (2)步骤②需要加热的目的是________________,温度保持80~95 ℃,采用的合适加热方式是________。铁屑中含有少量硫化物,反应产生的气体需要净化处理,合适的装置为________(填标号)。 (3)步骤③中选用足量的H2O2,理由是_______________________________________ - 43 - ________________________________________________________________________。 分批加入H2O2,同时为了________________,溶液要保持pH小于0.5。 (4)步骤⑤的具体实验操作有______________,经干燥得到硫酸铁铵晶体样品。 (5)采用热重分析法测定硫酸铁铵晶体样品所含结晶水数,将样品加热到150 ℃时失掉1.5个结晶水,失重5.6%。硫酸铁铵晶体的化学式为______________。 解析:(1)除去铁屑表面油污的方法是用热纯碱溶液清洗铁屑,再用水洗。(2)铁与稀硫酸反应时加热,可提高反应速率。温度低于水的沸点,可以用热水浴加热,受热均匀且便于控制。含少量硫化物的铁屑与稀硫酸反应有H2S生成。氢气不与碱溶液反应,而硫化氢能与碱溶液反应,而H2S在水中溶解度小,故氢气中混有的硫化氢用烧碱溶液除去,又因为硫化氢与碱反应较快,容易引起倒吸,C装置倒置漏斗能防倒吸,故宜选择C装置吸收硫化氢。(3)铁与稀硫酸反应生成硫酸亚铁和氢气,加入足量双氧水的目的是将Fe2+全部氧化为Fe3+,发生反应为2Fe2++H2O2 +2H+===2Fe3++2H2O,从生成物看,又不引入杂质。铁离子对双氧水分解起催化作用,分批加入双氧水,避免反应过快、放出热量较多,减少双氧水分解,以免造成氧化剂损失;铁离子易水解,保持溶液呈强酸性,避免铁离子发生水解反应生成氢氧化铁。(4)步骤⑤是要从溶液中得到硫酸铁铵晶体,故实验操作有加热浓缩、冷却结晶、过滤(洗涤)。(5)失重5.6%是质量分数,设结晶水合物的化学式为NH4Fe(SO4)2·xH2O,由题意知=5.6%,解得x=12。 答案:(1)碱煮水洗 (2)加快反应 热水浴 C (3)将Fe2+全部氧化为Fe3+;不引入杂质 防止Fe3+水解 (4)加热浓缩、冷却结晶、过滤(洗涤) (5)NH4Fe(SO4)2·12H2O 2.环己烯是重要的化工原料。其实验室制备流程如下: 回答下列问题: (1)原料环己醇中若含苯酚杂质,检验试剂为____________,现象为__________________。 (2)操作1的装置如图所示(加热和夹持装置已略去)。 - 43 - ①烧瓶A中进行的可逆反应化学方程式为________________________,浓硫酸也可做该反应的催化剂,选择FeCl3·6H2O而不用浓硫酸的原因为________(填序号)。 a.浓硫酸易使原料炭化并产生SO2 b.FeCl3·6H2O污染小、可循环使用,符合绿色化学理念 c.同等条件下,用FeCl3·6H2O比浓硫酸的平衡转化率高 ②仪器B的作用为__________________________________________________________。 (3)操作2用到的玻璃仪器是____________。 (4)将操作3(蒸馏)的步骤补齐:安装蒸馏装置,加入待蒸馏的物质和沸石,____________,弃去前馏分,收集83 ℃的馏分。 解析:(1)利用苯酚遇FeCl3溶液显紫色,检验环己醇中含有的苯酚。(2)①烧瓶A中进行的可逆反应为+H2O。a项,浓硫酸易使原料炭化并产生SO2,会降低原料利用率,正确;b项,使用FeCl3·6H2O不产生有毒气体,污染小,可以循环使用,符合绿色化学理念,正确;c项,同等条件下,浓硫酸能吸收反应生成的水,促进反应向右进行,故用浓硫酸比用FeCl3·6H2O的平衡转化率高,错误。②仪器B的作用为冷凝回流,减少环己醇蒸出。(3)操作2得到有机相和水相,为分液操作,用到的玻璃仪器有分液漏斗、烧杯。(4)蒸馏实验开始时,先通冷凝水,后加热。 答案:(1)FeCl3溶液 溶液显紫色 (2)①OH+H2O ab ②冷凝回流,减少环己醇蒸出 (3)分液漏斗、烧杯 (4)通冷凝水,加热 3.二茂铁是一种具有芳香族性质的有机过渡金属化合物。二茂铁的熔点是173 ℃,在100 - 43 - ℃时开始升华,沸点是249 ℃,不溶于水,易溶于苯、乙醚、汽油、柴油等有机溶剂;化学性质稳定,400 ℃以内不分解。 实验室制备二茂铁的装置示意图如图1,实验步骤为 ①在三颈烧瓶中加入25 g粉末状的KOH,并从仪器a中加入60 mL无水乙醚,充分搅拌,同时通氮气约10 min; ②再从仪器a滴入5.5 mL新蒸馏的环戊二烯(C5H6、密度为0.95 g/cm3),搅拌; ③将6.5 g无水FeCl2与(CH3)2SO(二甲亚砜,做溶剂)配成的溶液25 mL装入仪器a中,慢慢滴入三颈烧瓶中,45 min滴完,继续搅拌45 min; ④再从仪器a加入25 mL无水乙醚搅拌; ⑤将三颈烧瓶中液体转入分液漏斗,依次用盐酸、水各洗涤两次,分液得橙黄色溶液; ⑥蒸发橙黄色溶液,得二茂铁粗产品。 回答下列问题: (1)仪器b的名称是________________,作用是________________________________ ________________________________________________________________________。 (2)步骤①中通入氮气的目的是_______________________________________________ ________________________________________________________________________。 (3)三颈烧瓶的适宜容积应为________(填序号)。 ①100 mL ②250 mL ③500 mL 步骤⑤所得的橙黄色溶液的溶剂是___________________________________________。 (4)KOH、FeCl2、C5H6反应生成二茂铁[Fe(C5H5)2]和KCl的化学方程式为 ________________________________________________________________________ ________________________________________________________________________。 (5)二茂铁粗产品的提纯过程在图2中进行,其操作名称为________。二茂铁及其衍生物可做抗震剂用于制无铅汽油,它们比曾经使用过的四乙基铅安全得多,其中一个重要的原因是________________________________________________________________________。 (6)最终得到纯净的二茂铁4.8 g,则该实验的产率为________(保留两位有效数字)。 - 43 - 解析:(1)仪器b的名称是(球形)冷凝管,其作用为冷凝回流有机物。 (2)该实验过程中用到试剂氯化亚铁,它易被空气中的氧气氧化,所以需要通入氮气,将装置中的空气排尽。 (3)根据题给的试剂的体积可知,60 mL+5.5 mL+25 mL+25 mL=115.5 mL,所以三颈烧瓶的适宜容积应为250 mL;步骤⑤所得的橙黄色溶液的溶剂是乙醚和二甲亚砜。 (4)由生成物可知,该反应为非氧化还原反应,KOH、FeCl2、C5H6反应生成二茂铁[Fe(C5H5)2]和KCl,化学方程式为2KOH+FeCl2+2C5H6===Fe(C5H5)2+2KCl+2H2O。 (5)由题给信息:二茂铁的熔点是173 ℃,在100 ℃时开始升华,所以二茂铁粗产品的提纯操作名称为升华;二茂铁及其衍生物可做抗震剂用于制无铅汽油,它们比曾经使用过的四乙基铅安全得多,其中一个重要的原因是四乙基铅反应后的产物会造成空气污染。 (6)根据反应2KOH+FeCl2+2C5H6===Fe(C5H5)2+2KCl+2H2O可知,KOH、FeCl2均过量,应以C5H6的量来计算二茂铁的产率。5.5 mL C5H6的物质的量为≈0.079 mol,则生成Fe(C5H5)2的物质的量为0.039 5 mol,质量为0.039 5 mol×186 g/mol=7.347 g,该实验的产率为×100%≈65%。 答案:(1)(球形)冷凝管 冷凝回流有机物(或冷凝回流乙醚、环戊二烯和二甲亚砜) (2)将装置中的空气排尽,防止实验过程中Fe2+被氧化 (3)② 乙醚和二甲亚砜 (4)2KOH+FeCl2+2C5H6===Fe(C5H5)2+2KCl+2H2O (5)升华 四乙基铅反应后的产物会造成空气污染 (6)65% 4.(2015·高考江苏卷)实验室以苯甲醛为原料制备间溴苯甲醛(实验装置见下图,相关物质的沸点见附表)。 附表 相关物质的沸点(101 kPa) 物质 沸点/℃ 物质 沸点/℃ - 43 - 溴 58.8 1,2二氯乙烷 83.5 苯甲醛 179 间溴苯甲醛 229 其实验步骤为 步骤1:将三颈瓶中的一定配比的无水AlCl3、1,2二氯乙烷和苯甲醛充分混合后,升温至60 ℃,缓慢滴加经浓H2SO4干燥过的液溴,保温反应一段时间,冷却。 步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液。有机相用10% NaHCO3 溶液洗涤。 步骤3:经洗涤的有机相加入适量无水MgSO4固体,放置一段时间后过滤。 步骤4:减压蒸馏有机相,收集相应馏分。 (1)实验装置中冷凝管的主要作用是________,锥形瓶中的溶液应为________。 (2)步骤1所加入的物质中,有一种物质是催化剂,其化学式为________。 (3)步骤2中用10% NaHCO3溶液洗涤有机相,是为了除去溶于有机相的________(填化学式)。 (4)步骤3中加入无水MgSO4固体的作用是__________________________________ ________________________________________________________________________。 (5)步骤4中采用减压蒸馏技术,是为了防止__________________________________。 解析:(1)由表中数据可知,溴的沸点只有58.8 ℃,加热至 60 ℃时,会造成大量溴的挥发,因此冷凝管的主要作用是冷凝回流溴。因Br2有毒,可用NaOH溶液吸收未被冷凝的Br2。 (2)由步骤1可知,三颈瓶中加入的物质有无水AlCl3、1,2二氯乙烷、苯甲醛和液溴,1,2二氯乙烷应是溶剂,无水AlCl3应是催化剂。 (3)因Br2易溶于有机相,步骤2加盐酸时,也会导致少量HCl溶于有机相。Br2和HCl都易与NaHCO3溶液发生化学反应,则加10% NaHCO3溶液的目的是除去有机相中的Br2和HCl。 (4)无水MgSO4是一种常用的有机物干燥剂,可除去有机相中的少量水分。 (5)间溴苯甲醛中的醛基易被空气中的O2氧化为羧基,温度越高被氧化得越快;减压蒸馏可降低蒸馏温度。因此,采用减压蒸馏技术是为了防止间溴苯甲醛被氧化。 答案:(1)冷凝回流 NaOH溶液 (2)AlCl3 (3)Br2、HCl (4)除去有机相中的水 (5)间溴苯甲醛被氧化 性质探究类综合实验 - 43 - 1.题型特点 该类题型以探究物质未知的性质,主要包括酸碱性、氧化性、还原性、热稳定性等以及可能发生的反应为主要目的。在性质探究实验中主要考查试剂的选择、装置仪器的规范、步骤优化、实验设计、现象的探究和结论的评价等综合分析能力。 2.研究物质性质的基本方法和程序 3.注意事项 (1)若探究影响物质性质的因素,首先应确定变量,其次是“定多变一”,即其他因素不变,只改变一种因素,看这种因素与探究的问题存在怎样的关系。 (2)多角度辩证地看问题 ①研究反应物中各微粒的性质(即内因)。 ②研究反应条件的影响(温度、浓度、环境中的其他物质)。 ③装置中的空气(氧气、水蒸气、二氧化碳)是否对性质实验有影响,如何避免。 1.(2019·高考江苏卷)实验室以工业废渣(主要含CaSO4·2H2O,还含少量SiO2、Al2O3、Fe2O3)为原料制取轻质CaCO3和(NH4)2SO4晶体,其实验流程如下: (1)室温下,反应CaSO4(s)+CO(aq)CaCO3(s)+SO(aq)达到平衡,则溶液中=_______________________________________________________________ [Ksp(CaSO4)=4.8×10-5,Ksp(CaCO3)=3×10-9]。 (2)将氨水和NH4HCO3溶液混合,可制得(NH4)2CO3溶液, - 43 - 其离子方程式为________________________________________________________________________; 浸取废渣时,向(NH4)2CO3溶液中加入适量浓氨水的目的是______________________。 (3)废渣浸取在如图所示的装置中进行。控制反应温度在60~70 ℃,搅拌,反应3小时。温度过高将会导致CaSO4的转化率下降,其原因是____________________________________; 保持温度、反应时间、反应物和溶剂的量不变,实验中提高CaSO4转化率的操作有________________________________________________________________________。 (4)滤渣水洗后,经多步处理得到制备轻质CaCO3所需的CaCl2溶液。设计以水洗后的滤渣为原料,制取CaCl2溶液的实验方案:___________________________________[已知pH=5时Fe(OH)3和Al(OH)3沉淀完全;pH=8.5时Al(OH)3开始溶解。实验中必须使用的试剂:盐酸和Ca(OH)2]。 解析:(1)====1.6×104。(2)HCO与NH3·H2O反应生成CO、NH和H2O。CO水解显碱性,加入NH3·H2O可以抑制CO水解,增加溶液中CO的浓度,促进CaSO4转化为CaCO3。(3)(NH4)2CO3受热易分解,所以反应环境温度不能过高。加快搅拌速率,可提高CaSO4的转化率。(4)水洗之后的滤渣的主要成分为SiO2、Al2O3、Fe2O3和CaCO3,将滤渣分批加入盐酸中,可以使其与盐酸充分反应,CaCO3与HCl反应会有气泡产生,当看不到气泡时,过滤除去SiO2等不溶物,此时滤液中含有Al3+、Fe3+和Ca2+,加入Ca(OH)2,调节pH介于5~8.5时,Al3+和Fe3+完全以沉淀形式存在,然后过滤得CaCl2溶液。 答案:(1)1.6×104 (2)HCO+NH3·H2O===NH+CO+H2O 增加溶液中CO的浓度,促进CaSO4的转化 (3)温度过高,(NH4)2CO3分解 加快搅拌速率 (4)在搅拌下向足量稀盐酸中分批加入滤渣,待观察不到气泡产生后,过滤,向滤液中分批加入少量Ca(OH)2,用pH试纸测量溶液pH,当pH介于5~8.5时,过滤 2.(2016·高考江苏卷)实验室以一种工业废渣(主要成分为MgCO3、Mg2SiO4 - 43 - 和少量Fe、Al的氧化物)为原料制备MgCO3·3H2O。实验过程如下: (1)酸溶过程中主要反应的热化学方程式为 MgCO3(s)+2H+(aq)===Mg2+(aq)+CO2(g)+H2O(l) ΔH=-50.4 kJ·mol-1 Mg2SiO4(s)+4H+(aq)===2Mg2+(aq)+H2SiO3(s)+H2O(l) ΔH=-225.4 kJ·mol-1 酸溶需加热的目的是________;所加H2SO4不宜过量太多的原因是__________________。 (2)加入H2O2氧化时发生反应的离子方程式为_________________________________ ________________________________________________________________________。 (3)用如图所示的实验装置进行萃取分液,以除去溶液中的Fe3+。 ①实验装置图中仪器A的名称为________。 ②为使Fe3+尽可能多地从水相转移至有机相,采取的操作:向装有水溶液的仪器A中加入一定量的有机萃取剂,________、静置、分液,并重复多次。 (4)请补充完整由萃取后得到的水溶液制备MgCO3·3H2O的实验方案:边搅拌边向溶液中滴加氨水,________________________________________________________________ ________________________________________________________________________ ________________________________________________________________________, 过滤、用水洗涤固体2~3次,在50 ℃下干燥,得到MgCO3·3H2O。[已知该溶液中pH=8.5时 Mg(OH)2开始沉淀;pH=5.0时Al(OH)3沉淀完全] 解析:(1)酸溶时需加热,目的是加快溶解速率。(2)加入H2O2的目的是将Fe2+氧化为Fe3+,离子方程式为2Fe2++H2O2+2H+===2Fe3++2H2O。(3)①仪器A为分液漏斗。②加入有机萃取剂后,应充分振荡、静置、分液,并重复多次。(4)制备MgCO3·3H2O时,向溶液中滴加氨水,调节至5.0查看更多
相关文章
- 当前文档收益归属上传用户
- 下载本文档