- 2021-04-20 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020_2021学年高中化学专题2从海水中获得的化学物质1_1氯气课时作业含解析苏教版必修1
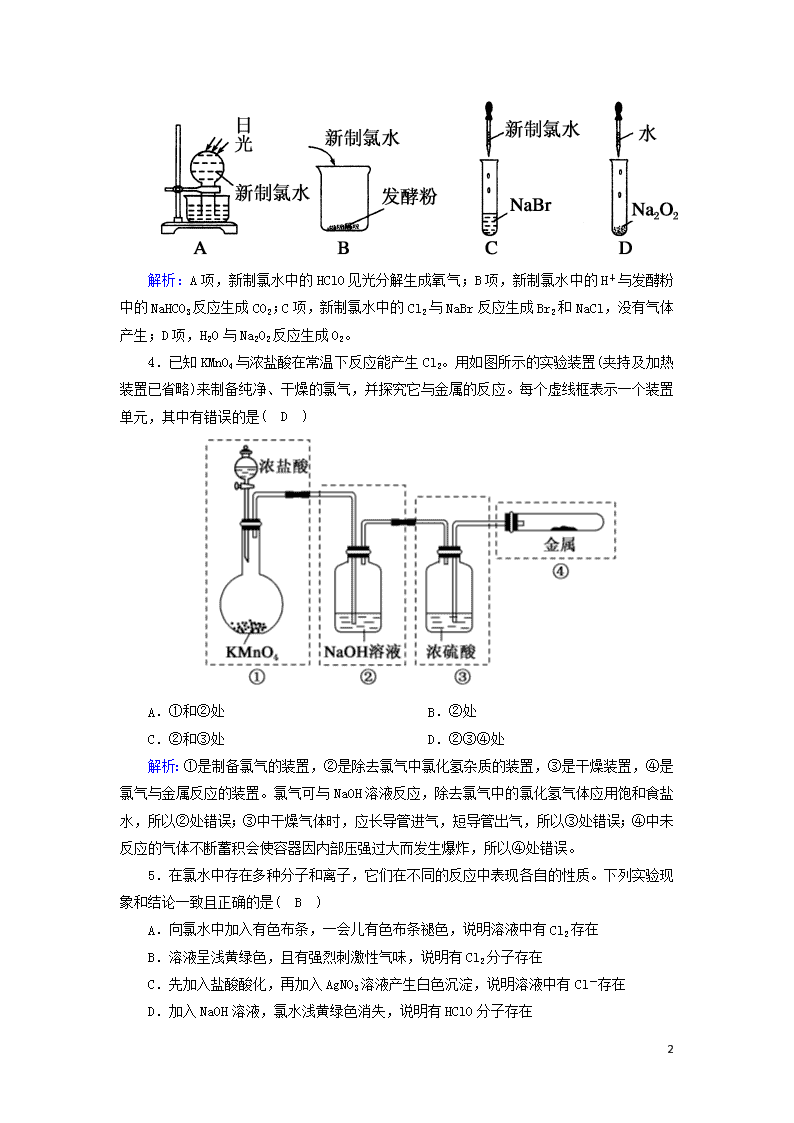
课时作业10 氯气 时间:45分钟 满分:100分 一、选择题(每小题4分,共48分) 1.下列说法正确的是( C ) ①Cl2的性质活泼,与H2混合后立即发生爆炸 ②实验室制取Cl2时,为了防止环境污染,多余的Cl2可以用Ca(OH)2溶液吸收 ③若Cl2发生泄漏,应立即向上风地区转移 ④检验HCl气体中是否混有Cl2,方法是将气体通入AgNO3溶液中 ⑤除去HCl气体中的Cl2,可将气体通入饱和食盐水中 A.①②③ B.②③④ C.③ D.③⑤ 解析:Cl2与H2混合,达到爆炸极限时,在点燃或光照的条件下能发生爆炸,①错误;Ca(OH)2的溶解度小,溶液中溶质含量少,实验室中通常用NaOH溶液吸收多余的Cl2,②错误,排除A、B项;HCl气体与AgNO3溶液反应可产生AgCl沉淀,④错误;将混合气体通入饱和食盐水中,除去的是HCl气体,而不是Cl2,⑤错误,排除D项。 2.现有四种黑色粉末,分别为MnO2、CuO、炭粉、铁粉,只需加入一种试剂并进行适当的操作就可以将它们区分开,这种试剂是( B ) A.氢氧化钠溶液 B.浓盐酸 C.稀硫酸 D.稀盐酸 解析:A项,四种物质均不与氢氧化钠溶液反应,不能区分开,A项错误;B项,MnO2与浓盐酸在加热条件下生成黄绿色气体,CuO与浓盐酸反应得到蓝色溶液,铁粉与浓盐酸反应得到绿色溶液和无色气体,炭粉与浓盐酸不反应,故用浓盐酸可以区分四种物质,B项正确;C项,MnO2、炭粉均不与稀硫酸反应,不能区分,C项错误;D项,MnO2、炭粉均不与稀盐酸反应,不能区分,D项错误。 3.下列实验过程中,不会产生气体的是( C ) 8 解析:A项,新制氯水中的HClO见光分解生成氧气;B项,新制氯水中的H+与发酵粉中的NaHCO3反应生成CO2;C项,新制氯水中的Cl2与NaBr反应生成Br2和NaCl,没有气体产生;D项,H2O与Na2O2反应生成O2。 4.已知KMnO4与浓盐酸在常温下反应能产生Cl2。用如图所示的实验装置(夹持及加热装置已省略)来制备纯净、干燥的氯气,并探究它与金属的反应。每个虚线框表示一个装置单元,其中有错误的是( D ) A.①和②处 B.②处 C.②和③处 D.②③④处 解析:①是制备氯气的装置,②是除去氯气中氯化氢杂质的装置,③是干燥装置,④是氯气与金属反应的装置。氯气可与NaOH溶液反应,除去氯气中的氯化氢气体应用饱和食盐水,所以②处错误;③中干燥气体时,应长导管进气,短导管出气,所以③处错误;④中未反应的气体不断蓄积会使容器因内部压强过大而发生爆炸,所以④处错误。 5.在氯水中存在多种分子和离子,它们在不同的反应中表现各自的性质。下列实验现象和结论一致且正确的是( B ) A.向氯水中加入有色布条,一会儿有色布条褪色,说明溶液中有Cl2存在 B.溶液呈浅黄绿色,且有强烈刺激性气味,说明有Cl2分子存在 C.先加入盐酸酸化,再加入AgNO3溶液产生白色沉淀,说明溶液中有Cl-存在 D.加入NaOH溶液,氯水浅黄绿色消失,说明有HClO分子存在 8 解析:氯水中使有色布条褪色的是HClO分子;呈浅黄绿色的是Cl2分子;能与AgNO3反应生成白色沉淀的是Cl-,但前提是不能加入盐酸酸化(引入了Cl-);加入NaOH溶液,NaOH与Cl2、HCl、HClO都发生反应,最终使Cl2消耗完而失去浅黄绿色。 6.利用如图所示装置可以检验氯气的部分性质,下列说法不正确的是( D ) A.装置A的作用是除去氯气中的水蒸气 B.该实验必须在通风橱中进行 C.装置C中发生的反应为Cl2+2NaOH===NaCl+NaClO+H2O D.装置B中的现象是干燥的有色布条褪色,湿润的有色布条不褪色 解析:A项,浓硫酸具有吸水性,与氯气不反应,则装置A的作用是除去氯气中的水蒸气,故A项正确;B项,氯气有毒,则该实验必须在通风橱中进行,故B项正确;C项,装置C中的NaOH溶液用来吸收尾气,发生的反应为Cl2+2NaOH===NaCl+NaClO+H2O,故C项正确;D项,装置B中干燥的有色布条不褪色,而湿润的有色布条褪色,故D项错误。 7.下列有关氯气及其化合物的说法不正确的是( D ) A.氯气能与大多数金属化合,其一般将变价金属氧化至最高价态 B.干燥的氯气和氯水均能使鲜花褪色 C.除去氯气中的少量氯化氢可使气体通过饱和食盐水 D.因为氯气有毒,所以具有杀菌、消毒、漂白的作用 解析:A项,氯气是强氧化剂,能将变价金属氧化至最高价态,故A项正确;B项,因干燥的氯气遇到鲜花(含水)生成次氯酸,氯水中含有次氯酸,所以鲜花都褪色,故B项正确;C项,因氯气难溶于饱和食盐水,而氯化氢易溶于饱和食盐水,所以可用饱和食盐水除去氯气中的少量氯化氢,故C项正确;D项,Cl2遇水生成的次氯酸具有杀菌、消毒、漂白的作用,故D项错误。 8.下列有关实验现象与分析或结论都正确的是( C ) 选项 实验现象 分析或结论 A 光照新制氯水有气泡冒出 氯水中含有Cl2,光照时Cl2逸出 B 液氯滴到干燥的有色布条上,有色布条会褪色 液氯中的次氯酸具有漂白性 C 向NaHCO3 氯水中含有的盐酸与NaHCO3反应产生CO2 8 固体中加入新制氯水,有无色无味的气体产生 气体 D 新制氯水放置数天后,pH增大 氯化氢具有挥发性,溶液的酸性减弱 解析:A项,光照新制氯水时,氯水中的次氯酸分解产生O2,A项错误;B项,氯气没有漂白性,液氯滴到干燥的有色布条上,有色布条不会褪色,液氯中不含次氯酸,B项错误;C项,向NaHCO3固体中加入新制氯水,有无色无味的气体产生,这是由于氯水中含有的盐酸与NaHCO3发生反应产生了CO2气体,C项正确;D项,新制氯水放置数天后,次氯酸分解产生盐酸,pH将减小,溶液酸性增强,D项错误。 9.向盛有Cl2的三个集气瓶甲、乙、丙中各注入下列液体中的一种,经过振荡,现象如图所示,则甲、乙、丙中注入的液体分别是( B ) ①AgNO3溶液 ②NaOH溶液 ③水 A.①②③ B.②①③ C.③②① D.①③② 解析:甲中气体和溶液都无色,说明不存在Cl2,是加入NaOH溶液;乙中气体无色且溶液中出现白色浑浊,说明不存在Cl2,且溶液中生成了白色沉淀,是加入AgNO3溶液;丙中气体和溶液都呈浅黄绿色,说明存在Cl2,是加入水。 10.化学来源于生活,也服务于生活,下列有关生活中的化学知识叙述正确的是( B ) A.氯气和活性炭均可作为漂白剂,若同时使用,漂白效果会明显加强 B.氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂 C.测定溶液pH的实验中,用干燥pH试纸测定新制氯水的pH对测定结果无影响 D.洁厕灵不能与“84”消毒液混用,原因是两种溶液混合产生的HClO易分解 解析:活性炭具有吸附性,可以吸附氯气,同时使用时漂白效果不会增强,A错误;氯气与烧碱溶液或石灰乳反应均可生成次氯酸盐,B正确;氯水中的次氯酸具有漂白性,能漂白pH试纸,C错误;洁厕灵与“84”消毒液不能混用的原因是消毒液中的NaClO与洁厕灵中的HCl反应生成Cl2,D错误。 11.世界卫生组织将ClO2定为A级高效安全灭菌消毒剂,它在食品保鲜、饮用水消毒等方面有广泛应用。消毒效率是用单位质量的消毒剂得电子数来表示的,ClO2作消毒剂时和氯气一样,还原产物均为Cl-。下列关于ClO2的说法正确的是( C ) A.ClO2的摩尔质量为67.5 B.从分类上来看,ClO2属于金属氧化物 8 C.ClO2的消毒效率是氯气的2.63倍 D.ClO2分子中氯元素与氧元素的质量比为12 解析:A项,摩尔质量应带单位;B项,从分类上来看,ClO2属于非金属氧化物;C项,ClO2的消毒效率为5/67.5,氯气的消毒效率为2/71,故ClO2的消毒效率是氯气的2.63倍;D项,ClO2分子中氯原子与氧原子的个数比为12,氯元素与氧元素的质量比为35.532。 12.已知:KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O。如图所示,将少量试剂分别放入培养皿中的相应位置,实验时将浓盐酸滴在KClO3晶体上,并用表面皿盖好。如表中由实验现象得出的结论完全正确的是( D ) 选项 实验现象 结论 A 滴有KSCN的FeCl2溶液变红色 Cl2具有还原性 B 滴有酚酞的NaOH的溶液褪色 Cl2具有酸性 C 石蕊溶液先变红后褪色 Cl2具有漂白性 D 淀粉KI溶液中变为蓝色 Cl2具有氧化性 解析:A项说明Cl2具有氧化性。B项是Cl2与H2O反应生成了有漂白性的次氯酸。C项是Cl2与H2O反应生成的HCl具有酸性,HClO具有漂白性。D项的反应为Cl2+2KI===2KCl+I2,说明Cl2具有氧化性。 二、非选择题(共52分) 13.(15分)Cl2是一种重要的化工原料,下图是一些含氯产品。 (1)①中钢瓶上应贴的标签为C。 8 A.腐蚀品 B.爆炸品 C.有毒品 D.易燃品 (2)下列有关漂白粉和漂白液的说法正确的是B。 A.漂白粉是纯净物,漂白液是混合物 B.漂白粉的有效成分是Ca(ClO)2 C.工业上将氯气通入澄清石灰水中制取漂白粉 D.漂白液的有效成分是Na2O2 (3)工业上利用Cl2制取盐酸,其化学方程式为H2+Cl22HCl。Cl2溶于水可制得氯水,检验一瓶氯水是否已经完全变质,可选用的试剂是D。 A.硝酸银溶液 B.酚酞溶液 C.碳酸钠溶液 D.紫色石蕊溶液 (4)将8.7 g MnO2与足量浓盐酸混合加热,反应生成氯气的体积是2.24 L(标准状况);被氧化的HCl的质量是7.3 g。 解析:(1)Cl2有毒,贮存Cl2的钢瓶应贴的标签为有毒品。 (2)漂白粉的有效成分是Ca(ClO)2,漂白液的有效成分是NaClO,二者均是混合物,A、D项错误;制取漂白粉时,不用澄清石灰水,因氢氧化钙的溶解度较小,一般用石灰乳,也可用氯气与稍湿的消石灰作用制得,C项错误。 (3)久置氯水的成分为稀盐酸,新制氯水的成分为Cl2、HCl、HClO,新制氯水和稀盐酸均与AgNO3溶液反应生成白色沉淀,均与Na2CO3溶液反应放出CO2气体,遇酚酞溶液均无明显现象。新制氯水中加入紫色石蕊溶液,溶液先变红后褪色,而稀盐酸中加入紫色石蕊溶液,溶液只变红色。 (4)利用化学方程式进行计算。 MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O 87 g 4 mol 22.4 L 8.7 g n(HCl) V(Cl2) == 解得V(Cl2)=2.24 L,n(HCl)=0.4 mol。 被氧化的HCl为0.2 mol,质量为0.2 mol×36.5 g/mol=7.3 g。 14.(15分)新制氯水能使干燥的红色布条褪色。对于使干燥的红色布条褪色的物质,同学们的看法不一致,认为新制氯水中存在的几种粒子都有可能。请设计实验,得出正确结论。 (1)提出假设 8 假设1 :氯气使干燥的红色布条褪色; 假设2:HClO使干燥的红色布条褪色; 假设3:盐酸使干燥的红色布条褪色(顺序可调); 假设4:H2O使干燥的红色布条褪色。 (2)设计方案 基于提出的假设,设计出实验方案。 (3)实验过程和现象 实验①:把干燥的红色布条放入充满氯气的集气瓶中,红色布条不褪色; 实验②:把干燥的红色布条放入盐酸中,红色布条不褪色(顺序可调); 实验③:把干燥的红色布条放在水里,红色布条不褪色。 (4)得出结论:次氯酸使干燥的红色布条褪色。 (5)实验过程中,为防止氯气外逸,用化学方程式表示处理方法:Cl2+2NaOH===NaCl+NaClO+H2O。 解析:(1)新制氯水的成分有氯气、水、次氯酸、盐酸,这些物质都有可能导致红色布条褪色,据此可提出相应假设。(3)干燥的氯气中不存在H2O、HClO、HCl,比较氯气和新制氯水成分的区别,据此设计三个实验:氯气与干燥的红色布条作用、盐酸与干燥的红色布条作用、水与干燥的红色布条作用,即可证明到底是哪一种物质导致红色布条褪色。(4)把干燥的红色布条放在水里,红色布条不褪色,说明H2O没有漂白性,氯气与干燥的红色布条作用、盐酸与干燥的红色布条作用,红色布条均不褪色,说明氯气、盐酸都没有漂白性,故可确定红色布条褪色是由HClO引起的。(5)Cl2逸出到空气中,污染环境,可用NaOH溶液吸收多余的Cl2。 15.(22分)某化学实验小组用浓盐酸和MnO2反应制取并探究Cl2的化学性质,设计如图所示装置。 (1)A是氯气发生装置(省略未画),制备Cl2的化学方程式是MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O,A装置除了酒精灯、圆底烧瓶、导管外还用到的主要玻璃仪器有分液漏斗。 8 (2)从C装置出来的气体中含有CO2和HCl,则在C装置中发生反应的化学方程式为2Cl2+2H2O+CCO2+4HCl。 (3)同学们在实验中发现,若用稀盐酸代替浓盐酸,与MnO2混合加热时没有氯气生成,于是开始探究该条件下不能生成氯气的原因。 ①提出合理假设 假设1:H+的浓度不够大; 假设2:Cl-的浓度不够大; 假设3:Cl-和H+的浓度均不够大(顺序和②对应即可)。 ②设计实验方案,进行实验。 限选试剂:蒸馏水、浓硫酸、NaCl固体、MnO2固体、1 mol/L稀盐酸、1 mol/L AgNO3溶液、品红溶液。 8查看更多