- 2021-04-20 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
中考化学计算题专项训练
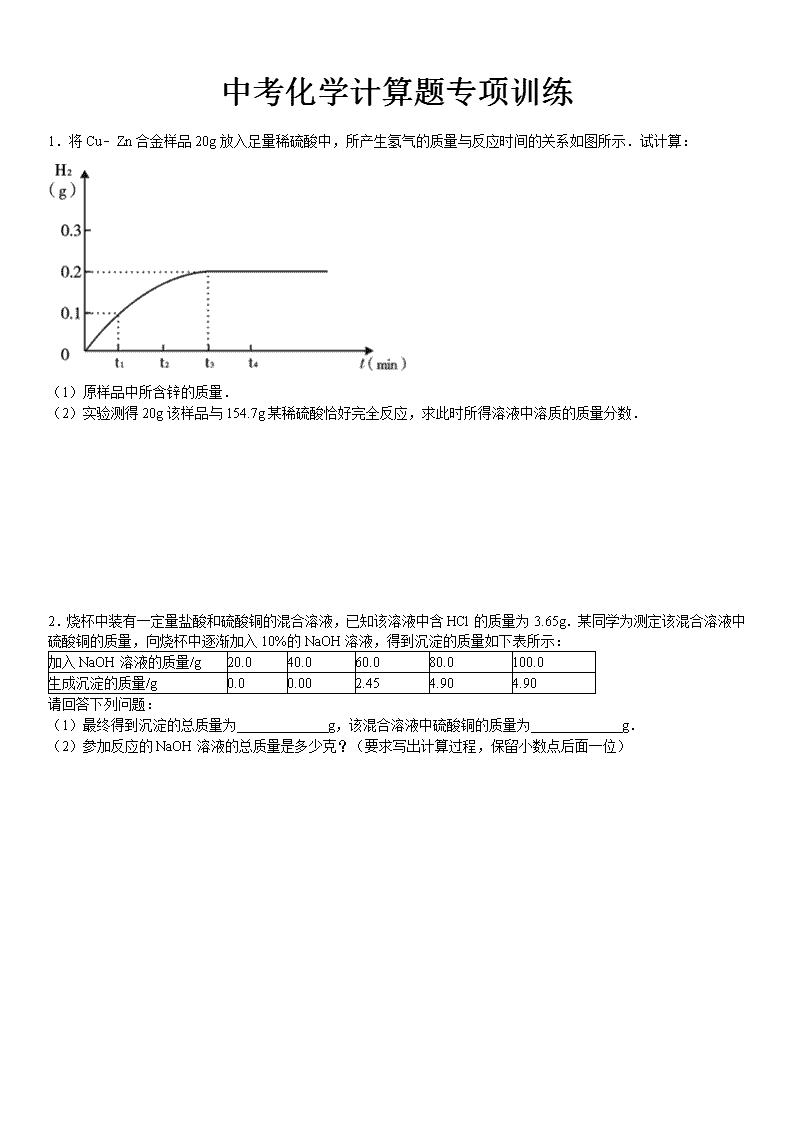
中考化学计算题专项训练 1.将Cu﹣Zn合金样品20g放入足量稀硫酸中,所产生氢气的质量与反应时间的关系如图所示.试计算: (1)原样品中所含锌的质量. (2)实验测得20g该样品与154.7g某稀硫酸恰好完全反应,求此时所得溶液中溶质的质量分数. 2.烧杯中装有一定量盐酸和硫酸铜的混合溶液,已知该溶液中含HCl的质量为3.65g.某同学为测定该混合溶液中硫酸铜的质量,向烧杯中逐渐加入10%的NaOH溶液,得到沉淀的质量如下表所示: 加入NaOH溶液的质量/g 20.0 40.0 60.0 80.0 100.0 生成沉淀的质量/g 0.0 0.00 2.45 4.90 4.90 请回答下列问题: (1)最终得到沉淀的总质量为 _________ g,该混合溶液中硫酸铜的质量为 _________ g. (2)参加反应的NaOH溶液的总质量是多少克?(要求写出计算过程,保留小数点后面一位) 3.为测定某粉末状黄铜(即Cu﹣﹣Zn合金)样品中铜锌的组成,某同学取样品9.75g放入烧杯 中,再取40g稀盐酸溶液分四次加入烧杯中,充分反应后实验数据如下: 第一次 第二次 第三次 第四次 加稀盐酸的质量(g) 10 10 10 10 剩余固体质量(g) 9.10 8.45 7.80 7.80 (1)9.75g黄铜样品中铜的质量 _________ g; (2)第 _________ 次恰好完全反应; (3)计算所用盐酸溶液的溶质质量分数(写出解题过程). 4.为了测定某石灰石中碳酸钙的质量分数.取石灰石样品,与足量质量分数为7.3%的稀盐酸在烧杯(烧杯质量为20g)中充分反应(假设石灰石样品中杂质不与稀盐酸反应也不溶于水).有关实验数据如下表: 反应前 反应后 实验 烧杯和稀盐酸的质量 石灰石样品的质量 烧杯和混合物的质量 数据 120g 12g 127.6g (1)配制上述质量分数为7.3%的稀盐酸,需要质量分数为36.5%的浓盐酸的质量是 _________ ; (2)反应中生成二氧化碳的质量是 _________ . (3)求解l2g该石灰石样品中碳酸钙的质量分数. (4)用120g该石灰石可制得含杂质的生石灰的质量是 _________ . 5.黄铜是铜和锌合金.某化学兴趣小组的同学在测定黄铜样品中铜的含量时,取黄铜样品20g放入烧杯中,向其中加入100g稀硫酸,恰好完全反应.反应后烧杯中剩余物的总质量为119.8g.请计算: (1)反应产生氢气的质量是 _________ g. (2)求黄铜样品中铜的质量分数.(写出计算过程) 6.纯碱样品中含有少量的氯化钠,某同学为测定该纯碱样品中碳酸钠的含量,他取该纯碱样品11g,全部溶解在100g水中,再加入150.7g氯化钡溶液,恰好完全反应,过滤,得到19.7g沉淀(不考虑过程中物质质量的损失).请计算: (1)纯碱样品中碳酸钠的质量; (2)所加氯化钡溶液的溶质质量分数:(计算结果保留到0.1%) (3)反应后所得溶液中溶质的质量分数. 7.将氢氧化钠和硫酸钠的混合物13.8g放入88.2g水中使其完全溶解,再加入98g溶质质量分数为10%的硫酸溶液,恰好完全反应.试计算: (1)98g10%的硫酸溶液中溶质的质量; (2)原混合物中氢氧化钠的质量; (3)反应后所得溶液中溶质的质量分数. 参考答案 1. 分析: Cu﹣Zn合金样品20g放入足量稀硫酸中,只有锌与稀硫酸反应生成硫酸锌和氢气;由产生氢气的质量与反应时间的关系图可知,产生氢气的质量为0.2g,据此根据反应的化学方程式列式计算出参加反应锌的质量、生成硫酸锌的质量,进而可计算出所得溶液中溶质的质量分数. 解答: 解:设原样品中锌的质量为x,生成ZnSO4的质量为y, Zn+H2SO4=ZnSO4+H2↑ 65 161 2 x y 0.2g (1) x=6.5g (2) y=16.1g 反应后溶液的质量为:154.7g+6.5g﹣0.2g=161g, 所得溶液中溶质的质量分数为:×100%=10%. 答:(1)原样品中锌的质量为6.5g; (2)反应后溶液中溶质的质量分数为10%. 点评: 本题难度不是很大,抓住“三点一趋势”(起点、拐点、终点和图象的变化趋势)、分析图象中所给数据的含义、正确的运用有关数据解决问题是解答此类题目的关键所在. 2. 分析: (1)根据图表中信息可知沉淀质量不再增加的质量就是最后的沉淀总质量;根据沉淀的质量计算出硫酸铜的质量; (2)根据氯化氢的质量算出参加反应的氢氧化钠的质量,再根据沉淀的质量算出与硫酸铜反应的氢氧化钠的质量,将二者加在一块,除以10%即可. 解答: 解:(1)根据图表中数据可知生成4.9g沉淀不再反应了,说明最多生成4.9g沉淀;设要生成4.9g沉淀需要参加反应的硫酸铜的质量为X,参加反应的氢氧化钠的质量为Y则: CuSO4+2NaOH═Cu(OH)2↓+Na2SO4 160 80 98 X Y 4.9g 根据:解得X=8.0g,根据:解得Y=4g (2)设与氯化氢反应的氢氧化钠质量为Z则: HCl+NaOH═NaCl+H2O 36.5 40 3.65g Z 根据:解得Z=4g,所以 氢氧化钠的质量总和为4g+4g=8g,所以参加反应的NaOH溶液的总质量是:=80.0g 故答案为:(1)4.9;8.0;(2)80.0g. 点评: 本题容易出错的地方是忽略氢氧化钠有两部分,根据沉淀算出与硫酸铜反应的氢氧化钠,根据氯化氢算出与盐酸反应的氢氧化钠. 3.分析: (1)根据金属活动性可知,铜排在氢后,不能与稀盐酸发生反应,故发生反应的是锌,减少的固体的质量就是参加反应的锌的质量,从第三次与第四次加酸后固体质量不变可得铜的质量; (2)由题目可知:每加入10g盐酸可消耗锌的质量为9.75g﹣9.1g=0.65g,据此分析恰好反应的次数即可; (3)第二次反应消耗锌的质量=9.10g﹣8.45g=0.65g,根据反应的化学方程式,可计算出所加10g稀盐酸中溶质的质量,由溶质的质量分数公式,求出所用稀盐酸中溶质的质量分数; 解答: 解:(1)由第三次和第四次剩余固体质量相等可知,剩余的7.8g固体即为样品中铜的质量,故第三次实验结束时样品中的锌就已完全反应; (2)由于第一次加入10g盐酸固体减少的质量是9.75g﹣9.1g=0.65g,所以可知到第三次时30g盐酸恰好能反应掉样品中的锌; (3)根据金属活动性可知,铜排在氢后,不能与稀盐酸发生反应,故发生反应的是锌,减少的固体的质量就是参加反应的锌的质量,由题目可知:每10g盐酸反应消耗锌的质量是0.65g, 设稀盐酸中溶质的质量为x Zn+2HCl═ZnCl2+H2↑ 65 73 0.65g x x=0.73g 稀盐酸中溶质的质量分数为×100%=7.3% 故答案为:(1)7.8;(2)三;(3)答:所用稀盐酸的质量分数为7.3%. 点评: 根据所给的实验数据分析每次加入10g稀盐酸固体剩余物质量的变化,可对反应进行的情况进行判断,并明确参加反应的是固体中的锌,这是解决本题的关键. 4.分析: (1)根据溶液稀释前后溶质的质量不变来完成解答; (2)根据质量守恒定律可以计算出生成的二氧化碳的质量; (3)根据生成二氧化碳的质量结合反应的化学方程式可以计算出石灰石中碳酸钙的质量,进而求算出样品中碳酸钙的质量分数; (4)根据(2)的解答可以完成该题的解答. 解答: 解:(1)设需要质量分数为36.5%的浓盐酸的质量是x,根据反应前后溶质的质量不变可得:(120g﹣20g)×7.3%=x•36.5% 解得:x=20g (2)根据质量守恒定律可以知道生成二氧化碳的质量为:120g+12g﹣127.6g=4.4g; (3)设l2g该石灰石样品中碳酸钙的质量为y,则: CaCO3+2HCl═CaCl2+H2O+CO2↑ 100 44 y 4.4g 解得:y=10g l2g该石灰石样品中碳酸钙的质量分数为:×100%=83.3% (4)根据碳酸钙分解的化学方程式CaCO3CaO+CO2 ↑可以知道:碳酸钙分解只产生了二氧化碳和氧化钙,所以根据质量守恒定律可以知道石灰石样品的质量减去生成的二氧化碳的质量即为含有杂质的氧化钙的质量,根据(2)的解答可以知道12g石灰石样品产生了4.4g气体,所以120g石灰石样品能够产生二氧化碳的质量为44g,所以用120g该石灰石可制得含杂质的生石灰的质量为:120g﹣44g=76g. 答:(1)配制上述质量分数为7.3%的稀盐酸,需要质量分数为36.5%的浓盐酸的质量是 20g; (2)反应中生成二氧化碳的质量是 4.4g; (3)求解l2g该石灰石样品中碳酸钙的质量分数83.3%; (4)用120g该石灰石可制得含杂质的生石灰的质量是76g. 故答案为:(1)20g; (2)4.4g; (3)83.3%; (4)76g. 点评: 此题是对化学方程式计算的考查,解题的关键是找到已知量,此题则是利用反应前后物质质量的变化求出生成二氧化碳的质量,而后根据它的质量求出其它的需要的物质的质量解答即可. 5.分析: 根据黄铜的成分铜和锌的性质可知,加入稀硫酸时,只有锌与硫酸反应生成了硫酸锌和氢气;根据质量守恒定律,烧杯内质量的减少的质量即生成的氢气质量,据此根据反应的化学方程式列式计算出参加反应锌的质量,进而计算出铜的质量和铜的质量分数. 解答: 解:(1)根据质量守恒定律,产生氢气的质量为:20g+100g﹣119.8g=0.2g.故答案为:0.2. (2)设黄铜样品中锌的质量为x, Zn+H2SO4=ZnSO4+H2↑ 65 2 x 0.2g x=6.5g 黄铜样品中铜的质量分数为:×100%=67.5%. 答:黄铜样品中铜的质量分数为67.5%. 点评: 本题难度不大,掌握根据化学方程式的计算即可正确解答本题,根据质量守恒定律计算出氢气的质量是正确解答本题的前提和关键. 6.分析: (1)根据氯化钠、碳酸钠的性质,氯化钠不能与加入的氯化钡发生反应,碳酸钠与氯化钡生成碳酸钡沉淀和氯化钠,根据生成沉淀碳酸钡的质量可计算样品中所含碳酸钠的质量; (2)根据生成沉淀碳酸钡的质量可计算150.7g氯化钡溶液中所含氯化钡的质量,进一步可求得所加氯化钡溶液的溶质质量分数; (3)恰好完全反应后所得溶液为氯化钠溶液,此时溶液中的溶质氯化钠由原固体中的氯化钠和反应后生成的氯化钠两部分构成,反应后溶液的质量可使用质量守恒定律的方法进行解决,以简化分析. 解答: 解:设样品中碳酸钠的质量为x,反应的氯化钡的质量为y,生成氯化钠的质量为z Na2CO3+BaCl2=BaCO3↓+2NaCl 106 208 197 117 x y 19.7 g z x=10.6g y=20.8g z=11.7g (2)所加氯化钡溶液的溶质质量分数为:×100%=13.8% (3)反应后所得溶液中溶质的质量分数为:×100%=5% 答:(1)纯碱样品中碳酸钠的质量为10.6g; (2)所加氯化钡溶液的溶质质量分数为13.8% (3)反应后所得溶液中溶质的质量分数为5%. 点评: 本道题的第二小题比较难,难点有两个:一是滤液中的溶质氯化钠包括原混合物中的氯化钠和反应生成的氯化钠;二是所得滤液的质量比较难算,不是用溶质的质量+溶剂的质量,而是将所加入的物质的质量全部加起来,再减去生成沉淀的质量. 7.分析: 在混合物中只有氢氧化钠能与硫酸反应,则可利用氢氧化钠与硫酸恰好完全反应的化学反应方程式来计算氢氧化钠的质量,反应后的溶液中溶质为硫酸钠,其质量由两部分,原混合物中硫酸钠的质量和反应生成的硫酸钠的质量,溶液的总质量即为混合物的总质量之和,然后利用质量分数的定义式来解答. 解答: 解:(1)98g10%的硫酸溶液中溶质的质量为:98g×10%=9.8g; (2)设氢氧化钠的质量为x,生成硫酸钠的质量为y 2NaOH+H2SO4=Na2SO4+2H2O 80 98 142 x 9.8g y 解得:x=8g,y=14.2g (3)所得溶液溶质质量分数=×100%=10% 答:(1)硫酸溶液中溶质质量为9.8g;(2)原混合物中氢氧化钠的质量8g;(3)反应后所得溶液中溶质质量分数为10%. 点评: 本题考查学生利用酸碱发生的化学反应方程式来进行的有关计算,学生应明确混合物中的物质能否反应,发生的什么反应,熟悉常见的化学反应是解答此类习题的关键. 查看更多