- 2021-02-26 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届全国I卷高考化学考前适应性试卷(一)(Word版附答案)
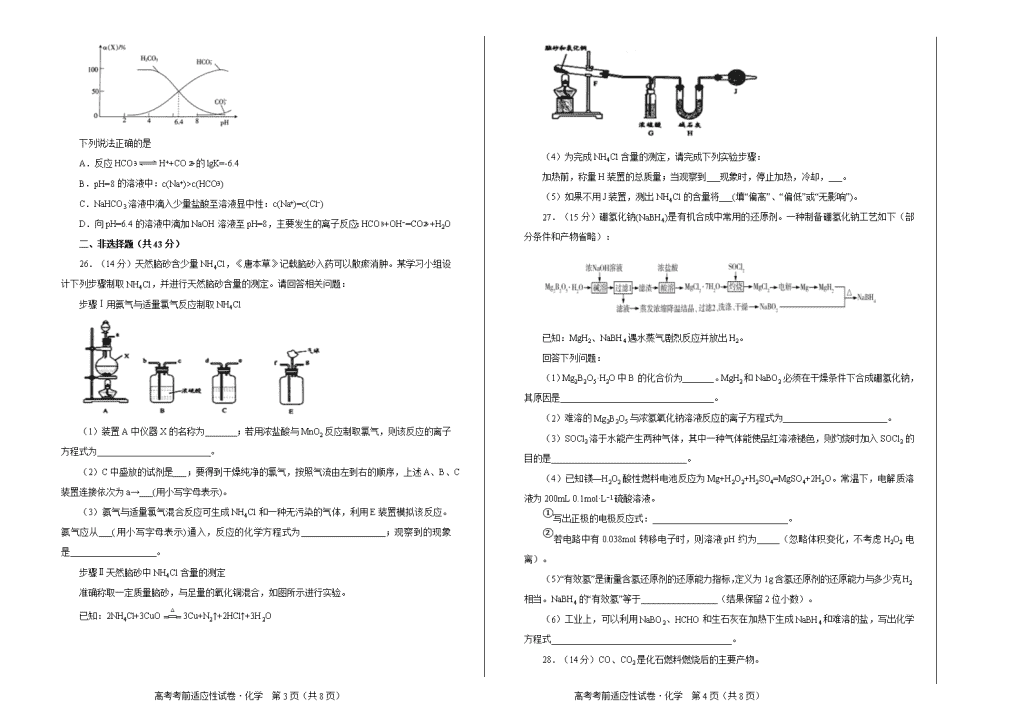
此卷只装订不密封 班级 姓名 准考证号 考场号 座位号 绝密 ★ 启用前 2020年全国I卷高考考前适应性试卷 化 学 (一) 注意事项: 1、本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。答题前,考生务必将自己的姓名、考生号填写在答题卡上。 2、回答第Ⅰ卷时,选出每小题的答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案标号。写在试卷上无效。 3、回答第Ⅱ卷时,将答案填写在答题卡上,写在试卷上无效。 4、考试结束,将本试卷和答题卡一并交回。 可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 K 39 一、选择题:本大题共7小题,每小题6分。在每小题给出的四个选项中,只有一项是符合题目要求的。 7.2019年7月1日起,上海进入垃圾分类强制时代,随后全国各地也纷纷开始实行垃圾分类。这体现了我国保护环境的决心,而环境保护与化学息息相关,下列有关说法正确的是 A.废弃的聚乙烯塑料属于白色垃圾,不可降解,能使溴水褪色 B.可回收的易拉罐中含金属铝,可通过电解氯化铝制取 C.含棉、麻、丝、毛及合成纤维的废旧衣物燃烧处理时均只生成CO2和H2O D.废旧电池中含有镍、镉等重金属,不可用填埋法处理 8.NA为阿伏加德罗常数的值。下列说法正确的是 A.0.1mol的11B中,含有0.6NA个中子 B.pH=1的H3PO4溶液中,含有0.1NA个H+ C.2.24L(标准状况)苯在O2中完全燃烧,得到0.6NA个CO2分子 D.密闭容器中1mol PCl3与1mol Cl2反应制备PCl5(g),增加2NA个P-Cl键 9.某有机化工品R的结构简式如图所示。下列有关R的说法正确的是 A.R的分子式为C10H10O2 B.苯环上一氯代物有2种 C.R能发生加成、氧化和水解反应 D.R分子中所有原子可共平面 10.短周期主族元素X、Y、Z、W原子序数依次增大,X是周期表中原子半径最小的元素,Y是短周期中金属性最强的元素,Z的单质可用于野外焊接铁轨,W的单质为黄绿色气体。下列说法正确的是 A.原子半径:r(W)>r(Z)>r(Y)>r(X) B.X分别与Y、W组成的化合物中含有相同的化学键 C.Y的最高价氧化物的水化物的碱性比Z的弱 D.Y、Z、W最高价氧化物对应水化物两两均可发生反应 11.工业上联合生产硫酸和烧碱溶液的装置如图所示,其中阴极和阳极均为惰性电极。实验过程中取样测丙溶液的pH值,pH试纸显红色。下列有关说法正确的是 A.a电极的电极反应式为:2H++2e−=H2↑ B.联合生产过程中需添加补充Na2SO4 C.离子交换膜d为阴离子交换膜 D.每转移0.1mol电子,产生1.12L的气体乙 12.石墨烯是单层碳原子排列成的蜂窝状六角平面晶体,具有重要的应用前景。中科院科学家研发出一条以碳化硅为原料制备高品质石墨烯材料的途径,过程如图。下列相关认识正确的是 A.石墨烯与C60互为同素异形体 B.碳化硅是一种硬度很高的合金 C.上述制备途径属于物理剥离过程 D.石墨烯属于新型高分子化合物 13.常温时,在H2CO3溶液中逐滴加入NaOH溶液,溶液中H2CO3、HCO和CO的物种分布分数(X)=与pH的关系如图所示: 下列说法正确的是 A.反应HCOH++CO的lgK=-6.4 B.pH=8的溶液中:c(Na+)>c(HCO) C.NaHCO3溶液中滴入少量盐酸至溶液显中性:c(Na+)=c(Cl−) D.向pH=6.4的溶液中滴加NaOH溶液至pH=8,主要发生的离子反应:HCO+OH−=CO+H2O 二、非选择题(共43分) 26.(14分)天然脑砂含少量NH4Cl,《唐本草》记载脑砂入药可以散瘀消肿。某学习小组设计下列步骤制取NH4Cl,并进行天然脑砂含量的测定。请回答相关问题: 步骤Ⅰ用氨气与适量氯气反应制取NH4Cl (1)装置A中仪器X的名称为 ;若用浓盐酸与MnO2反应制取氯气,则该反应的离子方程式为 。 (2)C中盛放的试剂是___;要得到干燥纯净的氯气,按照气流由左到右的顺序,上述A、B、C装置连接依次为a→___(用小写字母表示)。 (3)氨气与适量氯气混合反应可生成NH4Cl和一种无污染的气体,利用E装置模拟该反应。氨气应从___(用小写字母表示)通入,反应的化学方程式为 ;观察到的现象是 。 步骤Ⅱ天然脑砂中NH4Cl含量的测定 准确称取一定质量脑砂,与足量的氧化铜混合,如图所示进行实验。 已知:2NH4Cl+3CuO3Cu+N2↑+2HCl↑+3H2O (4)为完成NH4Cl含量的测定,请完成下列实验步骤: 加热前,称量H装置的总质量;当观察到___现象时,停止加热,冷却,___。 (5)如果不用J装置,测出NH4Cl的含量将___(填“偏高”、“偏低”或“无影响”)。 27.(15分)硼氢化钠(NaBH4)是有机合成中常用的还原剂。一种制备硼氢化钠工艺如下(部分条件和产物省略): 已知:MgH2、NaBH4遇水蒸气剧烈反应并放出H2。 回答下列问题: (1)Mg2B2O5·H2O中B的化合价为_______。MgH2和NaBO2必须在干燥条件下合成硼氢化钠,其原因是__________________________________。 (2)难溶的Mg2B2O5与浓氢氧化钠溶液反应的离子方程式为 。 (3)SOCl2溶于水能产生两种气体,其中一种气体能使品红溶液褪色,则灼烧时加入SOCl2的目的是______________________________。 (4)已知镁—H2O2酸性燃料电池反应为Mg+H2O2+H2SO4=MgSO4+2H2O。常温下,电解质溶液为200mL 0.1mol·L−1硫酸溶液。 ①写出正极的电极反应式:______________________________。 ②若电路中有0.038mol转移电子时,则溶液pH约为_____(忽略体积变化,不考虑H2O2电离)。 (5)“有效氢”是衡量含氢还原剂的还原能力指标,定义为1g含氢还原剂的还原能力与多少克H2相当。NaBH4的“有效氢”等于_________________(结果保留2位小数)。 (6)工业上,可以利用NaBO2、HCHO和生石灰在加热下生成NaBH4和难溶的盐,写出化学方程式________________________________________。 28.(14分)CO、CO2是化石燃料燃烧后的主要产物。 (1)将体积比为2∶1的CO2和CO混合气体通入有足量Na2O2固体的密闭容器中,同时不断地用电火花点燃。将残留固体溶于水,所得溶液中2c(CO)+c(HCO)__________c(Na+)(填“>”“<”或“=”)。 (2)已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566.0 kJ/mol;键能E(o=o)=499.0kJ/mol ①CO(g)+O2(g)CO2(g)+O(g)的ΔH=____________kJ/mol ②已知2500K时,①中反应的平衡常数为0.40。某时刻该反应体系中各物质浓度满足: c(CO)·c(O2)=c(CO2)·c(O),则此时反应____________(填向左”或“向右”)进行。 (3)已知:反应CO2(g)CO(g)+O(g)在密闭容器中CO2分解实验的结果如下图1;反应2CO2(g)2CO(g)+O2(g)中1mol CO2在不同温度下的平衡分解量如下图2, ①分析图1,求2min内v(CO2)=_______。 ②分析图2,1500℃时反应达平衡,此时容器体积为1L,则反应的平衡常数K=______(计算结果保留1位小数)。 (4)为探究不同催化剂对CO和H2合成CH3OH的选择性效果,某实验室控制CO和H2的初始投料比为1∶3进行实验,得到如下数据: 选项 T/K 时间/min 催化剂种类 甲醇的含量(%) A 450 10 CuO-ZnO 78 B 450 10 CuO-ZnO-ZrO2 88 C 450 10 ZnO-ZrO2 46 ①由表1可知,该反应的最佳催化剂为____________(填编号);图3中a、b、c、d四点是该温度下CO的平衡转化率的是____________。 ②有利于提高CO转化为CH3OH的平衡转化率的措施有____________。 A.使用催化剂CuO-ZnO-ZrO2 B.适当降低反应温度 C.增大CO和H2的初始投料比 D.恒容下,再充入a mol CO和3a mol H2 三、选考题(共15分,请考生从以下题中任选一题作答,如果多做,则按所做的第一题计分。) 35.【化学——选修3:物质结构与性质】(15分) 锌的配合物[Zn(NH3)4]2+、ZSM、[Zn(N2H4)2(N3)2]n等用途非常广泛。 (1)Zn2+基态核外电子排布式为________________________。 (2)Zn2+能与NH3形成配离子[Zn(NH3)4]2+。配体NH3分子属于________(填“极性分子”或“非极性分子”);在[Zn(NH3)4]2+中,Zn2+位于正四面体中心,N位于正四面体的顶点,试在图中表示出[Zn(NH3)4]2+中Zn2+与N之间的化学键___________。 (3)ZSM是2-甲基咪唑和水杨酸与锌形成的配合物,2-甲基咪唑可通过下列反应制备: ①与CN−互为等电子体的分子是____________(填化学式,写两种)。 ②2-甲基咪唑中碳原子杂化轨道类型为________;1mol 2-甲基咪唑分子中含σ键和π键之比为________。 ③乙二胺易溶于水的主要原因是_________________。 36.【化学——选修5:有机化学基础】(15分) 某药物H的一种合成路线如下: 回答下列问题: (1)C的名称是______________。 (2)F→H的反应类型为______________。B→C的试剂和条件是_____________。 (3)H有多种同分异构体,在下列哪种仪器中可以显示物质中化学键和官能团类型______(填字母)。 A.质谱仪 B.元素分析仪 C.红外光谱仪 D.核磁共振氢谱仪 (4)写出D→E的化学方程式___________。 (5)在E的同分异构体中,同时满足下列条件的结构有____种;其中核磁共振氢谱有六组峰,且峰面积之比为3∶3∶2∶2∶1∶1的是______。 ①既能发生银镜反应,又能发生水解反应;②属于芳香族化合物;③苯环上只有2个取代基。 (6)参照上述流程,以D和乙醛为原料合成(其他无机试剂自选),设计合成路线:____________。 绝密 ★ 启用前 2020年全国I卷高考考前适应性试卷 化学答案(一) 7.【答案】D 【解析】聚乙烯不含不饱和键,不能使溴水褪色,故A错误;工业上用电解熔融氧化铝的方法制取铝,故B错误;丝、毛成分为蛋白质,含有碳、氢、氧、氮等元素,灼烧除了生成二氧化碳和水,还会生成含氮物质,故C错误;故选D。 8. 【答案】A 【解析】11B中含有6个中子,0.1mol 11B含有6NA个中子,A正确;溶液体积未定,不能计算氢离子个数,B错误;标准状况下苯不是气体,不能利用气体摩尔体积计算22.4L苯的物质的量,C错误;PCl3与Cl2反应生成PCl5的反应是可逆反应,则所1mol PCl3与1mol Cl2反应生成的PCl5小于1mol,增加的P-Cl键的数目小于2NA个,D错误;答案选A。 9. 【答案】C 【解析】R的分子式为C10H8O2;苯环上4个氢原子位置不对称,故苯环上一氯代物有4种;R含有酯基、碳碳双键和苯环,能发生水解反应、加成反应和氧化反应;-CH3中四个原子不可能共平面,则R分子中所有原子不可能共平面;答案选C。 10. 【答案】D 【解析】根据题意分析可知:X为H,Y是Na,Z是Al,W是Cl元素。原子核外电子层数越多,原子半径越大;同一周期的元素,原子序数越大,原子半径越小,所以四种元素的原子半径大小关系为:r(Y)>r(Z)>r(W)>r(X),A错误;X是H,Y是Na,W是Cl,H、Na两种元素形成的化合物NaH是离子化合物,化学键为离子键;而H、Cl两种非元素形成的化合物HCl是共价化合物,化学键H-Cl是共价键,因此形成的化学键类型不同,B错误;元素的金属性Y>Z,所以Y的最高价氧化物的水化物的碱性比Z的强,C错误;Y、Z、W最高价氧化物对应水化物分别是NaOH、Al(OH)3、HClO4,Al(OH)3是两性氢氧化物,既能与强酸反应,也能够与强碱反应,所以Y、Z、W最高价氧化物对应水化物两两均可发生反应,D正确;故合理选项是D。 11. 【答案】B 【解析】根据题干信息,实验过程中取样测丙溶液的pH值,pH试纸显红色,说明并溶液呈酸性,电解过程中,OH−离子在a极放电,失去电子,所以a极为阳极,电极反应式为4OH−-4e−=2H2O+O2↑,即气体甲为氧气,SO向阳极移动,则c为阴离子交换膜,产物丙为硫酸,则b为阴极,电极反应式为2H++2e−=H2↑,即气体乙为氢气,Na+向阴极移动,则d为阳离子交换膜,产物丁为NaOH。未指明标准状况下,不能准确计算产生的氢气的体积,D错误;正确答案选B。 12. 【答案】A 【解析】石墨烯与C60是由碳元素组成的不同单质,互为同素异形体;碳化硅属于非金属材料,不属于合金;由碳化硅生产石墨有新物质产生,属于化学反应;石墨烯属于单质。答案选A。 13. 【答案】B 【解析】pH=6.4时,c(HCO)=c(H2CO3),反应H2CO3H++HCO的lgK=lgc(H+)=lg10−6.4=-6.4,故A项错误;pH=8的溶液中:c(H+)查看更多