- 2021-04-20 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学代表性综合大题
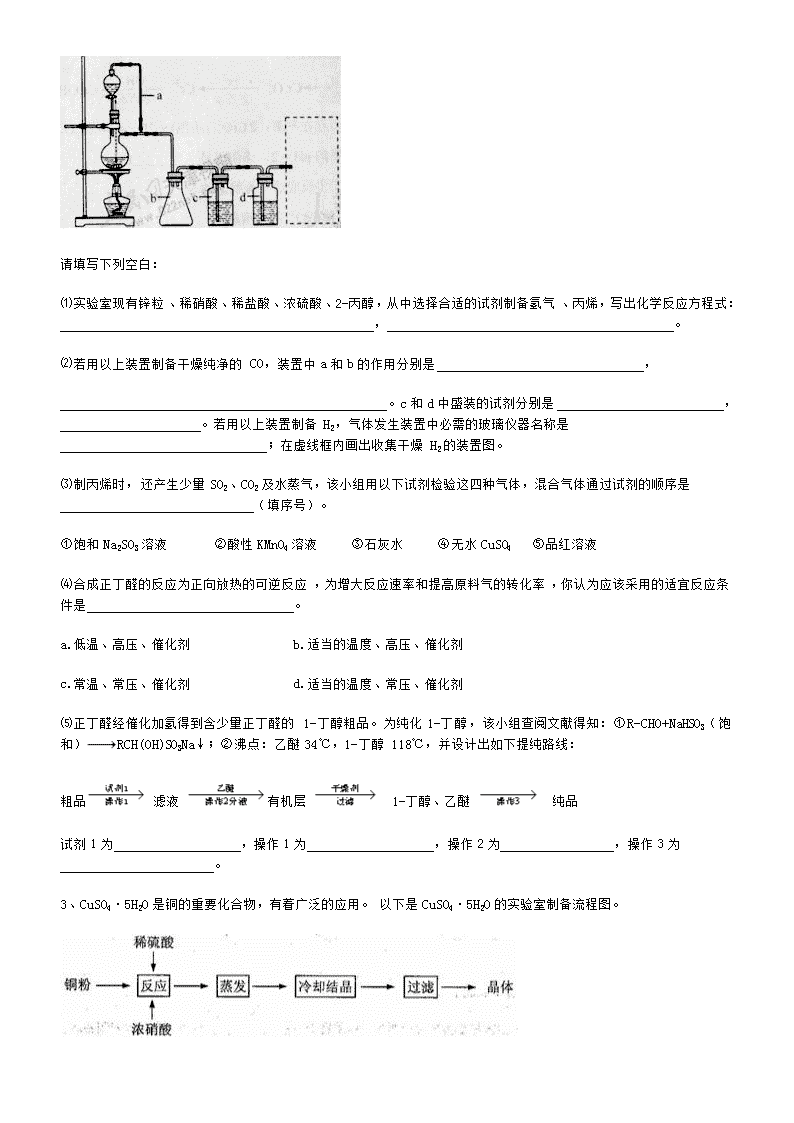
1、四氯化钛(TiCl4)是制取航天航空工业材料——钛合金的重要原料,由钛铁矿(主要成分是FeTiO3)制备TiCl4等产品的一种工艺流程示意如下: 回答下列问题: (1) 往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生。 2Fe3++Fe === 3Fe2+ 2TiO2+(无色) +Fe+4H+ === 2Ti3+(紫色) +Fe2++2H2O Ti3+(紫色) +Fe3++H2O ===TiO2+(无色) +Fe2++2H+ (2)在②→③工艺中需要控制条件以形成TiO2·n H2O溶胶,该分散质颗粒直径大小在_____________范围。 (3)若把③中制得的固体TiO2·n H2O用酸清洗除去其中的Fe (OH)3杂质,还可制得钛白粉。已知25℃时,,该温度下反应Fe (OH)3+3H+Fe3+ +H2O的平衡常数K=_____________。 (4)已知:TiO2 (s) +2 Cl2 (g)=== TiCl4(l) +O2(g) △H=+140KJ·mol-1 C(s) +O2(g)=== 2CO(g) △H=—221KJ·mol-1 写出④中TiO2和焦炭、氯气反应生成液态TiCl4和CO气体的热化学方程式:_____________。 (5)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是_____________(只要求写出一项)。 (6)依据右表信息,要精制含少量SiCl4杂质的TiCl4 ,可采用_____________方法。 2、某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线: CH3CH=CH2+CO+H2CH3CH2CH2CHO CH3CH2CH2CH2OH; CO的制备原理:HCOOHCO↑+H2O,并设计出原料气的制备装置(如图)。 请填写下列空白: ⑴实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸、2-丙醇,从中选择合适的试剂制备氢气、丙烯,写出化学反应方程式: , 。 ⑵若用以上装置制备干燥纯净的CO,装置中a和b的作用分别是 , 。c和d中盛装的试剂分别是 , 。若用以上装置制备H2,气体发生装置中必需的玻璃仪器名称是 ;在虚线框内画出收集干燥H2的装置图。 ⑶制丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是 (填序号)。 ①饱和Na2SO3溶液 ②酸性KMnO4溶液 ③石灰水 ④无水CuSO4 ⑤品红溶液 ⑷合成正丁醛的反应为正向放热的可逆反应,为增大反应速率和提高原料气的转化率,你认为应该采用的适宜反应条件是 。 a.低温、高压、催化剂 b.适当的温度、高压、催化剂 c.常温、常压、催化剂 d.适当的温度、常压、催化剂 ⑸正丁醛经催化加氢得到含少量正丁醛的1-丁醇粗品。为纯化1-丁醇,该小组查阅文献得知:①R-CHO+NaHSO3(饱和)RCH(OH)SO3Na↓;②沸点:乙醚34℃,1-丁醇 118℃,并设计出如下提纯路线: 粗品 滤液 有机层 1-丁醇、乙醚 纯品 试剂1为 ,操作1为 ,操作2为 ,操作3为 。 3、CuSO4·5H2O是铜的重要化合物,有着广泛的应用。以下是CuSO4·5H2O的实验室制备流程图。 根据题意完成下列填空: ⑴向含铜粉的稀硫酸中滴加浓硝酸,在铜粉溶解时可以观察到的实验现象: 、 。 ⑵如果铜粉、硫酸及硝酸都比较纯净,则制得的CuSO4·5H2O中可能存在的杂质是 ,除去这种杂质的实验操作称为 。 ⑶已知:CuSO4+2NaOH=Cu(OH)2↓+ Na2SO4 称取0.1000 g提纯后的CuSO4·5H2O试样于锥形瓶中,加入0.1000 mol/L氢氧化钠溶液28.00 mL,反应完全后,过量的氢氧化钠用0.1000 mol/L盐酸滴定至终点,耗用盐酸20.16 mL,则0.1000 g该试样中含CuSO4·5H2O g。 ⑷上述滴定中,滴定管在注入盐酸之前,先用蒸馏水洗净,再用 。 在滴定中,准确读数应该是滴定管上蓝线 所对应的刻度。 ⑸如果采用重量法测定CuSO4·5H2O的含量,完成下列步骤: ① ②加水溶解③加氯化钡溶液,沉淀④过滤(其余步骤省略) 在过滤前,需要检验是否沉淀完全,其操作是 ⑹如果1.040 g提纯后的试样中含CuSO4·5H2O的准确值为1.015 g,而实验测定结果是l.000 g 测定的相对误差为 。 4、四川攀枝花蕴藏丰富的钒、钛、铁资源。用钛铁矿渣(主要成分为TiO2、FeO、Fe2O3,Ti的最高化合价为+4)作原料,生产白色颜料二氧化钛的主要步骤如下:w_w w. k#s5_u.c o*m 请回答下列问题:w_w w. k#s5_u.c o*m (1) 硫酸与二氧化钛反应的化学方程式是____________________________________。 (2) 向滤液I中加入铁粉,发生反应的离子方程式为:_________________________、_______________________________________。 (3) 在实际生产过程中,向沸水中加入滤液Ⅲ,使混合液pH达0.5,钛盐开始水解。水解过程中不断通入高温水蒸气,维持溶液沸腾一段时间,钛盐充分水解析出水合二氧化钛沉淀。请用所学化学平衡原理分析通入高温水蒸气的作用:_______________________________________________。 过滤分离出水合二氧化钛沉淀后,将滤液返回的主要目的是充分利用滤液中的钛盐、___________、______________、_______________________(填化学式),减少废物排放。 (4)A可用于生产红色颜料(Fe2O3),其方法是:将556a kgA(摩尔质量为278 g/mol)溶于水中,加入适量氢氧化钠溶液恰好完全反应,鼓入足量空气搅拌,产生红褐色胶体;再向红褐色胶体中加入3336b kg A和112c kg铁粉,鼓入足量空气搅拌,反应完成后,有大量Fe2O3附着在胶体粒子上以沉淀形式析出;过滤后,沉淀经高温灼烧得红色颜料。若所得滤液中溶质只有硫酸钠和硫酸铁,则理论上可生产红色颜料_______________________kg。 5、某化学兴趣小组用铝土矿(主要成分为A12 03,还含有Si02及铁的氧化物)提取氧化铝做冶炼铝的原料,提取的操作过程如下: (1)实验室中制取CO2时,为了使反应随开随用、随关随停,应选用下图中的装置 (填字母代号)。 (2)在过滤操作中,除烧杯、玻璃棒外,还需用到的玻璃仪器有 ; 洗涤沉淀的操作是 (3)实验室制备氢氧化铝的方案有多种。现提供铝屑、氢氧化钠溶液、稀硫酸三种药品,若制备等量的氢氧化铝,请你从药品用量最少的角度出发,设计出最佳实验方案(方案不必给出),写出此方案中发生反应的离子方程式: 此方案中所用药品的物质的量之比是:= 。 (4)兴趣小组欲对铝土矿中铁元素的价态进行探究:取少量固体,加入过量稀硝酸, 加热溶解;取少许溶液滴加KSCN溶液后出现红色。由此得出,铁元素的价态为+3的结论。请指出该结论是否合理并说明理由。 6、 某实验小组利用如下装置(部分固定装置略)制备氮化钙(Ca3N2),并探究其实验式。 (1)按图连接好实验装置。检查装置的气密性,方法是 。 (2)反应过程中末端导管必须插入试管A的水中,目的是 。 (3)制备氮化钙的操作步骤是:①打开活塞K并通入N2;②点燃酒精灯,进行反应;③反应结束后, ;④拆除装置,取出产物。 (4)数据记录如下: ① 计算得到实验式CaxN2,其中x= . ② 若通入的N2中混有少量O2,请比较x与3的大小,并给出判断依据: 。 7、要提纯下列物质(括号内物质为杂质),实验操作最合理的是() A.CO2(SO2):通入盛有饱和NaHCO3溶液的洗气瓶 B.溴苯(Br2):加入KI溶液,充分反应后,弃去水溶液 C.己烷(己烯):加入足量的溴水,充分振荡,静置分层后分离 D.乙酸乙酯(苯酚):加入NaOH溶液,振荡、静置分层后,除去水层 评卷人 得分 二、综合题 (每空? 分,共? 分) 8、臭氧是一种强氧化剂,常用于消毒、灭菌等。 (1)O3与KI溶液反应生成的两种单质是___________和_________.(填分子式) (2)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如题29表所示。已知:O3的起始浓度为0.0216 mol/L。 ①pH增大能加速O3分解,表明对O3分解起催化作用的是___________. ②在30°C、pH=4.0条件下,O3的分解速率为__________ mol/(L·min)。 ③据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为______.(填字母代号) a.40°C、pH=3.0 b.10°C、pH=4.0 c.30°C、pH=7.0 (3)O3 可由臭氧发生器(原理如题29图)电解稀硫酸制得。 ①图中阴极为_____(填“A”或“B”),其电极反应式为_____. ②若C处通入O 2 ,则A极的电极反应式为_____. ③若C处不通入O 2 ,D、E处分别收集到L和有L气体(标准情况),则E处收集的气体中O 3 所占的体积分数为_____.(忽略 O 3 的分解)。 参考答案 一、实验,探究题 1、(1)使Fe3+还原为Fe2+;生成Ti3+保护Fe2+不被氧化。 (2)10-9~10-7m(或其它合理答案); (3) (4)TiO2 (s) +2C(s) +Cl2 (g)=== TiCl4(l) +2CO(g) △H=—81KJ·mol-1 (5)蒸馏(或分馏或精馏) 2、⑴Zn+2HClZnCl2+H2↑ CH3CH=CH2↑+H2O ⑵恒压 防倒吸 NaOH溶液 浓H2SO4 分液漏斗、蒸馏烧瓶 ⑶④⑤①②③(或④⑤①③②) ⑷b ⑸饱和NaHSO3溶液 过滤 萃取 蒸馏 解析:⑴制备氢气选用锌粒和稀盐酸,反应方程式见答案;制备丙烯选用2-丙醇和浓硫酸,反应方程式见答案。⑵在题给装置中,a的作用保持分液漏斗和烧瓶内的气压相等,以保证分液漏斗内的液体能顺利加入烧瓶中;b主要是起安全瓶的作用,以防止倒吸;c为除去CO中的酸性气体,选用NaOH溶液,d为除去CO中的H2O,试剂选用浓硫酸;若用题给装置制备H2,则不需要酒精灯。⑶检验丙烯和少量SO2、CO2及水蒸气组成的混合气体各成分时,应首先选④无水CuSO4检验水蒸气,然后用⑤品红溶液检验SO2,并用①饱和Na2SO3溶液除去SO2;然后用③石灰水检验CO2,用② 酸性KMnO4溶液检验丙烯。⑷题给合成正丁醛的反应为气体体积减小的放热反应,为增大反应速率和提高原料气的转化率,选b。⑸见答案。 3、答案:⑴溶液呈蓝色、有红棕色气体产生 ⑵Cu(NO3)2 ,重结晶 ⑶0.0980 ⑷标准盐酸溶液润洗2-3次 粗细交界点 ⑸称取样品;在上层清液中继续滴加氯化钡溶液,观察有无沉淀产生 ⑹-1.5%(-1.48% ) 4、 (1) 或 (2) (3) 加水促进钛盐水解,加热促进钛盐水解,降低浓度促进钛盐水解 (4) 解析:本题属于化工生产流程题。(1)考查酸的通性,可以与金属氧化物反应,又知道TI的化合价,可以写出化学方程式。(2)加入浓硫酸后,浓硫酸可以氧化亚铁离子,再加入铁粉,铁粉可以还原铁离子。除此外,铁粉还可以与溶液中的H+反应、(3)考查了影响盐类水解的因素。(4)考虑最后溶质是只有硫酸钠和硫酸铁,根据开始加入A为2a×103mol加入适量氢氧化钠溶液恰好完全反应.,说明加入氢氧化钠的物质的量为4a×103mol,后来又加入12b×103mol的A,和2c×103mol的铁。根据电荷守恒,溶质中硫酸钠消耗硫酸根离子为2a×103mol,。而溶液中加入的硫酸根离子物质的量共计为(2a+12b)×103mol,这样剩下的硫酸根就与铁离子结合。可知消耗铁离子为8b×103mol,根据铁元素守恒。nFe=(2a+4b+2c) ×103mol,n Fe2O3=(a+2b+c) ×103mol,计算得mFe2O3=kg. 5、 6、【命题意图】考查考生化学实验基本操作技能和处理问题的能力,以及对试验结果进行计算和误差分析判断的能力 【答案】(1)关闭活塞K,微热反应管,试管A中有气泡冒出,停止加热。冷却后若末端导管中水柱上升且高度保持不变,则说明装置气密性良好。 (2)防止反应过程中空气进入反应管;便于观察N2的流速 (3)熄灭酒精灯,待反应管冷却至室温,停止通入N2,并关闭活塞K。 (4)①2.80 ②O2和N2分别与等量的Ca反应,生成CaO的质量高于Ca3N2。若通入的N2中混有少量的O2,会导致计算出n(N)偏大,所以n(Ca)/n(N)<3/2,即x<3。 【解析】(1)见答案;(2)要保证整个装置不能混入其他气体;(3)一定要使玻璃管冷却后再停止通入气流;(4)要确定X值必须求出钙和氮的原子个数比根据题目给的数据可做如下计算①m(Ca)=(15.08-14.80)g=0.28g,m(N)= (15.15-15.08)g=0.07g,则n(Ca):n(N)= :=7:5,则x=;②若通入的N2中混有少量O2,则产物中就有可能混有了CaO,而Ca3N2中钙的质量分数为81.08,CaO中钙的质量分数为71.43,所以产物中混有了CaO会导致钙的质量分数减小,x的值偏小。 【考点分析】考查学生化学实验基本操作技能和处理问题的能力,以及对实验结果进行计算和误差分析判断的能力。 7、A 二、综合题 8、 (1)I2、O2 (2)①OH—; ②1.00×10—4 ③b、a、c (3)①A;2H++2e—=H2↑ ②O2+4H++4e—=2H2O ③(x-2y)/y查看更多