- 2021-04-20 发布 |
- 37.5 KB |
- 7页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021届高考化学一轮复习物质的制备学案
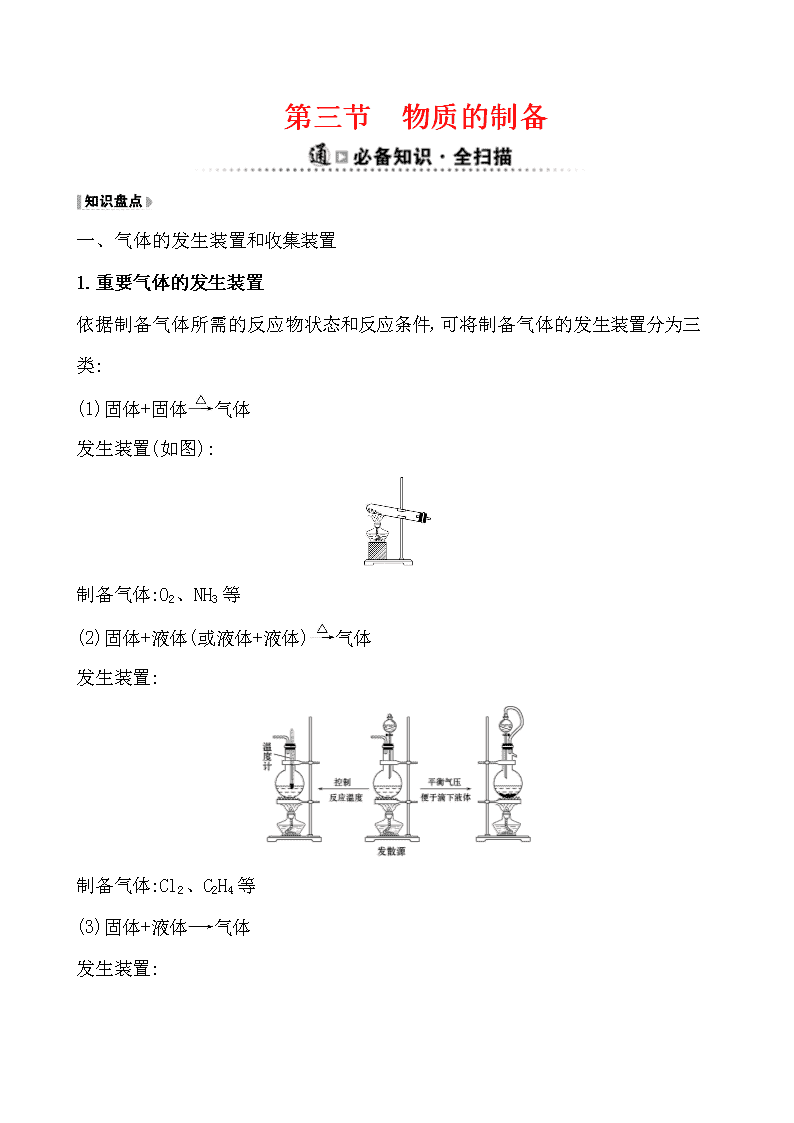
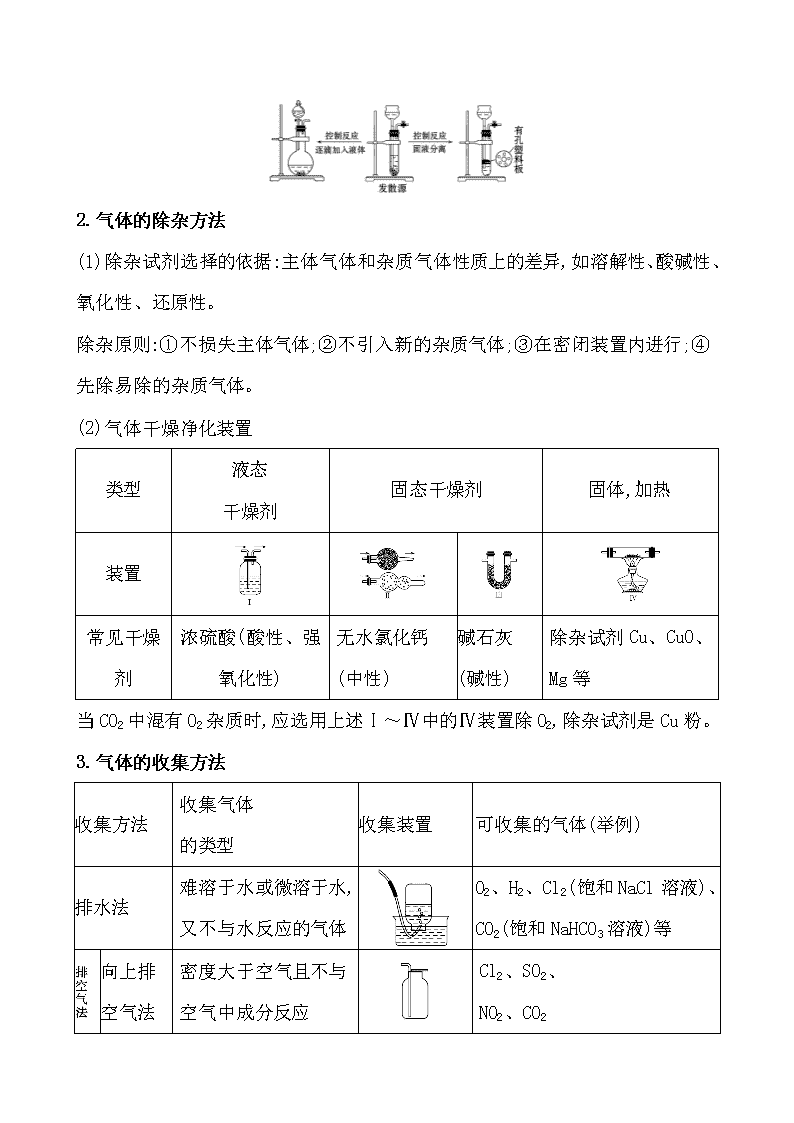
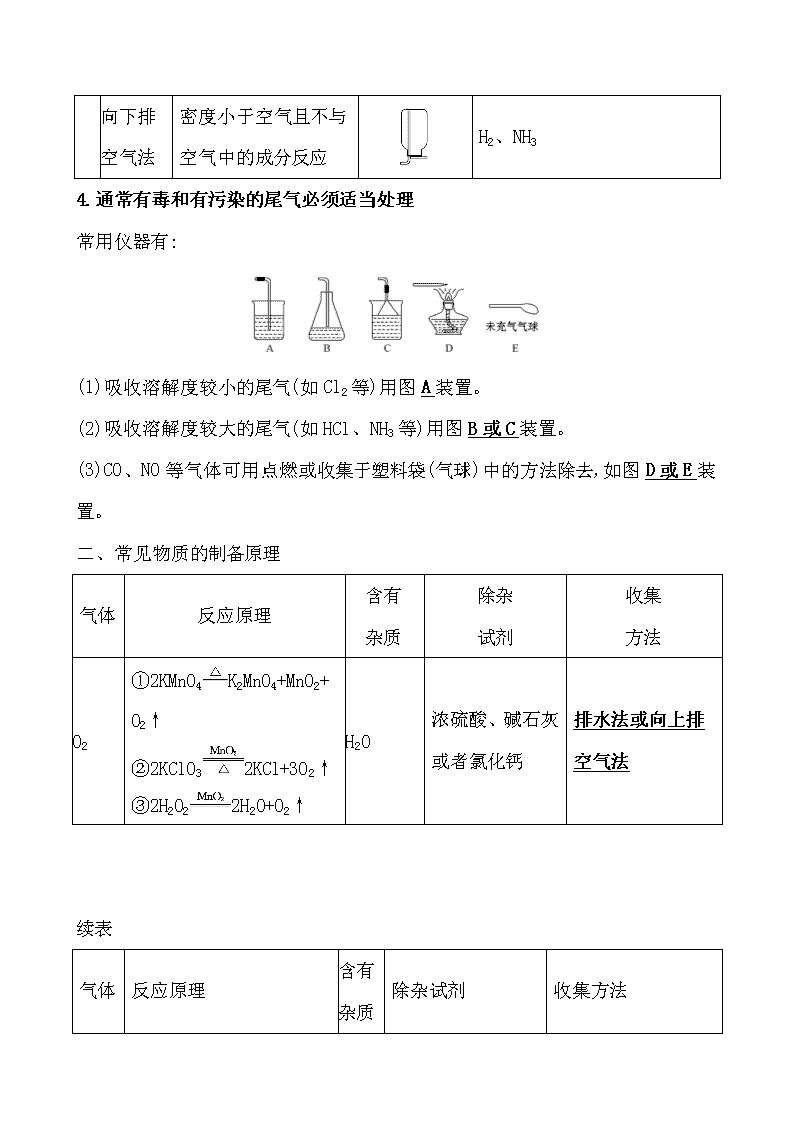
第三节 物质的制备 一、气体的发生装置和收集装置 1.重要气体的发生装置 依据制备气体所需的反应物状态和反应条件,可将制备气体的发生装置分为三类: (1)固体+固体气体 发生装置(如图): 制备气体:O2、NH3等 (2)固体+液体(或液体+液体)气体 发生装置: 制备气体:Cl2、C2H4等 (3)固体+液体气体 发生装置: 2.气体的除杂方法 (1)除杂试剂选择的依据:主体气体和杂质气体性质上的差异,如溶解性、酸碱性、氧化性、还原性。 除杂原则:①不损失主体气体;②不引入新的杂质气体;③在密闭装置内进行;④先除易除的杂质气体。 (2)气体干燥净化装置 类型 液态 干燥剂 固态干燥剂 固体,加热 装置 常见干燥 剂 浓硫酸(酸性、强氧化性) 无水氯化钙(中性) 碱石灰 (碱性) 除杂试剂Cu、CuO、 Mg等 当CO2中混有O2杂质时,应选用上述Ⅰ~Ⅳ中的Ⅳ装置除O2,除杂试剂是Cu粉。 3.气体的收集方法 收集方法 收集气体 的类型 收集装置 可收集的气体(举例) 排水法 难溶于水或微溶于水,又不与水反应的气体 O2、H2、Cl2(饱和NaCl溶液)、CO2(饱和NaHCO3溶液)等 向上排 空气法 密度大于空气且不与空气中成分反应 Cl2、SO2、 NO2、CO2 向下排 空气法 密度小于空气且不与空气中的成分反应 H2、NH3 4.通常有毒和有污染的尾气必须适当处理 常用仪器有: (1)吸收溶解度较小的尾气(如Cl2等)用图A装置。 (2)吸收溶解度较大的尾气(如HCl、NH3等)用图B或C装置。 (3)CO、NO等气体可用点燃或收集于塑料袋(气球)中的方法除去,如图D或E装置。 二、常见物质的制备原理 气体 反应原理 含有 杂质 除杂 试剂 收集 方法 O2 ①2KMnO4K2MnO4+MnO2+ O2↑ ②2KClO32KCl+3O2↑ ③2H2O22H2O+O2↑ H2O 浓硫酸、碱石灰或者氯化钙 排水法或向上排空气法 续表 气体 反应原理 含有 杂质 除杂试剂 收集方法 H2 Zn+H2SO4ZnSO4+H2↑ H2O 浓硫酸、碱石灰或者氯化钙 排水法或向下排空气法 CO2 CaCO3+2HClCaCl2+ CO2↑+H2O HCl、 H2O 饱和碳酸氢钠溶液和浓硫酸 向上排空气法 Cl2 MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O HCl、 H2O 饱和食盐水和浓硫酸 排饱和食盐水法或向上排空气法 NH3 Ca(OH)2+2NH4Cl CaCl2+2NH3↑+2H2O H2O 碱石灰 向下排空气法 三、几种非气体物质的制备 1.铜盐的制备 (1)用铜制取硫酸铜:2Cu+O22CuO、 CuO+H2SO4CuSO4+H2O (2)用铜制取硝酸铜:2Cu+O22CuO、 CuO+2HNO3Cu(NO3)2+H2O 2.从废旧线路板中回收铜 发生反应的化学方程式为a:Cu+2FeCl3CuCl2+2FeCl2 d:2FeCl2+H2O2+2HCl2FeCl3+2H2O 3.氢氧化亚铁 (1)原理 离子方程式:Fe2++2OH-Fe(OH)2↓。 (2)注意事项 ①Fe(OH)2有强还原性,易被氧化而迅速变色,因此用于配制硫酸亚铁溶液和氢氧化钠溶液的蒸馏水要煮沸,以便除去水中氧气。 ②将吸有氢氧化钠溶液的胶头滴管伸入硫酸亚铁溶液液面下,再将氢氧化钠溶液挤出。 ③还可在硫酸亚铁溶液上加一层植物油,尽量减少与空气(或氧气)的接触。 4.氢氧化铁胶体的制备 (1)原理 化学方程式:FeCl3+3H2OFe(OH)3(胶体)+3HCl。 (2)操作步骤:加热蒸馏水至沸腾,逐滴滴加饱和氯化铁溶液,加热至液体呈红褐色停止加热,不可搅拌。 1.(RJ必修1·P63改编题)制备FeSO4最适宜的方法是 ( ) A.过量的铁与稀硫酸反应 B.FeO与稀硫酸反应 C.FeCO3与稀硫酸反应 D.Fe(OH)2与稀硫酸反应 【解析】选A。制备FeSO4要加Fe防止Fe2+被氧化。 2.(RJ必修1·P87改编题)设计四种制备气体的方案:①加热NH4Cl制备氨气;②加热稀盐酸和MnO2制备氯气;③用稀硫酸和大理石制备二氧化碳;④用浓硫酸和锌粒制备氢气,不宜采用的方案有 ( ) A.只有①和② B.只有②和③ C.只有③和④ D.①②③④ 【解析】选D。①中NH4ClNH3↑+HCl↑,冷却时,NH3+HClNH4Cl;②中应使用浓盐酸;③中应使用盐酸;④中应使用稀硫酸或盐酸。 3.化学实验装置的正确连接是实验成功的关键,如图是中学化学中常见的实验装置。 (1)用上述装置制备气体: ①若B中盛放浓硫酸,则A、B、C组合后能制取并收集的气体是________。 a.H2 b.H2S c.CO2 d.C2H2 ②要快速制取并得到干燥的NH3,正确的仪器组合是________(按制气装置顺序填仪器的编号字母),制气所选用的固体药品是________。 ③若用H2O2和MnO2来制取和收集干燥的O2,则应选择的仪器正确组合是________ (按制气装置顺序填仪器的编号字母),检验气体收集满的方法是___________ ___________________________。 (2)甲同学用A、B组合来验证稀硫酸、碳酸、次氯酸的酸性强弱,稀硫酸应装入________(填仪器名称)中,B装置中发生反应的离子方程式为_____________ ___________________。 【解析】(1)①B中的浓硫酸可以和硫化氢反应,C装置只能收集密度比空气大的气体,氢气、乙炔不符合,所以只能选c。②利用固体氢氧化钠(或生石灰)和浓氨水反应可以快速制取氨气,氨气密度比空气小,所以采用向下排空气法收集。③氧气的密度比空气大,所以采用向上排空气法收集,正确的仪器组合为ABC,检验O2收集满的方法是将带火星的木条靠近集气瓶口,若木条复燃,则说明氧气收集满了。 (2)在利用A、B组合验证稀硫酸、碳酸、次氯酸的酸性强弱时,可以采用强酸制弱酸的方法,A中利用稀硫酸和碳酸钠反应制取二氧化碳,将二氧化碳通入B中的次氯酸钙溶液中,可反应生成次氯酸和CaCO3沉淀。 答案:(1)①c ②AFE 固体氢氧化钠(合理即可) ③ABC(合理即可) 将带火星的木条靠近集气瓶口,若木条复燃,则说明氧气收集满了 (2)分液漏斗 Ca2++2ClO-+CO2+H2OCaCO3↓+2HClO 关闭Word文档返回原板块查看更多