- 2021-04-20 发布 |
- 37.5 KB |
- 34页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021高三化学人教版一轮学案:第一章 第一节 物质的量 气体摩尔体积 Word版含解析
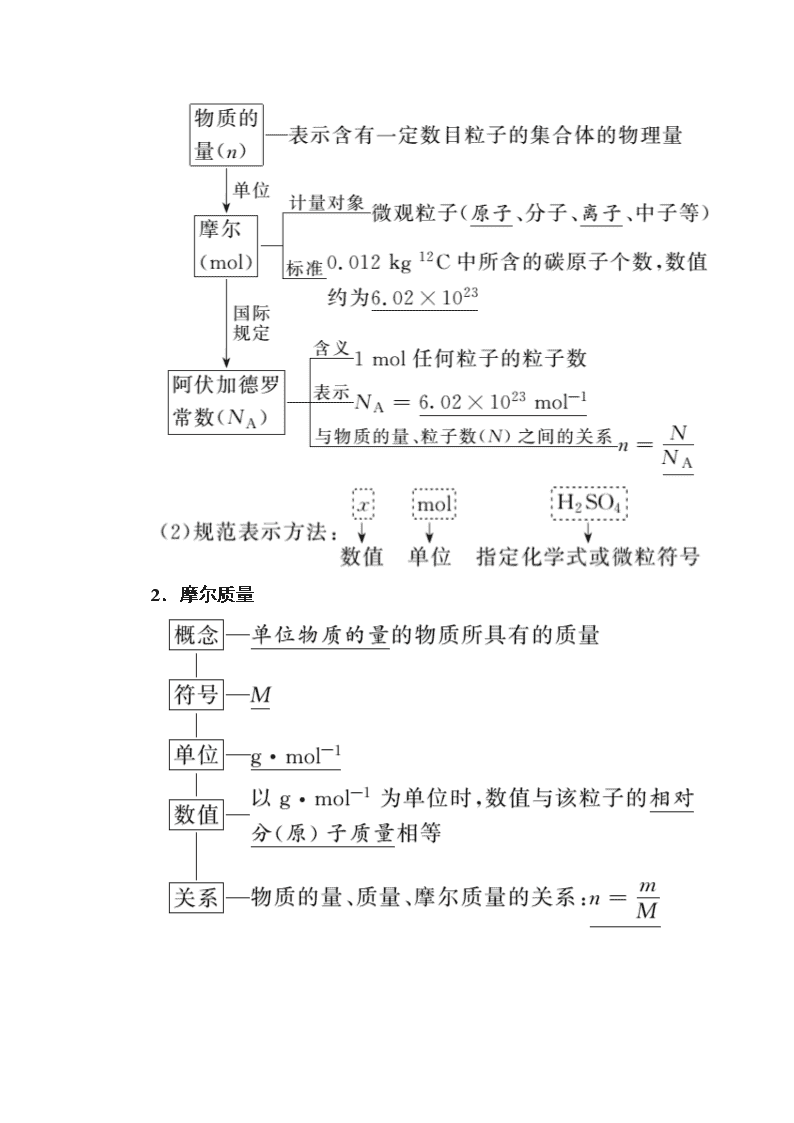
www.ks5u.com 第一节 物质的量 气体摩尔体积 最新考纲:1.了解物质的量(n)及其单位摩尔(mol)、摩尔质量(M)、气体摩尔体积(Vm)、阿伏加德罗常数(NA)的含义。2.能根据微粒(原子、分子、离子等)物质的量、数目、气体体积(标准状况下)之间的相互关系进行有关计算。 核心素养:1.宏观辨识与微观探析:认识物质的量是联系宏观物质和微观粒子的重要工具,能从宏观和微观相结合的视角分析与解决实际问题。2.证据推理与模型认知:在有关物质的量计算过程中,通过分析、推理等方法认识计算的方法,建立阿伏加德罗常数、气体摩尔体积等题目解答的模型。 知识点一 物质的量、摩尔质量 1.物质的量、阿伏加德罗常数 (1)基本概念间的关系 2.摩尔质量 判断正误(正确的打“√”,错误的打“×”) 1.0.012 kg 12C中含有约6.02×1023个碳原子( √ ) 提示:国际上规定,1 mol粒子所含的粒子数与0.012 kg 12C中所含的碳原子数相同,约为6.02×1023。 2.2 mol O2的摩尔质量是1 mol O2摩尔质量的2倍( × ) 提示:摩尔质量表示单位物质的量的物质所具有的质量,氧气的摩尔质量为32 g·mol-1,不受物质的量多少的影响。 3.一个钠原子的质量为( × ) 提示:钠的摩尔质量为23 g·mol-1,一个钠原子的质量为 g,约为 g。 4.NH的摩尔质量小于18 g·mol-1( × ) 提示:NH的摩尔质量为18 g·mol-1。 5.1.6 g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA( √ ) 提示:氧气和臭氧都由氧原子构成,1.6 g混合气体中含有氧原子的物质的量为0.1 mol,数目为0.1NA。 1.使用摩尔(mol)时,一定要指明粒子种类,可以用化学式。 2.摩尔质量与相对原子(分子)质量是两个不同的概念,但当摩尔质量以g·mol-1为单位时,两者在数值上是相等的。 3.阿伏加德罗常数(NA)不等同于6.02×1023。阿伏加德罗常数是一个确定的值,且有单位(mol-1),而6.02×1023只是阿伏加德罗常数的约值。 1.据央视新闻报道,在政府工作报告中指出,建设一批光网城市,推进5万个行政村通光纤,让更多城乡居民享受数字化生活。光缆的主要成分为SiO2。下列叙述正确的是( C ) A.SiO2的摩尔质量为60 B.标准状况下,15 g SiO2的体积为5.6 L C.SiO2中Si与O的质量比为7∶8 D.相同质量的SiO2和CO2中含有的氧原子数相同 解析:摩尔质量的单位为g·mol-1,A项错误。标准状况下,SiO2为固体,B项错误。SiO2中Si与O的质量比为28∶32=7∶8,C项正确。SiO2和CO2的摩尔质量不同,D项错误。 2.一个氯原子的质量为a g,一个12C的质量为b g,用NA表示阿伏加德罗常数,下列说法中正确的是( C ) A.氯元素的相对原子质量为 B.氯元素的摩尔质量为aNA C.m g该氯原子的物质的量为 mol D.n g该氯原子所含的电子数为 解析:根据原子的相对原子质量等于该原子的质量除以12C质量的,可以算出该氯原子的相对原子质量为,不能确定氯元素的相对原子质量,A错误。摩尔质量的单位是g·mol-1,并且aNA g·mol-1是该氯原子的摩尔质量,B错误。该氯原子的摩尔质量为aNA g·mol-1,则m g该氯原子的物质的量为 mol,C正确。n g该氯原子的原子数为,电子数为,D错误。 3.利用太阳能分解水制氢,若光解0.02 mol水,下列说法正确的是( D ) A.可生成H2的质量为0.02 g B.可生成氢的原子数为2.408×1023个 C.可生成H2的体积为0.224 L(标准状况) D.生成H2的量理论上等于0.04 mol Na与水反应产生H2的量 解析:利用太阳能分解水制氢气的方程式为2H2O2H2↑+O2↑,0.02 mol的水被分解,产生H2的物质的量为0.02 mol,标准状况下的体积为0.448 L,质量为0.04 g,氢原子总数为2.408×1022个,A、B、C项均错误;Na与水反应的化学方程式为2Na+2H2O===2NaOH+H2↑,0.04 mol Na与水反应,放出的H2的物质的量为0.02 mol,D项正确。 4.有以下四种气体:①3.01×1023个HCl分子 ②13.6 g H2S ③2 g D2 ④0.2 mol NH3。下列关系正确的是( D ) A.质量:②>①>④>③ B.分子个数:①>③>②>④ C.物质的量:③>①>②>④ D.氢原子数:③>②>④>① 解析:四种气体的物质的量分别为HCl 0.5 mol、H2S 0.4 mol、D2 0.5 mol、NH3 0.2 mol,所以根据各量关系,质量大小顺序关系为 ①>②>④>③;分子个数和物质的量的关系为①=③>②>④;氢原子数的关系为③>②>④>①,答案为D。 5.中国地质调查局宣称,我国将加速布局,推进“可燃冰”产业化进程。“可燃冰”是由水和甲烷在一定条件下形成的类冰结晶化合物。 (1)1 mol甲烷中含有NA或6.02×1023个CH4分子,含有4NA或2.408×1024个氢原子。 (2)甲烷的摩尔质量是16_g·mol-1,32 g甲烷和72 g水所含氢原子数相同。 (3)0.3 mol CH4分子中所含质子数与0.3NA或1.806×1023个H2O分子中所含质子数相等。1.5 g CH中的电子数为0.8NA或4.816×1023。 (4)已知:1.6 g可燃冰(CH4·xH2O)的物质的量与6.02×1021个水分子的物质的量相等,则该“可燃冰”的摩尔质量为160_g·mol-1,x值为8。 素养 阿伏加德罗常数的正误判断 1.设NA为阿伏加德罗常数的值。判断下列说法的正误。 (1)(2018·全国卷Ⅰ)22.4 L(标准状况)氩气含有的质子数为18NA( √ ) 提示:氩气为单原子分子,标准状况下,22.4 L氩气含有1 mol Ar原子,而1个Ar原子中含有18个质子,正确。 (2)(2018·全国卷Ⅱ)标准状况下,11.2 L甲烷和乙烯混合物中含氢原子数目为2NA( √ ) 提示:甲烷和乙烯的分子式分别为CH4和C2H4 ,每个分子均含有4个H,故标准状况下11.2 L甲烷和乙烯混合物的物质的量为0.5 mol,则含有氢原子数目为2NA,正确。 (3)(2017·全国卷Ⅲ)2.24 L(标准状况)苯在O2中完全燃烧,得到0.6NA个CO2分子( × ) 提示:标准状况下,苯为固体,不能用22.4 L·mol-1进行相关计算,错误。 (4)(2017·江苏卷)常温常压下,锌与稀H2SO4反应生成11.2 L H2,反应中转移的电子数为6.02×1023( × ) 提示:常温常压下,11.2 L H2的物质的量不是0.5 mol,错误。 (5)(2016·四川卷)标准状况下,5.6 L CO2气体中含有的氧原子数为0.5NA( √ ) 提示:标准状况下5.6 L CO2的物质的量为0.25 mol,含有的氧原子数为0.5NA,正确。 (6)(2015·广东卷)标准状况下,22.4 L N2和H2的混合气体中含有NA个原子( × ) 提示:N2和H2都是双原子分子,标准状况下,22.4 L混合气体是1 mol,含有2NA个原子,错误。 规律小结 抓“两看”,突破气体与状况陷阱 一看“气体”是否处在“标准状况”。 二看“标准状况”下,物质是否为“气体”[如CCl4、CHCl3、CH2Cl2(注:CH3Cl为气体)、H2O、溴、SO3、NO2、己烷、HF、苯等在标准状况下均不为气体]。 若给出非标准状况下气体的物质的量或质量,干扰学生正确判断,让学生误以为无法求解物质所含的粒子数,实质上,此时物质所含的粒子数与温度、压强等外界条件无关。 2.设NA为阿伏加德罗常数的值。判断下列说法的正误。 (1)(2019·全国卷Ⅱ)3 g 3He含有的中子数为1NA( √ ) 提示:3 g 3He的物质的量为1 mol,每个3He含1个中子,则1 mol 3He含1 mol中子,正确。 (2)(2019·全国卷Ⅱ)48 g正丁烷和10 g异丁烷的混合物中共价键数目为13NA( √ ) 提示:正丁烷和异丁烷互为同分异构体,每个分子中均含10个C—H键和3个C—C键,即每个分子中含13个共价键,则48 g正丁烷和10 g异丁烷的混合物中含13 mol共价键,正确。 (3)(2019·浙江卷)30 g HCHO与CH3COOH混合物中含C原子数为NA( √ ) 提示:HCHO与CH3COOH的最简式均为CH2O,原混合物相当于30 g CH2O,n(CH2O)=1 mol,因而C原子数为NA,正确。 (4)(2018·全国卷Ⅰ)92.0 g甘油(丙三醇)中含有羟基数为1.0NA( × ) 提示:92.0 g甘油的物质的量为1 mol,而1个甘油分子中含有3个—OH,则92.0 g甘油中含有羟基数为3.0NA,错误。 (5)(2018·全国卷Ⅱ)常温常压下,124 g P4中所含P—P键数目为4NA( × ) 提示:P4分子是正四面体结构,1个P4分子中含有6个P—P键,124 g P4的物质的量为1 mol,则含有P—P键的数目为6NA,错误。 (6)(2018·海南卷)12 g金刚石中含有化学键的数目为4NA( × ) 提示:在金刚石中,1个C原子相当于形成2个C—C键,n(金刚石)==1 mol,所以12 g金刚石中含有2NA个化学键,错误。 (7)(2018·海南卷)18 g的D2O中含有的质子数为10NA( × ) 提示:D2O的摩尔质量是20 g·mol-1,每个D2O中含有10个质子,n(D2O)==0.9 mol,则18 g D2O中含有的质子数为9NA,错误。 (8)(2017·全国卷Ⅲ)0.1 mol的11B中,含有0.6NA个中子( √ ) 提示:一个11B中的中子数为11-5=6,0.1 mol 11B中含有0.6 mol中子,即0.6NA个中子,正确。 规律小结 突破物质组成与结构 1.物质组成的微观结构 (1)微粒个数 ①稀有气体是单原子分子,臭氧为O3,白磷为P4。 ②由同位素组成单质和同位素化合物,它们的摩尔质量与通常情况下不同,例如摩尔质量:18O2(36 g·mol-1)、D2O(20 g·mol-1)、T2O(22 g·mol-1)。 ③涉及电子数时要注意根、基、离子的区别,如OH-与—OH、CH与—CH3等。 ④特殊物质中所含微粒(分子、原子、电子、质子、中子)数目,如D2O(或T2O)、18O2等。 (2)混合物中微粒数目的计算 ①对于分子式中某一种原子数相同的混合物,计算该原子数时,不用考虑各混合物的占比,如1 mol NO2和CO2混合气体中O原子数为2NA。 ②相对分子质量相同的物质组成的混合物,计算分子总数时,不用考虑各混合物的占比,分子总数N=×NA,M是相同的摩尔质量。如常温常压下,14 g由N2与CO组成的混合气体中,含有的分子数目为0.5NA,含有的原子数目为NA。 ③最简式相同的物质组成的混合物计算原子总数时,不用考虑各混合物的占比,N(最简式)=×NA。如甲醛和冰醋酸的最简式都为CH2O,常温常压下,3.0 g甲醛和冰醋酸的混合物中含有的N(CH2O)为0.1NA,含有的原子总数为0.4NA。类似的例子还有计算一定质量O2和O3、乙烯和环丙烷、NO2和N2O4的原子数目等。 (3)胶体 胶体粒子较大,由多个微粒组合而成,如一个Fe(OH)3 胶体粒子是由多个Fe(OH)3微粒的集合体吸附一些粒子组成的,故Fe(OH)3胶体粒子数小于Fe(OH)3分子数。 2.物质中所含化学键 (1)熟悉一些物质中的化学键的数目,如Si、CH4、P4、CO2等。 几种常 考物质 CO2 (C===O) CH4 (C—H) P4 (P—P) Si (Si—Si) SiO2 (Si—O) 石墨 (C—C) 金刚石 (C—C) 每摩尔微粒 所含共价键 数目(NA) 2 4 6 2 4 1.5 2 (2)苯环中不存在碳碳单键和碳碳双键。 (3)常用的解题技巧 ①烃中化学键数目可巧记公式计算。设烃的分子式为CxHy,则化学键总数=,非极性键总数=-y=。 ②烃的含氧衍生物化学键数目也可用公式计算。设烃的含氧衍生物分子式为CaHbOc,则化学键总数=。 3.设NA为阿伏加德罗常数的值,判断下列说法的正误。 (1)(2019·全国卷Ⅱ)1 mol K2Cr2O7被还原为Cr3+转移的电子数为6NA( √ ) 提示:K2Cr2O7中Cr元素为+6价,1 mol K2Cr2O7被还原成Cr3+时,得到6 mol电子,正确。 (2)(2019·浙江卷)2.3 g Na与O2完全反应,反应中转移的电子数介于0.1NA和0.2NA之间( × ) 提示: 无论钠和氧气生成氧化钠还是过氧化钠,钠元素的化合价都由0价变为+1价,因而2.3 g Na(0.1 mol)与O2完全反应转移电子数为0.1 mol×NA mol-1=0.1NA,错误。 (3)(2017·全国卷Ⅰ)2.4 g Mg和H2SO4完全反应,转移电子数为0.1NA( × ) 提示:2.4 g镁完全反应,化合价由0价升高到+2价,转移0.2NA个电子。 (4)(2017·海南卷)1 mol甲烷完全燃烧转移的电子数为8NA( √ ) 提示:1 mol甲烷完全燃烧,碳元素化合价由-4价升高到+4价,转移8NA个电子。 (5)(2016·全国卷Ⅰ)1 mol Fe溶于过量硝酸,电子转移数为2NA( × ) 提示:1 mol Fe与过量HNO3反应,生成Fe3+,转移3NA个电子。 (6)(2015·四川卷)标准状况下,5.6 L CO2与足量Na2O2反应转移的电子数为0.5NA( × ) 提示:1 mol CO2与1 mol Na2O2反应生成0.5 mol O2,转移1 mol电子,而n(CO2)==0.25 mol,由方程式2Na2O2+2CO2===2Na2CO3+O2推知0.25 mol CO2反应,生成0.125 mol O2,转移0.25 mol电子。 规律小结 突破氧化还原反应中转移电子数目 1.同一种物质在不同反应中作氧化剂、还原剂的判断。 如:①Cl2和Fe、Cu等反应,Cl2只作氧化剂,而Cl2和NaOH反应,Cl2既作氧化剂,又作还原剂;②Na2O2与CO2或H2O反应,Na2O2既作氧化剂,又作还原剂,而Na2O2与SO2反应,Na2O2只作氧化剂;③NO2和H2O的反应中,NO2既作氧化剂,又作还原剂。 2.量不同,所表现的化合价不同。如Fe和HNO3反应,Fe不足,生成Fe3+;Fe过量,生成Fe2+。 3.氧化剂或还原剂不同,所表现的化合价不同。如Cu和Cl2反应生成CuCl2,而Cu和S反应生成Cu2S。 4.注意氧化还原反应的顺序。如向FeI2溶液中通入Cl2,Cl2首先氧化I-,再氧化Fe2+。 5.常见的氧化还原反应电子转移数目 6.要特别注意以下特殊情况 (1)可逆反应电子转移数目的计算:如某密闭容器盛有0.1 mol N2和0.3 mol H2,在一定条件下充分反应,转移电子的数目小于0.6NA。 (2)涉及与浓酸反应时电子转移数目的计算:如50 mL 18.4 mol/L浓硫酸与足量铜微热反应,随着反应进行浓硫酸变稀,稀硫酸不与铜反应,生成SO2分子数目小于0.46NA,转移电子的数目小于0.92NA。MnO2与浓盐酸的反应也要类似处理。 (3)粗铜精炼时,阳极质量减轻64 g,转移电子物质的量不一定是2 mol。 4.设NA为阿伏加德罗常数的值,判断下列说法的正误。 (1)(2019·全国卷Ⅱ)1 L 0.1 mol·L-1磷酸钠溶液含有的PO数目为0.1NA( × ) 提示:该溶液中含0.1 mol Na3PO4,由于部分PO水解,故溶液中PO的数目小于0.1NA,错误。 (2)(2019·浙江卷)500 mL 0.5 mol·L-1的NaCl溶液中微粒数大于0.5NA( √ ) 提示:n(Na+)=n(Cl-)=0.5 L×0.5 mol·L-1=0.25 mol,n(Na+)+n(Cl-)=0.5 mol,故Na+和Cl-共0.5NA个,但溶液中存在水分子、少量的H+和OH-,因而NaCl溶液中微粒数大于0.5NA,正确。 (3)(2018·全国卷Ⅰ)16.25 g FeCl3水解形成的Fe(OH)3胶体粒子数为0.1NA( × ) 提示:FeCl3的摩尔质量为162.5 g·mol-1,16.25 g FeCl3的物质的量为0.1 mol,FeCl3的水解为可逆反应,且Fe(OH)3胶粒是若干个Fe(OH)3的集合体,所以形成的Fe(OH)3胶体粒子数远少于0.1NA,错误。 (4)(2018·全国卷Ⅱ)100 mL 1 mol·L-1 FeCl3溶液中所含Fe3+的数目为0.1NA( × ) 提示:由于Fe3+发生水解反应,故100 mL 1 mol·L-1 FeCl3溶液中所含Fe3+的数目小于0.1NA,错误。 (5)(2018·海南卷)1 L 1 mol·L-1的NH4Cl溶液中NH和Cl-的数目均为NA( × ) 提示:NH4Cl为强酸弱碱盐,NH水解导致c(NH)<1 mol·L-1,1 L该溶液中N(NH)查看更多
相关文章
- 当前文档收益归属上传用户
- 下载本文档