- 2021-04-19 发布 |
- 37.5 KB |
- 14页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
中考化学背多分教师版
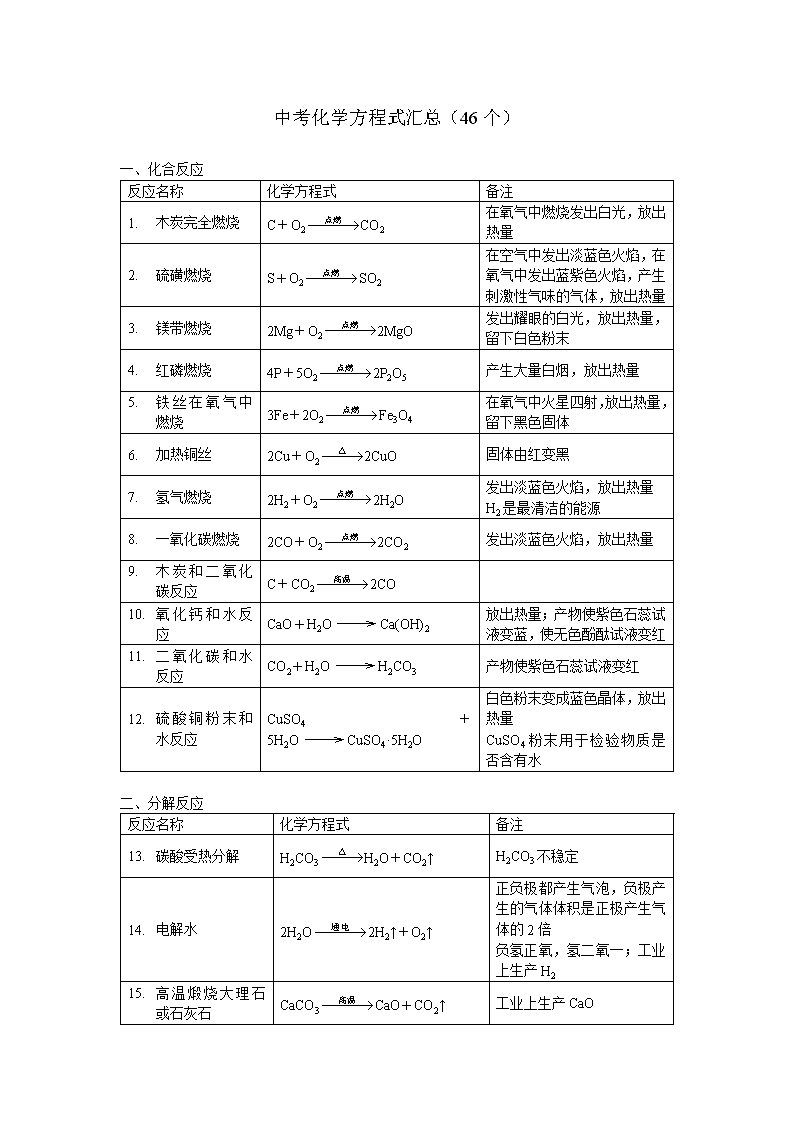
中考化学方程式汇总(46个) 一、化合反应 反应名称 化学方程式 备注 1. 木炭完全燃烧 C+O2CO2 在氧气中燃烧发出白光,放出热量 2. 硫磺燃烧 S+O2SO2 在空气中发出淡蓝色火焰,在氧气中发出蓝紫色火焰,产生刺激性气味的气体,放出热量 3. 镁带燃烧 2Mg+O22MgO 发出耀眼的白光,放出热量,留下白色粉末 4. 红磷燃烧 4P+5O22P2O5 产生大量白烟,放出热量 5. 铁丝在氧气中燃烧 3Fe+2O2Fe3O4 在氧气中火星四射,放出热量,留下黑色固体 6. 加热铜丝 2Cu+O22CuO 固体由红变黑 7. 氢气燃烧 2H2+O22H2O 发出淡蓝色火焰,放出热量 H2是最清洁的能源 8. 一氧化碳燃烧 2CO+O22CO2 发出淡蓝色火焰,放出热量 9. 木炭和二氧化碳反应 C+CO22CO 10. 氧化钙和水反应 CaO+H2OCa(OH)2 放出热量;产物使紫色石蕊试液变蓝,使无色酚酞试液变红 11. 二氧化碳和水反应 CO2+H2OH2CO3 产物使紫色石蕊试液变红 12. 硫酸铜粉末和水反应 CuSO4+5H2OCuSO4·5H2O 白色粉末变成蓝色晶体,放出热量 CuSO4粉末用于检验物质是否含有水 二、分解反应 反应名称 化学方程式 备注 13. 碳酸受热分解 H2CO3H2O+CO2↑ H2CO3不稳定 14. 电解水 2H2O2H2↑+O2↑ 正负极都产生气泡,负极产生的气体体积是正极产生气体的2倍 负氢正氧,氢二氧一;工业上生产H2 15. 高温煅烧大理石或石灰石 CaCO3CaO+CO2↑ 工业上生产CaO 1. 过氧化氢在二氧化锰的催化作用下分解 2H2O22H2O+O2↑ 产生大量气泡,放出热量 实验室制取O2 2. 加热氯酸钾和二氧化锰的混合物 2KClO32KCl+3O2↑ 实验室制取O2 3. 加热硫酸铜晶体 CuSO4·5H2OCuSO4+5H2O 蓝色晶体变成白色粉末,试管口产生无色液体 三、置换反应 反应名称 化学方程式 备注 4. 木炭还原氧化铜 C+2CuO2Cu+CO2↑ 产生红色固体 5. 氢气还原氧化铜 H2+CuOCu+H2O 产生红色固体,试管口产生无色液体 H2有还原性,用于冶炼金属 6. 镁带在二氧化碳中燃烧 2Mg+CO22MgO+C 产生黑色和白色固体 7. 锌粒和稀盐酸反应 Zn+2HClZnCl2+H2↑ 实验室制取H2 8. 锌粒和稀硫酸反应 Zn+H2SO4ZnSO4+H2↑ 实验室制取H2 9. 铁钉和稀盐酸反应 Fe+2HClFeCl2+H2↑ Fe元素从0价变成+2价 10. 铁钉和稀硫酸反应 Fe+H2SO4FeSO4+H2↑ 11. 铁丝和硫酸铜溶液反应 Fe+CuSO4FeSO4+Cu 铁丝表面产生红色固体 12. 铜丝和硝酸银溶液反应 Cu+2AgNO3Cu(NO3)2+2Ag 铜丝表面产生银白色固体 四、复分解反应 反应名称 化学方程式 备注 13. 氢氧化镁治疗胃“泛酸” Mg(OH)2+2HClMgCl2+2H2O 14. 大理石或石灰石和稀盐酸反应 CaCO3+2HClCaCl2+H2O+CO2↑ 实验室制取CO2 15. 硝酸银溶液和稀盐酸反应 AgNO3+HClAgCl↓+HNO3 产生白色沉淀 16. 氯化钡溶液和稀硫酸反应 BaCl2+H2SO4BaSO4↓+2HCl 产生白色沉淀 17. 硫酸铜溶液和氢氧化钠溶液反应 CuSO4+2NaOHCu(OH)2↓+Na2SO4 产生蓝色沉淀 18. 氯化铁溶液和氢氧化钠溶液反应 FeCl3+3NaOHFe(OH)3↓+3NaCl 产生红褐色沉淀 19. Na2CO3+Ca(OH)2CaCO3 碳酸钠溶液和石灰水反应 ↓+2NaOH 1. 硫酸铜溶液和熟石灰制取农药波尔多液 CuSO4+Ca(OH)2Cu(OH)2↓+CaSO4 2. 碳酸钠溶液和足量盐酸反应 Na2CO3+2HCl2NaCl+H2O+CO2↑ 3. 氯化钠溶液和硝酸银溶液反应 NaCl+AgNO3AgCl↓+NaNO3 AgCl不溶于HNO3 4. 硫酸钠溶液和氯化钡溶液反应 Na2SO4+BaCl2BaSO4↓+2NaCl BaSO4不溶于HNO3 五、其他反应 反应名称 化学方程式 备注 5. 甲烷燃烧 CH4+2O2CO2+2H2O 产生淡蓝色火焰 6. 少量二氧化碳通入石灰水 CO2+Ca(OH)2CaCO3↓+H2O 产生白色沉淀;石灰水在空气中变质; 石灰水用于检验CO2 7. 少量二氧化碳和氢氧化钠溶液反应 CO2+2NaOHNa2CO3+H2O NaOH在空气中变质; NaOH溶液用于吸收CO2 8. 氢氧化钠溶液吸收二氧化硫 SO2+2NaOHNa2SO3+H2O Na2SO3名称是亚硫酸钠 9. 一氧化碳还原氧化铜 CO+CuOCu+CO2 产生红色固体 尾气需要燃烧处理,防止CO污染空气 10. 一氧化碳还原氧化铁 3CO+Fe2O32Fe+3CO2 工业炼铁的主要反应 11. 盐酸除铁锈 Fe2O3+6HCl2FeCl3+3H2O 溶液变成棕黄色 12. 硫酸溶解氧化铜固体 CuO+H2SO4CuSO4+H2O 溶液变成蓝色 * 固体小颗粒分散到气体中形成烟;小液滴分散到气体中形成雾。 ** “烟雾”表示固体小颗粒和小液滴同时分散到气体中时的情形。 中考化学复习“背多分”1——化学基础 1. 21种元素及其符号 元素名称 氢 氦 碳 氮 氧 钠 镁 铝 硅 磷 硫 元素符号 H He C N O Na Mg Al Si P S 元素名称 氯 钾 钙 锰 铁 铜 锌 银 钡 汞 元素符号 Cl K Ca Mn Fe Cu Zn Ag Ba Hg 2. 化合价规律 K、Na、Ag、H、NH4(铵根) +1价 Ba、Mg、Ca、Zn、Cu、亚Fe +2价 Al、Fe +3价 Cl、OH(氢氧根)、NO3(硝酸根) -1价 O、CO3(碳酸根)、SO4(硫酸根) -2价 3. 金属活动性顺序 钾 钙 钠 镁 铝 锌 铁 锡 铅 氢 铜 汞 银 铂 金 K Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au 金属活动性依次减弱 4. 溶解性口诀 钾、钠、铵、硝溶 含有K、Na、NH4的碱和盐,含有NO3的盐,可溶 氢氧化钡、钙溶 Ba(OH)2、Ca(OH)2可溶 氯化银、硫酸钡不溶 盐酸盐中,AgCl不溶;硫酸盐中,BaSO4不溶 其它都不溶 如Cu(OH)2、Fe(OH)3、Mg(OH)2、Al(OH)3、Fe(OH)2 Zn(OH)2、CaCO3、BaCO3、Ag2CO3、CaSO3、BaSO3不溶 *“八大沉淀”: 白:CaCO3、BaCO3、Mg(OH)2、AgCl、BaSO4、Ag2CO3 蓝:Cu(OH)2 红褐:Fe(OH)3 **AgCl、BaSO4不溶于HNO3 5. 物质的俗称 物质 俗称 物质 俗称 物质 俗称 S 硫磺 Ca(OH)2 熟石灰、 消石灰 NaCl 食盐 Hg 水银 Ca(OH)2溶液 石灰水 Na2CO3 纯碱 CaO 生石灰 NaOH 烧碱、火碱、 苛性钠 CuSO4·5H2O 胆矾、蓝矾 H2O2 双氧水 HCl溶液 盐酸 1. 物质的颜色 白色 MgO、P2O5、CuSO4、 CaO、Ca(OH)2、CaCO3 红棕色 Fe2O3(铁锈的主要成分) 黑色 CuO、Fe3O4、MnO2、木炭 红褐色 Fe(OH)3 红色 Cu、红磷 棕黄色 FeCl3溶液 蓝色 Cu(OH)2、CuSO4·5H2O、 CuSO4溶液 中考化学复习“背多分”2——物质知识 1. 空气中含量最多的元素是N,O;地壳中含量最多元素是O,Si,Al,Fe。 2. 空气中N2的体积分数约为78%,O2的体积分数约为21%。 3. 稀有气体(氦气He)的性质很稳定,常用作保护气;在通电时能发出不同颜色的光,可制成霓虹灯。 4. 工业生产O2的方法:分离液态的空气。 5. 自来水生产过程中加入净水剂(明矾)起凝聚作用;在水中加入适量Cl2,起杀菌消毒作用。 6. 天然气的主要成分是甲烷(CH4)。 7. 焰色反应用于燃放焰火。 8. 酸碱指示剂变色口诀:紫色石蕊碱蓝酸红中不变,无色酚酞碱红酸不变。 一、单质 9. O2有助燃性,能使带火星的木条复燃;O2的浓度越大,燃烧程度越剧烈。 10. O2的性质和用途: 性质 氧化性 助燃性 用途 供给呼吸 支持燃烧 11. H2的性质和用途: 性质 可燃性 还原性 用途 作燃料 冶炼金属 12. 单质碳的性质和用途: 性质 金刚石硬度非常大 石墨有导电性 石墨软而滑 石墨熔点高 用途 做钻头、玻璃刀 作碳棒 做铅笔芯 做坩埚 13. 无定形碳的性质和用途: 性质 木炭有可燃性 活性炭有吸附性 炭黑常温下很稳定 焦炭有还原性 用途 作燃料 做防毒面具 做墨水 冶炼金属 14. 木炭、活性炭的吸附性属于物理性质。 二、氧化物 15. 水的性质和用途: 性质 0℃~4℃,反常膨胀 比热容大 分散能力强 用途 防止下层水结冰 降温 作溶剂 16. CO的性质和用途: 性质 可燃性 还原性 用途 作燃料 冶炼金属 17. CO能与血红蛋白结合,具有毒性,是污染空气的有害气体。 18. 干冰:固态的CO2。 19. CO2的性质和用途: 性质 进行光合作用 一般情况下,既不可燃也不助燃 干冰会升华 用途 使农作物增产 灭火 保藏食品、人工降雨 20. CO2的化学性质:①氧化性(和C反应);②和H2O反应;③和石灰水反应。 21. CaO在空气中变质: CaO+H2OCa(OH)2,CO2+Ca(OH)2CaCO3↓+H2O 1. 氧化物的性质 ①CO2+H2OH2CO3 ②CaO+H2OCa(OH)2(CaO可作干燥剂) ③CO2+2NaOHNa2CO3+H2O ④CO2+Ca(OH)2CaCO3↓+H2O ⑤CuO+2HClCuCl2+H2O ⑥CuO+H2SO4CuSO4+H2O ⑦Fe2O3+6HCl2FeCl3+3H2O ⑧Fe2O3+3H2SO4Fe2(SO4)3+3H2O 2. 铁锈属于混合物,其主要成分是Fe2O3。 3. 矿物燃料的燃烧产生大量CO2、SO2。CO2加剧“温室效应”,SO2导致“酸雨”。 三、酸 4. 酸是由氢元素和酸根组成的化合物。 5. “三大强酸”:HCl、H2SO4、HNO3 6. 盐酸是HCl的水溶液,属于混合物。 7. 浓盐酸有挥发性,挥发出HCl气体与空气中的水蒸气形成白雾。 8. 酸的通性:①有酸性、腐蚀性;②使酸碱指示剂变色;③能和碱反应;④能和碱性氧化物反应;⑤能和盐反应;⑥能和金属反应。 四、碱 9. 碱是由金属元素(或铵根)和氢氧根组成的化合物。 10. “四大强碱”:NaOH、KOH、Ca(OH)2、Ba(OH)2 11. Ca(OH)2的溶解性为微溶(在20℃时,溶解度为0.165g/100g水); 12. 随着温度的升高,Ca(OH)2的溶解度逐渐减小。 13. 石灰水是Ca(OH)2的溶液。 14. 石灰乳、石灰浆是Ca(OH)2的悬浊液。 15. Ca(OH)2或石灰水在空气中变质:CO2+Ca(OH)2CaCO3↓+H2O 16. NaOH易溶于水,溶于水时放出热量。 ①NaOH在空气中容易吸收水蒸气,有吸水性,可以作干燥剂,但不能干燥酸性气体(如CO2、HCl、SO2)。 ②NaOH在空气中变质:CO2+2NaOHNa2CO3+H2O 17. 称量NaOH固体时,应该放在烧杯中,不能使用称量纸。 18. 碱的通性:①有碱性、腐蚀性;②使酸碱指示剂变色;③能和酸反应;④能和酸性氧化物反应;⑤能和盐反应。 五、盐 19. 盐是由金属元素(或铵根)和酸根组成的化合物。 20. Na2CO3属于盐,它的水溶液呈碱性。 21. CuSO4·5H2O属于纯净物、化合物、盐。 22. 饱和的CuSO4溶液结晶析出的是CuSO4·5H2O。 23. 化肥的分类:氮肥、磷肥、钾肥 24. 氮肥:硫酸铵(NH4)2SO4、硝酸铵NH4NO3、碳酸氢铵NH4HCO3 25. 复合肥料:KNO3 26. 草木灰的主要成分为K2CO3,作钾肥。 中考化学复习“背多分”3——基本概念和理论 1. 化学变化:有其他物质生成的变化。 2. 物理变化:没有其他物质生成的变化。 3. 物理性质:不需要发生化学变化就能表现出来的性质。 4. 化学性质:只有通过发生化学变化才能表现出来的性质。 5. 混合物:由两种物质或多种物质组成的物质体系。 6. 纯净物:只含有一种物质(或只含有同一种分子)。 7. 单质:由同种元素组成的纯净物。 8. 化合物:由不同种元素组成的纯净物。 9. 氧化物:由两种元素组成,其中一种是氧元素的化合物。 10. 单质是元素的游离态,化合物是元素的化合态。 11. 分子:保持物质化学性质的一种微粒。 12. 原子:化学变化中最小的微粒。 13. 分子、原子的基本特征 ①体积很小;②质量很小;③不断地运动;④微粒间有间隙。 14. 在化学变化中,分子可以再分,而原子却不能再分。 15. 催化剂:能改变反应速率,自身的化学性质和质量不会发生变化。 16. MnO2可以作KClO3、H2O2分解的催化剂,起催化作用。 17. 质量守恒定律:参加反应的反应物质量总和,等于生成物的质量总和。 18. 质量守恒定律本质:化学反应前后,原子的种类(元素的种类)和数目不变。 19. 化学反应前后:分子种类一定发生变化,分子数目可能发生变化。 20. 溶液:均一、稳定的混合物。 21. 溶液是由溶质和溶剂组成的。 22. 悬浊液:固体小颗粒和水形成的混合物。 23. 乳浊液:液体小颗粒和水形成的混合物。 24. 物质的溶解性跟溶质种类、溶剂种类、温度、气体压强有关 25. 通常把在室温(20℃)下,溶解度小于0.01 g/100g水的物质叫难溶物质;溶解度在0.01~1 g/100g水的物质叫微溶物质;溶解度在1~10 g/100g水的叫可溶物质;溶解度在10 g/100g水以上的物质叫易溶物质。 26. 大多数固体物质在水中的溶解度随温度升高而增大,少数固体物质的溶解度随温度升高而减小。 27. 气体在水中的溶解度随温度升高而减小,随压强的增大而增大。 28. 溶解度:指在一定温度下,某物质在100 g溶剂里达到饱和状态时所溶解的克数。 29. 在25℃时,pH=7的溶液是中性溶液; pH>7的溶液是碱性溶液,pH越大,碱性越强; pH<7的溶液是酸性溶液,pH越小,酸性越强。 30. 使燃料充分燃烧应采用的措施:①提供充足的空气;②增大燃料和空气的接触面积(把固体燃料粉碎、把液体燃料喷成雾状) 31. 无定形碳:木炭、活性炭、焦炭、炭黑 32. 同素异形现象:由同一种元素组成不同的单质的现象。 33. 碳元素的同素异形体:金刚石、石墨和足球烯(C60) 34. 氧元素的同素异形体:O2和O3(臭氧) 35. 酸性溶液可能是酸的溶液或盐的溶液。 36. 碱性溶液可能是碱的溶液或盐的溶液。 37. 碱性氧化物:能跟酸反应生成盐和水的氧化物。 38. 大多数金属氧化物属于碱性氧化物。 39. 酸性氧化物:能跟碱溶液反应生成盐和水的氧化物。 40. 大多数非金属氧化物属于酸性氧化物。 41. “四大基本反应类型”:化合反应、分解反应、置换反应、复分解反应(含中和反应) 42. 化合反应:把两种或两种以上的物质生成一种新物质的反应。 43. 分解反应:把由一种物质生成两种或两种以上新物质的反应。 44. 置换反应:由一种单质和一种化合物发生反应,生成另一种单质和另一种化合物的反应。 45. 复分解反应:由两种化合物相互交换成分,生成另外两种化合物的反应。 46. 酸和碱的反应称为中和反应,并放出热量。 47. 复分解反应生成物的条件:生成物中必须要有沉淀、气体或水。 48. 在金属活动性中,排在氢前面的金属能置换出稀盐酸或稀硫酸中的氢元素;只有排在前面的金属,才能把排在后面的金属从它们的盐溶液中置换出来。(除K、Ca、Na) 49. 比较金属活动性强弱的方法:①金属和酸反应;②金属和盐溶液反应。 50. 通常把含有碳元素的化合物称为有机化合物(简称有机物)。有些物质虽然也含碳元素,但化学性质与无机物相似,如CO、CO2、H2CO3、CaCO3等,它们仍属于无机物。 51. 常见的有机物:甲烷CH4(最简单的有机物)、酒精C2H6O、葡萄糖、蔗糖、淀粉。 52. 反应规律 中考化学复习“背多分”4——化学实验 一、物质的性质 1. “三大还原剂”:H2、C、CO。 2. CO还原CuO时:先通CO赶空气,防止加热时CO和空气发生爆炸。 3. CO还原CuO反应结束后:停止加热,通CO直至固体冷却,防止灼热的铜被空气中的氧气氧化。 4. CO还原CuO时,尾气燃烧处理的原因:防止有毒的CO污染空气。 5. H2还原CuO的现象:产生红色固体,试管口产生无色液体。CuO+H2 △ Cu+H2O 6. H2还原CuO时,先通H2赶尽试管中的空气,防止加热时H2与空气发生爆炸。 7. H2还原CuO反应结束后,继续通H2直至试管冷却,防止灼热的Cu被空气中的O2氧化。 8. 铁丝在盛有O2的集气瓶中燃烧时:瓶底要留有少量的水或黄沙,防止灼热的产物使瓶底炸裂。 9. 电解水的实验现象:正负极都产生大量气泡,负极产生的气体体积是正极的2倍。 10. 电解水的实验结论: ①负极产生H2,正极产生O2;H2的体积是O2的2倍; ②水是由H元素和O元素组成的; ③在化学变化中,分子分裂为原子,原子重新构成新的分子。 11. 证明NaOH溶液和盐酸发生反应:NaOH+HClNaCl+H2O 在NaOH溶液中滴入酚酞试液,再加入过量盐酸,溶液变无色,说明发生反应。 12. 证明CO2和NaOH溶液发生反应:CO2+2NaOHNa2CO3+H2O ①在CO2中加入NaOH溶液,由于装置中气压变小而产生现象(如气球变大),说明发生反应。 ②在反应后的溶液中加入足量盐酸,产生气泡,说明发生反应。 Na2CO3+2HCl2NaCl+H2O+CO2↑ ③在反应后的溶液中加入Ca(OH)2(或CaCl2)溶液,产生白色浑浊,说明发生反应。 Na2CO3+Ca(OH)2CaCO3↓+2NaOH(或Na2CO3+CaCl2CaCO3↓+2NaCl) 13. 将铁丝放入CuSO4溶液中,铁丝表面产生红色固体,说明活动性Fe>Cu;将铜丝放入FeSO4溶液中,铜丝表面无明显现象,说明活动性Cu<Fe。 Fe+CuSO4FeSO4+Cu 14. 铜丝和AgNO3溶液反应,铜丝表面产生银白色固体。 Cu+2AgNO3Cu(NO3)2+2Ag 15. 加热CuSO4·5H2O的实验现象:固体由蓝变白,试管口产生无色液体。 CuSO4·5H2OCuSO4+5H2O 二、气体的制取 16. 先检查装置的气密性,后装入药品。 17. 需要检查装置气密性的实验: ①红磷在集气瓶中燃烧测空气中氧气的含量、②实验室制取O2、③实验室制取CO2、④CO还原CuO 18. 检查装置气密性的方法:①加热法、②液差法 1. 在试管中加热固体时:试管口应该略朝下倾斜,防止加热产生的水流到试管底部,使试管炸裂。 2. KClO3制取O2时:先加热赶尽装置中的空气,待有大量气泡产生时开始收集。实验结束后,先将导管移出水槽,后熄灭酒精灯,防止水倒流使试管炸裂。 3. 气体的制取装置包括发生装置和收集装置。 4. 反应物的状态和反应条件决定气体的发生装置。 发生装置 反应物状态 反应条件 制备气体 实验药品 ①加热固体型 固体 加热 O2 KClO3和MnO2 ②固液反应型 固体和液体 不加热 O2 H2O2溶液和MnO2 CO2 大理石和稀盐酸 H2 锌粒和稀硫酸(稀盐酸) 5. 气体的性质决定气体的收集装置。 收集方法 气体的性质 收集气体 ①排水法 难溶于水 O2、H2 ②向上排空气法 密度比空气大 O2、CO2 ③向下排空气法 密度比空气小 H2 6. O2的收集方法:①O2难溶于水,用排水法收集;②相同条件下,O2的密度比空气大,用向上排空气法收集。 7. 与排空气法相比,排水法收集氧气的优势有: ①无需验满,操作方便;②收集时,氧气损失较少;③收集的氧气纯度较大 8. 排水法收集O2时:当有气泡从集气瓶口逸出,说明O2收集满。 9. CO2的收集方法:相同条件下,CO2的密度比空气大,用向上排空气法收集。 CO2可溶于水,不能用排水法收集。 10. H2的收集方法:①H2难溶于水,用排水法收集;②相同条件下,H2的密度比空气小,用向下排空气法收集。 11. 向上排空气法收集O2时验满的方法:将带火星的木条放在集气瓶口,复燃说明收集满。 12. 向上排空气法收集CO2时验满的方法:将带火焰的木条放在集气瓶口,熄灭说明收集满。 13. 实验室制取CO2时:长颈漏斗要伸至瓶底,被盐酸浸没,防止CO2从长颈漏斗逃逸。 三、其它实验 14. 量筒读数时:应将量筒放置水平,并使视线与凹液面的最低处保持水平。 15. 红磷测定空气中O2的含量现象:集气瓶中产生大量白烟;水倒流进入集气瓶,约占集气瓶体积的。 16. 配制氯化钠溶液的主要步骤:计算,称量,量取,溶解。 17. 将不饱和溶液转变为饱和溶液的一般方法:增加溶质、蒸发溶剂、降低温度(减小溶解度)。 18. 将饱和溶液转变为不饱和溶液的一般方法:增加溶剂、升高温度(增大溶解度)。 19. 溶解度受温度影响变化比较小的固体物质,一般是用蒸发结晶的方法来得大量晶体。溶解度受温度影响变化比较大的固体物质,一般是用降温结晶(冷却热饱和溶液)的方法来得到晶体。 结晶法提纯固体混合物的具体操作 ①蒸发结晶法:溶解,蒸发结晶,过滤,洗涤,干燥 ②降温结晶法:溶解,蒸发浓缩,降温结晶,过滤,洗涤,干燥 1. pH试纸的使用方法:先把一小块试纸放在表面皿上,用玻璃棒蘸取溶液点到pH试纸上,再观察试纸颜色的变化,跟标准比色卡对比,就可测出pH值,显色以半分钟内的变化为准。(广泛pH试纸的读数为1~14的整数) 中考化学复习“背多分”5——物质的分离、鉴别、检验、吸收 一、物质的分离 1. 过滤:把不溶性的固体跟液体分离的方法。 2. 过滤操作要点“一贴二低三靠”及其原因: 要点 内容 原因 一贴 滤纸紧贴漏斗内壁 加快过滤速度 二低 滤纸低于漏斗边缘 防止滤液损失 漏斗中液面低于滤纸边缘 防止滤渣混入滤液 三靠 烧杯尖嘴靠玻璃棒 防止滤液损失 玻璃棒靠三层滤纸 防止滤纸破损,滤渣混入滤液 漏斗尖嘴靠烧杯内壁 加快过滤速度 3. 粗盐提纯的主要步骤:称量粗盐,溶解,过滤,蒸发,称量精盐,计算产率。 4. 粗盐除去不溶性杂质后得到的精盐中含有可溶性杂质,所以精盐属于混合物。 二、物质的鉴别 物质的鉴别 方法,现象和结论 ,方程式 5. 鉴别稀盐酸(HCl)和稀硫酸(H2SO4) 加入BaCl2溶液,产生白色浑浊的是H2SO4,无明显现象的是HCl BaCl2+H2SO4BaSO4↓+2HCl 6. 鉴别Ca(OH)2溶液和NaOH溶液 ①通入CO2,产生白色浑浊的是Ca(OH)2溶液,无明显现象的是NaOH溶液 CO2+Ca(OH)2CaCO3↓+H2O CO2+2NaOHNa2CO3+H2O ②加入Na2CO3溶液,产生白色浑浊的是Ca(OH)2溶液,无明显现象的是NaOH溶液 Na2CO3+Ca(OH)2CaCO3↓+2NaOH 三、物质的检验 物质的检验 方法,现象和结论 方程式 7. 检验O2 将带火星的木条伸入集气瓶中,复燃说明是O2 8. 检验CO2 加入适量石灰水,变浑浊,说明是CO2 Ca(OH)2+CO2CaCO3↓+H2O 9. 检验CO 将气体点燃,在火焰上罩一个内壁涂有石灰水的烧杯,石灰水变浑浊,说明是CO 10.检验混合气体中的CO 将气体通过灼热的CuO和石灰水,石灰水变浑浊,说明含有CO CO+CuOCu+CO2 Ca(OH)2+CO2CaCO3↓+H2O 11.检验H2 将气体点燃,在火焰上罩一个干而冷的烧杯,烧杯内壁产生无色液体,说明是H2 12.检验混合气体中的H2 通过灼热的CuO和CuSO4粉末,CuSO4粉末由白变蓝,说明含有H2 CuO+H2Cu+H2O CuSO4+5H2OCuSO4·5H2O 13.检验物质是否含有水 加入CuSO4粉末,如果固体由白变蓝,说明含有水 CuSO4+5H2OCuSO4·5H2O 14.检验Ca(OH)2是否变质 加入足量稀盐酸,产生气泡,说明变质 CaCO3+2HClCaCl2+H2O+CO2↑ 15.检验NaOH是否变质 ①加入足量稀盐酸,产生气泡,说明变质 Na2CO3+2HCl2NaCl+H2O+CO2↑ ②加入Ca(OH)2溶液,产生白色浑浊,说明变质 Na2CO3+Ca(OH)2CaCO3↓+2NaOH 16.检验碳酸盐(碳酸根) 加入足量盐酸,将产生的无色无味的气体通入石灰水,石灰水变浑浊说明是碳酸盐 *检验混合气体中的CO2和水蒸气时,先通过CuSO4粉末检验水蒸气,再通过石灰水检验CO2。(在初中阶段,气体通过溶液后混有水蒸气) 四、物质的吸收 物质的吸收 方法 17.吸收CO2 通入足量的NaOH溶液 CO2+2NaOHNa2CO3+H2O 18.吸收水蒸气 通过干燥剂(NaOH固体或CaO固体) NaOH能作干燥剂的原因:有吸水性 CaO能作干燥剂的原因:CaO+H2OCa(OH)2 *石灰水不适用于吸收CO2的原因:Ca(OH)2微溶,饱和石灰水的溶质的质量分数很小,无法充分吸收CO2。 **吸收混合气体中的CO2和水蒸气时,先通过NaOH溶液吸收CO2,再通过干燥剂吸收水蒸气。查看更多