- 2021-04-19 发布 |
- 37.5 KB |
- 14页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018中考化学重难点专题完全突破——坐标曲线图含答案
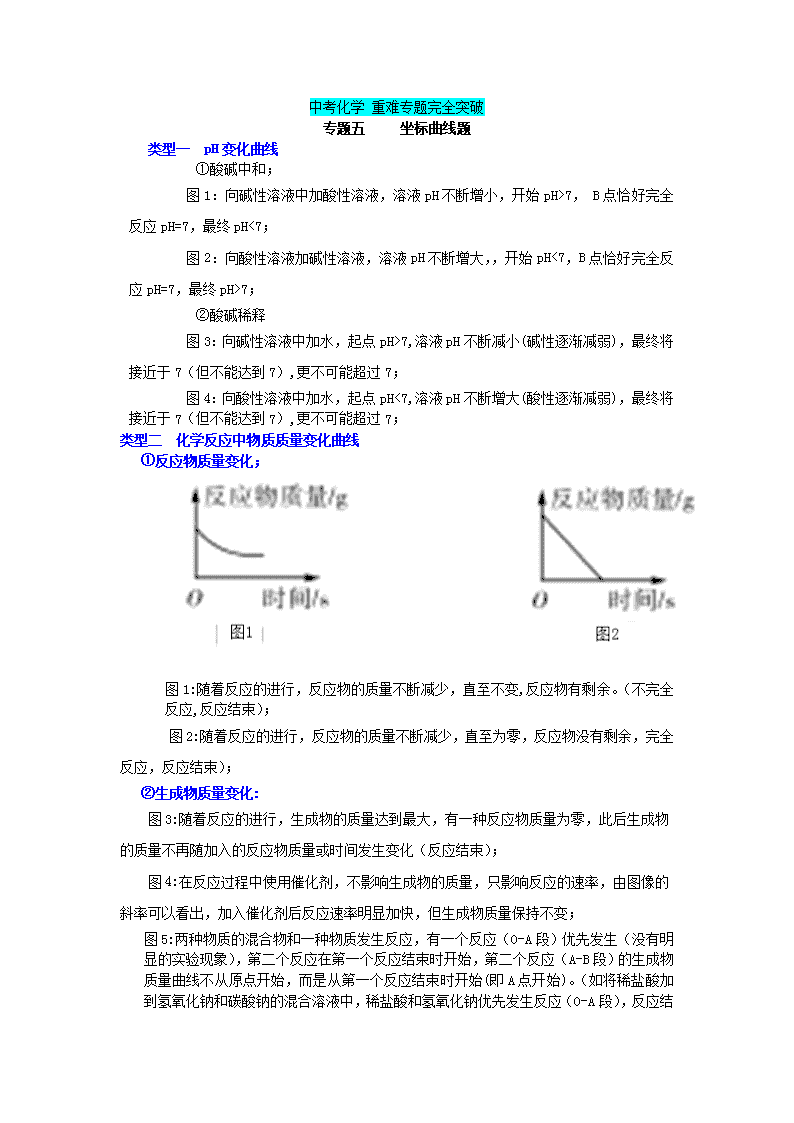
中考化学 重难专题完全突破 专题五 坐标曲线题 类型一 pH变化曲线 ①酸碱中和; 图1:向碱性溶液中加酸性溶液,溶液pH不断增小,开始pH>7, B点恰好完全反应pH=7,最终pH<7; 图2:向酸性溶液加碱性溶液,溶液pH不断增大,,开始pH<7,B点恰好完全反应pH=7,最终pH>7; ②酸碱稀释 图3:向碱性溶液中加水,起点pH>7,溶液pH不断减小(碱性逐渐减弱),最终将接近于7(但不能达到7),更不可能超过7; 图4: 向酸性溶液中加水,起点pH<7,溶液pH不断增大(酸性逐渐减弱),最终将接近于7(但不能达到7),更不可能超过7; 类型二 化学反应中物质质量变化曲线 ①反应物质量变化; 图1:随着反应的进行,反应物的质量不断减少,直至不变,反应物有剩余。(不完全反应,反应结束); 图2:随着反应的进行,反应物的质量不断减少,直至为零,反应物没有剩余,完全反应,反应结束); ②生成物质量变化: 图3:随着反应的进行,生成物的质量达到最大,有一种反应物质量为零,此后生成物的质量不再随加入的反应物质量或时间发生变化(反应结束); 图4:在反应过程中使用催化剂,不影响生成物的质量,只影响反应的速率,由图像的斜率可以看出,加入催化剂后反应速率明显加快,但生成物质量保持不变; 图5:两种物质的混合物和一种物质发生反应,有一个反应(O-A段)优先发生(没有明显的实验现象),第二个反应在第一个反应结束时开始,第二个反应(A-B段)的生成物质量曲线不从原点开始,而是从第一个反应结束时开始(即A点开始)。(如将稀盐酸加到氢氧化钠和碳酸钠的混合溶液中,稀盐酸和氢氧化钠优先发生反应(0-A段),反应结束后稀盐酸和碳酸钠反应(从A点开始),产生气体,并且气体质量达到最大后(B点),质量不随时间的变化而增加。 ③反应后剩余物质量变化; 图6:固体物质与溶液发生反应时,消耗的固体物质质量比生成的固体物质质量大时,随着反应的进行,溶液质量增加。 图7:固体物质与溶液发生反应时,消耗的固体物质质量比生成的固体物质质量小时,随着反应的进行,溶液质量减小。 图8:固体物质和其他物质发生反应仅生成固体,随着反应的进行,剩余固体质量不断增大,直至反应结束后,剩余固体的质量保持不变,增加的是参与反应的气体(液体)质量。 图9:固体物质反应生成气体时,当反应一开始,就生成气体,剩余固体的质量从反应一开始就减小,如加热一定质量的氯酸钾和二氧化锰的混合物。 图10:固体物质反应生成气体时,要加热一段时间才会生成气体,剩余固体的质量从中间开始减小。如加热一定质量的氯酸钾或一定质量的高锰酸钾或高温煅烧石灰石; ④化学反应中物质总质量的变化; 图 11:在密闭容器中,随着反应的进行,反应物和生成物的质量总和不会发生变化。 ⑤活泼金属与酸反应的曲线。 图12:等量金属(Mg、Zn、 Fe)与足量酸反应,反应后酸有剩余,产生的氢气质量不相等; 图13:足量金属(Mg、Zn、 Fe)与等量酸反应,反应后金属有剩余,产生的氢气质量相等; 对于所用金属属元素的化合价相同时,有以下规律: ①谁先出现“拐角”,谁的金属活动性强; ②谁的“平台”越高,谁产生的H2量越多,对应金属的相对原子质量越小,消耗的酸量越多。 类型三 溶质质量分数变化曲线 不发生化学反应时质量分数变化曲线; 图1:一定温度下,向一定量设水中加入某种溶质,起点为零,溶质的质量(溶质的质量分数)不断增加,当溶液达到饱和时,溶质的质量(溶质的质量分数)不再增加。 图2:一定温度下,向某种接近饱和的溶液中加入该溶质,起点不为零,溶质的质量(溶质的质量分数)不断增加,当溶液达到饱和时,溶质的质量(溶质的质量分数)不再增加。 图3:一定温度下,向某种饱和的溶液中加入该溶质,溶质的质量(溶质的质量分数)不再增加。 图4:一定温度下,稀释溶液时,起点不为零,随着水的加入,溶质质量保持不变,溶液质量增大,溶质的质量分数不断减小,趋于零,但不等于零。 ②发生化学反应时质量分数变化曲线; 图5:反应物为溶质时,随着反应的进行,溶质质量分数不断减小,到反应结束时,为零. 图6:生成物为溶质时, 随着反应的进行,溶质质量分数不断增大,到反应结束时,生成物质量分数达到最大,且不随时间的改变而改变,保持不变. 类型五 溶解度的变化曲线 ①气体溶解度曲线; 图1:气体的溶解度随温度的升高而减小; 图2: 气体的溶解度随压强的升高而增大; ②固体物质的溶解度曲线。 分析下图的溶解度曲线,总结规律,回答问题: ①Q点的含义: 在t3℃时A物质的溶解度是120g。(固体溶解度曲线上任意一点的含义) ② P点的含义:在t2℃时A物质和C物质的溶解度相等都是60g 。(固体溶解度曲线上交点的含义) ③ t1℃时A、B、C的溶解度由大到小的顺序为C>B>A 。(同一温度下不同物质溶解度大小的比较) ④ t3℃时,A物质的饱和溶液中,溶质、溶剂、溶液的质量之比为 6:5:11。(从溶解度曲线上认识溶液的组成) ⑤ t℃时,将A物质的不饱和溶液转变成饱和溶液可采取的方法加溶质或蒸发溶剂(降低温度)。t℃时,将C物质的不饱和溶液转变成饱和溶液可采取的方法加溶质 或 蒸发溶剂(升高温度)。(不饱和溶液和饱和溶液之间的转化) ⑥ 在t2℃时,40g A物质加入到50g水中不断搅拌,只能形成80g溶液。(溶液能否全溶) ⑦ t3℃时A、B、C的饱和溶液各W克,降温到t1℃时,析出晶体最多的有 A 物质。(降温结晶) ⑧ 从A溶液中获取A晶体(即提纯甲晶体),可用降温结晶(冷却热饱和溶液)的方法。 从C溶液中获取C晶体(即提纯乙晶体),可用蒸发结晶的方法。(溶解度有明显差异的混合物的提纯) ⑨将t2℃时A、B、C三种物质的饱和溶液降温到t1℃时三种物质的溶质质量分数由大到小的顺序是 B>C >A ;(降温后溶液溶质质量分数的变化) ⑩ t 3 ℃ 时等质量的A、B、C三种物质的饱和溶液降温至 t 1 ℃,所得溶液中溶剂的质量由大到小的顺序为 C>B>A。(降温后溶液中溶剂的变化) 【专题分类突破】 类型一 综合型坐标图像题 1.(2019∙兰州)下列图像与所对应操作相符的是( D ) A.用两份等质量、等质量分数的过氧化氢溶液制取氧气 B.向一定质量分数的盐酸中不断加水 C.向等质量的锌片、镁片中分别加入足量的等质量分数的稀硫酸 D.向一定质量的氧化铜和稀盐酸的混合溶液中不断加NaOH溶液 【解析】在过氧化氢分解过程中,催化剂只能加快反应速率,不能增加生成物氧气的质量,A错误;将盐酸稀释,其pH值只能无限接近7,不可能等于或大于7,B错误;金属越活泼,生成氢气的速度越快。生成物都是+2价盐,金属相对原子质量越小,生成氢气越多,则 镁比锌放出氢气多,C错误;氢氧化钠先与盐酸反应,因此反应开始时无沉淀产生,等盐酸耗尽,氢氧化钠再与氯化铜反应产生蓝色沉淀,D正确。 2.(2019∙天水)下列图像中有关量的变化趋势正确的是( C ) A.某温度下,向一定量不饱和硝酸钾溶液中不断加入硝酸钾晶体 B.向一定量的稀盐酸中逐滴滴加水 C.向一定量的氢氧化钠和碳酸钠的混合溶液中逐滴滴加盐酸 D.将水通电电解一段时间 【解析】一定温度下,向不饱和硝酸钾溶液中加入硝酸钾,固体溶解,溶质质量分数增大,达到饱和后质量分数不再变化,但最初溶液是不饱和溶液,质量分数不为0,A错误;盐酸中加水,pH值只能无限接近于7,不可能大于或等于7,B错误;加入的盐酸先与氢氧化钠反应,没有气体生成,再与碳酸钠反应,放出无色气体,C正确;电解水得到氧气和氢气的体积比是1:2,不是质量比,D错误。 3.(2019∙玉林) 下列图像中能正确反映其对应关系的是( C ) A.向某温度时一定量的不饱和硝酸钾溶液中不断加入硝酸钾固体 B.向等质量的锌粉和铁粉中分别加入足量的溶质质量分数相同的稀硫酸 C.一定温度下向一定量的某饱和氢氧化钙溶液中加入少量氧化钙 D.一定温度下,两份质量和溶质质量分数均相等的过氧化氢溶液分别在有无二氧化锰的情况下制取氧气 【解析】A.向一定量不饱和的硝酸钾溶液中再加入硝酸钾固体,还能继续溶解部分硝酸钾,溶质质量分数逐渐增大,直到溶液饱和后硝酸钾不再溶解,其溶质的质量分数不再变化,但溶质质量分数起点不为零,错误;B.等质量的锌、铁与足量的稀硫酸反应,铁产生的氢气多,锌比铁活泼,锌与硫酸的反应速率大,错误;C.生石灰与水反应生成氢氧化钙,溶液中溶剂质量减少,析出溶质氢氧化钙,又由于生石灰与水反应生成氢氧化钙时放出热量,在反应过程中溶液温度升高,氢氧化钙溶解度随温度升高而减小,因此溶液质量减少;当反应结束温度冷却至室温,溶解度逐渐增大到加入生石灰前溶解度,溶液增大,直至不再改变,正确;D.催化剂只是改变反应速率,不会改变生成物的量,即生成氧气的质量相等,错误; 4.(2019∙随州)大数据能及时获得更多的信息。下列图像能正确反映对应变化关系的是( A ) 【解析】铁粉能与盐酸反应产生氯化亚铁和氢气,向一定量的盐酸中加铁粉, 溶液中铁元素的质量分数逐渐增加,稀盐酸完全反应后,铁元素的质量分数不再增加,A正确;浓硫酸有吸水性,浓硫酸敞口放置一段时间后,溶质质量不变,溶液质量增大,溶液中溶质的质量分数逐渐变小,B错误;向一定量的氢氧化钠溶液中滴加盐酸,溶液中氯化钠的质量分数逐渐增加,完全反应后,继续滴加稀盐酸,溶液中氯化钠的质量分数逐渐减小,C错误;氢氧化钠溶液的pH大于7,加水稀释后溶液的碱性变弱,pH值变小,但不会变为酸性,D错误。 5.(2019∙孝感)下列图像不能正确反映对应变化关系的是(D) A.向等质量的氧化钙、氢氧化钙中分别加入等质量分数的稀盐酸至过量 B.向一定质量氯化亚铁和氯化铝的混合溶液中加入镁粉至过量 C.向盐酸和氯化钙的混合溶液中逐滴加入纯碱溶液至过量 D.向等质量的镁、铝中分别加入等质量分数的稀硫酸至过童 【解析】氧化钙与稀盐酸反应生成氯化钙和水,氢氧化钙与稀盐酸反应生成氯化钙与水,由于氧化钙、氢氧化钙充分反应时,钙元素全部转化为氯化钙,氧化钙中钙元素质量分数较氢氧化钙中钙元素质量分数大,所以等质量的氧化钙与氢氧化钙,完全反应时氧化钙反应生成氯化钙的质量大,A正确;镁、铝、铁三种金属的活动性依次减弱,所以将镁粉加入氯化亚铁和氯化铝的混合溶液中,根据反应的最终结果分析,可认为镁先与氯化亚铁反应,氯化亚铁反应完后,镁粉再与氯化铝反应,镁与氯化亚铁反应时,参加反应的氯化亚铁的质量大于反应生成的氯化镁的质量,所以该反应过程中溶液的质量减小,镁与氯化铝反应时,参加反应的氯化铝的质量小于反应生成的氯化镁的质量,所以该反应过程中溶液的质量增加,当溶液中氯化亚铁和氯化铝均完全反应,继续加入镁粉,不再反应,溶液的质量不变,B正确;盐酸和氯化钙的混合溶液显酸性,溶液的pH小于7,往盐酸和氯化钙的混合溶液中加入碳酸钠溶液时,碳酸钠能与溶液中的两种溶质反应,且碳酸钠与氯化钙反应生成的碳酸钙能与盐酸反应,所以从反应的最终结果考虑,可认为加入的碳酸钠先与盐酸反应,盐酸反应完之后,碳酸钠再与氯化钙反应,碳酸钠与盐酸反应时,溶液酸性逐渐减弱,碳酸钠与盐酸完全反应后生成的氯化钠溶液,显中性,pH等于7,氯化钙溶液也显中性,所以碳酸钠与氯化钙反应过程中溶液仍然显中性,当氯化钙完全反应后,继续加入碳酸钠溶液,由于碳酸钠溶液过量,且碳酸钠溶液显碱性,所以溶液碱性增强,pH逐渐大于7,C正确;镁和铝都可与稀硫酸反应产生氢气,由于加入的稀硫酸是质量分数相等且过量的,因此最终生成氢气的质量由金属的质量决定,等质量的镁、铝分别与上述稀硫酸充分反应时,镁和稀硫酸反应生成的氢气的质量较铝的多,D不正确。 6.(2107∙邵阳)下列图像与对应叙述相符合的是(C ) A.向一定量的锌粒中加入稀硫酸 B.向 pH=3 的溶液中加水 C.向一定量的二氧化锰中加入过氧化氢溶液 D.向一定量的氯化钙溶液中加入碳酸钾溶液 【解析】A.锌和稀硫酸反应生成硫酸锌和氢气,随着反应进行,氢气质量增大,当锌完全反应后氢气质量不再增大,该选项对应关系不正确;B.酸溶液稀释时,溶液的酸性减弱,pH升高,但是不能升高到7,更不能大于7,该选项对应关系不正确;C.过氧化氢在二氧化锰催化作用下分解生成水和氧气,二氧化锰作催化剂,质量始终不变,该选项对应关系正确;D.氯化钙和碳酸钾反应生成白色沉淀碳酸钙和氯化钾,因此加入碳酸钾溶液时,立即产生白色沉淀,而图中是加入一定量的碳酸钾溶液后才产生白色沉淀,该选项对应关系不正确.故选:C. 7.(2019∙呼和浩特)下列所示的四个图像,能正确反映对应变化关系的是( C ) A.电解水 B.向两份完全相同的稀盐酸中分别加入锌粉和铁粉 C.加热一定质量的离锰酸钾 D.向一定量的氢氧化钠溶液中加水稀释 【解析】A.电解水生成氢气和氧气的体积比是2:1,而不是质量比,故错误;B.由化学方程式:Zn+2HCl=Zn+H2↑,Fe+2HCl=Fe+H2↑,可知,生成相同质量的氢气质量需要的锌的质量大于铁,故错误;C.高锰酸钾加热一段时间才分解,随着生成氧气量的增加,固体质量在不断减少,但是锰元素的质量不变,所以固体中锰元素的质量分数变大;反应结束后,固体质量不再减少,则固体中锰元素的质量分数也不再改变,故正确;D.氢氧化钠是一种碱,无论加入多少水稀释,溶液仍显碱性,pH始终大于7,故错误。故选C. 8.(2019∙聊城)下列图像能正确反映其对应变化关系的是(D) A.加热一定质量的碳酸氢钠固体 B.向盛有少量硫酸溶液的烧杯中滴加一定质量的水 C.向盛有一定质量二氧化锰的烧杯中加入过氧化氢溶液 D.向盛有一定质量NaOH和Na2CO3混合溶液的烧杯中滴加稀盐酸 【解析】碳酸氢钠受热分解生成碳酸钠、水和二氧化碳,即碳酸钠充分分解后,剩余固体是碳酸钠,固体质量不为零,A错误;硫酸加水稀释浓度变小,酸性变弱,溶液pH 无限接近于7但不会等于7,B错误;二氧化锰催化过氧化氢分解实验中,二氧化锰是催化剂,过氧化氢是反应物,随着过氧化氢的质量的不断增加,生成氧气的质量也会不断增加,C错误;向氢氧化钠和碳酸钠的混合溶液中缓慢滴入稀盐酸,稀盐酸首先和氢氧化钠反应,,当氢氢氧化钠完全反应后,稀盐酸与碳酸钠反应生成二氧化碳气体,当碳酸钠完全反应,二氧化碳气体质量不再发生变化,D正确。 9.(2019∙泰安)下列四个图像中,能正确反映对应变化关系的是(B) A.向一定量的氢氧化钠溶液中逐滴加入pH =2的稀盐酸至过量 B.某温度时,向一定量的饱和石灰水中加入少量生石灰 C.向盐酸和氯化镁的混合溶液中滴加氢氧化钠溶液 D.将水通电一段时间 【解析】向一定质量的氢氧化钠溶液中加入pH=2的稀盐酸至过量时,溶液的pH会逐渐减小,越来越接近于2,但不可能等于2或小于2,A错误;某温度时,向一定量的饱和石灰水中加入少量的生石灰,氧化钙会和水反应生成氢氧化钙且放出大量的热,因而会有氢氧化钙析出,当氧化钙反消耗完,温度开始下降,氢氧化钙的溶解度增大,又会有少量的氢氧化钙溶解,因而溶质氢氧化钙的质量又增加,由于溶剂减少,溶质的质量也比原溶质质量减少,B正确;向盐酸和氯化镁的混合溶液中滴加氢氧化钠溶液,氢氧化钠先和盐酸反应,待盐酸反应完全,氢氧化钠继续与氯化镁反应生成氢氧化镁的沉淀,C错误;水在通电时产生氢气和氧气的体积比是2:1,质量比为1:8,D错误。 10.(2019∙枣庄)应对应变化关系是( A) A.向一定质量的AgNO3 C.在恒温条件下,将饱和的KNO3 D.向氢氧化钠溶液中不断加水 溶液中滴加NaCl溶液 B.两份等体积5%的过氧化氢溶液,向其中一份加入少量二氧化锰 溶液蒸发适量水 【解析】一定质量的AgNO3溶液中随NaCl的加入会出现白色AgCl沉淀,当AgNO3消耗完,沉淀不再产生,沉淀质量不再发生变化,A正确。相同体积和质量分数的过氧化氢溶液所能产生的氧气的质量相同,加入催化剂能使反应速率加快,不会增加生成物的质量,B错误;恒温条件下饱和KNO3溶液蒸发水分的同时也结晶析出KNO3,剩余溶液仍为饱和溶液,其溶质质量分数不发生改变;C错误。氢氧化钠溶液呈碱性,加水不断稀释,溶液票、pH会无限接近于7,但不会等于7或大于7,D错误。 11.(2019∙达州)下列图像不能正确反映其对应变化关系的是( B ) A B C D A.向一定质量的硫酸铜和稀硫酸的混合溶液中逐滴加入氢氧化钠溶液 B.向等质量、等浓度的稀硫酸中分别逐渐加入锌粉和铁粉 C.用等质量、等溶液的过氧化氢溶液在有无催化剂条件下制氧气 D.一定质量稀盐酸中逐滴加入氢氧化钠溶液 【解析】氢氧化钠首先与稀硫酸反应生成硫酸钠和水,当稀硫酸消耗完后,再与硫酸铜反应生成氢氧化铜沉淀和硫酸钠,沉淀质量增加,直到反应硫酸铜反应完全后保持不变,A正确;根据稀硫酸质量、浓度相等可知产生氢气质量相等,由于反应中锌、氢气的质量比为65:2,铁、氢气的质量比为56:2,可知反应停止时消耗金属锌的质量大,B错误;催化剂只能改变反应速率,不会影响生成物质量,C正确;稀盐酸显酸性,pH<7,加入氢氧化钠溶液后,二者反应生成氯化钠和水,随着加入氢氧化钠溶液质量增加,溶液酸性减弱,至恰好完全反应时,溶液pH=7,继续加入氢氧化钠溶液,溶液显碱性,pH>7,D正确。 12.(2019∙南充)下列图像能正确反映对应变化关系的是( C ) A B C D A.两份等质量的氯酸钾在有、无MnO2的情况下加热产生氧气 B.加水稀释浓盐酸 C.向稀盐酸和氯化钙的混合溶液中加入碳酸钠溶液 D.将足量粉末状的铁和镁分别与等质量、等质量分数的稀盐酸反应 【解析】二氧化锰作氯酸钾分解制氧气的催化剂,只能改变反应的速率,不会改变生成氧气的质量,故两份等质量的氯酸钾在有无二氧化锰的情况下加热产生氧气的质量是相同的,A错误;浓盐酸加水后,溶液浓度变稀,酸性变弱,pH值变大,但溶液pH始终不会大于7,B错误;向一定量的稀盐酸和氯化钙的混合溶液中不断滴入碳酸钠溶液,根据优先反应原则,碳酸钠先与盐酸反应,不产生沉淀,等盐酸反应完后再与氯化钙反应产生沉淀,C正确;足量的镁和铁投入到等质量、等质量分数的稀盐酸中,因为金属是足量的,产生氢气的质量由加入的酸的质量决定,故反应最终生成氢气一样多,D错误。 13.(2019∙重庆B)已知FeCl3也可以催化H2O2的分解,现向一定量的H2O2溶液中滴入几滴一定溶质质量分数的FeCl3 溶液,充分反应(忽略水的挥发).下列图象正确的是( B ) A. B. C. D. 【解析】A.一定量的过氧化氢溶液产生氧气的质量一定,当过氧化氢反应完毕后,气体质量不再增加,故错误;B.过氧化氢溶液中含有水,随着反应的进行,溶液中水的质量不断增加,当过氧化氢溶液反应完毕后,溶剂的质量不再增加,故正确;C.当反应完成后,溶液中过氧化氢的质量分数会变成零,故错误;D.反应过程中氯化铁的质量不变,随着氧气的产生,溶液的质量会逐渐减少,氯化铁的质量分数会增加,故错误; 类型二 pH曲线 1.(2019∙北京) 实验小组用传感器探究稀NaOH溶液与稀盐酸反应过程中温度和pH的变化。测定结果如下图所示。下列说法不正确的是( C ) A.反应过程中有热量放出 B.30s时,溶液中溶质为HCl和NaCl C.该实验是将稀盐酸滴入稀NaOH溶液 D.从20s到40s,溶液的温度升高、pH增大 【解析】A.由稀NaOH溶液与稀盐酸反应过程中温度的变化图可知,反应过程中有热量放出,故选项说法正确;B.30s时,溶液的pH小于7,溶液显酸性,溶液中溶质为HCl和NaCl,故选项说法正确;C.图象中pH值的变化是从小于7逐渐的增大到大于7,可知原溶液显酸性,然后不断的加入碱性溶液,使pH增大,说明是把氢氧化钠溶液滴加到稀盐酸中,故选项说法错误;D.由稀NaOH溶液与稀盐酸反应过程中温度的变化图可知,从20s到40s,溶液的温度升高,酸性减弱,pH增大,故选项说法正确。故选:C. 2.(2019∙襄阳) 某校化学兴趣小组利用数字化传感器探究稀盐酸和氢氧化钠溶液的反应过程,测得烧杯中溶液的pH随滴加液体体积变化的曲线如图所示。下列说法正确的是( B ) A.图中a点所示溶液中,含有的溶质是NaCl和Na0H B.由a点到b点的pH变化过程证明酸和碱发生了中和反应 C.向图中c点所示溶液中滴加无色酚酞,溶液不变色 D.该实验是将盐酸逐滴滴入到盛有氢氧化钠溶液的烧杯中 【解析】由图像的pH变化情况可知,该实验是向盐酸中加氢氧化钠溶液。a点为盐酸未全反应的过程,含有的溶质除生成的氯化钠外还有剩余的氯化氢,A错误;由a到b的pH变化过程证明酸和碱发生了中和反应,若不是发生反应,而是稀释,则pH不可能增大到7,B正确;C项,c点中溶质为氯化钠和氢氧化钠,所以加酚酞时,溶液会变红色,C错误;该实验是将氢氧化钠滴入到盐酸中,D错误。 3.(2019∙黔东南)某校化学小组在利用硫酸和氢氧化钾溶液探究酸碱中和反应时,利用数字化传感器测得烧杯中溶液pH的变化图象如图所示.下列说法正确的是( D ) A.图中c点所示溶液呈碱性 B.图中a点所示溶液中,含有的溶质是K2SO4和H2SO4 C.该实验是将氢氧化钾溶液逐滴滴入到盛有硫酸的烧杯中 D.由b点到c点的变化过程中没有发生化学反应 【解析】A.图中c点所示溶液pH<7,呈酸性,A错误;B.图中a点所示溶液中,含有的溶质是K2SO4和KOH,B错误;C.该实验是将硫酸逐滴滴入到盛有氢氧化钾溶液的烧杯中,C错误;D.b点反应已经结束,所以由b点到c点的变化过程中没有发生化学反应,D正确。 类型三 溶解度曲线 1.(2019∙天水)8.甲、乙两种物质的溶解度曲线如图所示,下列说法正确的是( A ) A. t1℃时,甲、乙两物质的溶解度相等 B.乙物质的溶解度大于甲物质的溶解度 C. t2℃时,乙物质的饱和溶液降温至t1℃,乙溶液变为不饱和溶液 D.t2℃时,30g甲物质能溶解于50g水中形成80g的溶液 【解析】从图像可以看出t1℃时A、B两物质溶解度相等,A正确;比较两种物质的溶解度,必须在同意温度下,没指名温度,B错误;乙的溶解度随温度的升高而增大,降温饱和溶液会析出晶体,仍然是饱和溶液,C错误;t2℃时100g水中溶解50g甲物质,50g水中溶解25g甲物质,溶液为75g,不是80g,D错误。 2.(2019∙兰州)甲、乙两种固体物质的溶解度曲线如图所示,请回答问题: (1) t1℃时,甲、乙两种物质的溶解度大小关系为甲_<乙(填“<”“>”或“=”); (2) P点的含义t3℃时,甲乙两物质的溶解度相等; (3) t2℃时,把20 g固体甲放入50 g水中,充分搅拌,所得溶液的质量是_62.5___g (4)欲将t2℃时乙物质的不饱和溶液变为该温度下的饱和溶液,可采取的一种方法是_加溶质乙________; (5)如果甲物质中含有少量乙物质,若要提纯甲,一般采用_降温结晶__的方法。 【解析】(1)从图像可以看出在t1℃时,甲的溶解度小于乙。(2)两条溶解度曲线的交点,表示该温度下这两种物质的溶解度相等。(3)在t2℃时甲的溶解度为25g,即100g水中最多溶解25g甲,则可得该温度下50g水中最多溶解12.5g甲,故所得溶液质量为62.5g。(4)由图可知,乙的溶解度随温度升高而增大,则将t2℃时乙物质的不饱和溶液变饱和溶液,可选择增加溶质、蒸发溶剂或降低温度等方法。(5)甲的溶解度受温度变化影响比较大,乙的溶解度受温度变化影响不大,则提纯甲物质可采用降温结晶(或冷却热饱和溶液)的方法。 3.(2019∙省卷)右图是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线,回答下列问题。 (1)t1 ℃时,将25 g丙加入到50 g水中充分溶解后所得溶液的质量为70 g。 (2)t2 ℃ 时,甲的溶解度_= (填“>”、“<”或“=”)乙的溶解度。 (3)甲中含有少量的乙,欲提纯甲应采用的方法是降温结晶(或冷却热饱和溶液)。 (4)将100 g 10%的甲溶液稀释到4%需加入150_g 水。 【解析】(1)t1℃时,丙物质溶解度40g,则50g水中最多溶解20g丙物质,溶液质量为70g; (2)t2℃时,甲、乙两物质溶解度曲线相交,则此时,甲、乙两物质的溶解度相等。 (3)甲物质溶解度随温度降低而减小,而乙受温度影响不大,可采取降温结晶提纯甲。 (4)根据溶液稀释前后溶质质量不变:设加水质量x,列100g×10%=(100g+x)×4%计算。 4.(2019∙武汉)R是硝酸钾或氯化铵中的一种。硝酸钾和氯化铵的溶解度曲线如图1所示.某化学兴趣小组的同学进行了如图2所示实验。 (1)t1℃时,氯化铵的济解度为_40_g。 (2)①的溶液中溶质质量分数为_25%。 (3)根据以上信息可推出R是_硝酸钾_(写名称或化学式均可)。 (4)关于图2中烧杯内的物质,以下几种说法正确的有_ BC _。 A.①、②、③中,只有③中上层清液是饱和溶液 B.若使③中的固体溶解,可采用加水或升温的方法 C.①和②的溶液中,溶质质量相等 D.①的溶液中溶质质量分数一定比③的上层清液中溶质质量分数小 【解析】(1)根据氯化铵的溶解度曲线可知,t1℃时氯化铵的溶解度为40g;(2)根据图示,①溶液全部溶解,且溶剂的质量为180g,溶质的质量为60g,所以溶液的溶质质量分数为60g/(180g+60g)×100%=25%;(3)②溶液中溶剂的质量为180g-80g=100g,溶质的质量为60g,而t2℃时氯化铵的溶解度小于60g,所以该溶液中的溶质不是氯化铵,而是硝酸钾;(4)由于R是硝酸钾,所以②溶液属于饱和溶液,即A不正确;硝酸钾的溶解度随温度升高而增大,所以使溶液中的固体溶解,可加入水或升高温度,B正确;①和②溶液中溶质的质量均为60g,C正确;溶液是饱和溶液,但不能确定其对应的温度,无法确定其溶解度,所以无法确定①和③中溶质质量分数的大小,D不正确。 5.(2019∙襄阳)甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线如右图所示。 (1)t1_℃时,甲的溶解度为20g。 (2)t2℃时将甲、乙、丙三种物质的饱和溶液各齐100g,分别降温到t1℃时,所得溶液中溶剂的质量由大到小依次为_丙、乙、甲_。 【解析】(1)由图像可知,在t1oC时,甲的溶解度为20g。(2)t2oC时将甲、乙、丙三种物质的饱和溶液各100g,分别降温到t1oC时,不管是析出晶体还是变成不饱和溶液,其溶液中溶剂的质量都不变,仍是降温前各溶液中的溶剂,t2oC时甲、乙、丙三种物质的溶解度由大到小的顺序为甲、乙、丙,则饱和溶液各100g溶剂由多到少的顺序为丙、乙、甲。 6.(2019∙达州)如图所示为X、Y、Z三种固体物质(不含结晶水)的溶解度曲线,请回答下列问题: ⑴X中含有少量Y,应采用降温结晶的方法提纯X。 ⑵t2℃时,三种物质的溶解度的大小关系是Y>X=Z。 ⑶t3℃时,溶质质量分数为25%的X溶液降温到t1℃,所得溶液中溶质质量分数是 20% 。 ⑷t3℃时,等质量X、Y、Z的饱和溶液分别降温到t1℃,溶液质量没有变化的是Z 。 【解析】(1)X、Y的溶解度均随温度升高而增大,且X的溶解度受温度影响较大,Y的溶解度受温度影响较小,故当X中含有少量Y时,应采用降温结晶或冷却热饱和溶液的方法提纯X。(2)根据溶解度曲线图可知,℃时,三种物质溶解度大小关系为Y>X=Z。(3)设℃时质量分数为25%的X溶液中所含溶质的质量为a,则有,解得a≈33.3 g>X在℃时的溶解度25 g,故降温后所得溶液为℃时X的饱和溶液,溶液中溶质的质量分数为20%。(4)X、Y的溶解度随温度升高而增大,Z的溶解度随温度升高而减小,降温过程中,X、Y溶液均有晶体析出,溶液质量减小,Z溶液不会析出晶体,溶液质量不变。 7.(2019∙南充)根据下图中甲、乙、丙三种固体物质的溶解度曲线,回答下列问题。 (1)温度为 t2 ℃时,甲、乙物质的溶解度相等。 (2)甲、乙、丙三种物质中,乙 的溶解度受温度影响最小。 (3)分别将100g甲、丙的饱和溶液从t3℃降温到t1℃时, 对所得溶液的叙述正确的D (填序号) A.甲、丙都是饱和溶液 B.所含溶剂质量:甲=丙 C.溶液的质量:甲>丙 D.溶质的质量分数:甲>丙 【解析】(1)由溶解度曲线可知,t2℃时甲、乙物质的溶解度相等。(2)根据三种物质的溶解度曲线可知,甲的溶解度随温度的升高而增大,丙的溶解度是随温度的升高而减小,乙的溶解度受温度影响最小。(3)甲、丙的饱和溶液从t3℃降温到t1℃时,甲的溶解度减小,溶液中有晶体析出,溶液仍然是饱和溶液;乙的溶解度增大,溶液会变成不饱和溶液,A错误;t3℃时甲的溶解度大于丙的溶解度,100g饱和溶液中含有溶质的质量甲大于丙,含有溶剂的质量甲小于丙,降温到t1℃时溶剂的质量不变,所含溶剂质量:甲<丙,B错误;甲、丙的饱和溶液从t3℃降温到t1℃时,甲的溶解度减小,溶液中有晶体析出,溶液质量减小,乙的溶解度增大,溶液会变成不饱和溶液,溶液质量不变,所得溶液的质量:甲<丙,C错误;降温到t1℃时,甲是饱和溶液,丙是不饱和溶液,溶质的质量分数:甲>丙,D正确。 8.(2019∙呼和浩特).t2℃时,将甲,乙各80g分别放到盛有100g水的两个烧杯中,充分溶解后,恢复到t2℃,现象如图一。甲和乙的溶解度曲线如图二。请结合图示回答下列问题: (1)固体甲对应的溶解度曲线是a _ (填“a”或“b”)。 (2)M点的含义t1℃时,甲乙两物质的溶解度相等;。 (3)向烧杯①的溶液中继续加入15g甲物质,充分搅拌,发现固体先全部溶解,一段时间后又有部分固体甲析出.你认为“全部溶解”的原因是甲物质溶于水放热,温度升高,溶解度增大;。 (4)将t2℃等质量的甲、乙饱和溶液分别降温到们将t1℃时,所得溶液的有关说法正确的是abd(填字母)。 a.甲溶液仍为饱和溶液 b.两溶液质量甲<乙 c.两溶液中溶剂质量甲=乙 d.两溶液溶质质量甲>乙 【解析】(1)t2℃时,将甲、乙各80g分别放在盛有100g水的两个烧杯中,充分溶解后,恢复到t2℃,甲固体全部溶解,乙固体有剩余,所以t2℃时,甲物质的溶解度大于乙物质的溶解度,固体甲对应的溶解度曲线是a;(2)M点的含义是:t1℃时,甲、乙物质的溶解度相等;(3)向烧杯①的溶液中继续加入15g甲物质,充分搅拌,发现固体先全部溶解,一段时间后又有部分甲析出,“全部溶解”的原因是:甲物质溶于水放热,温度升高,溶解度增大;( 4)将t2℃等质量的甲、乙饱和溶液分别降温到t1℃时,乙物质会析出晶体,甲物质不会析出晶体,所以a.甲溶液仍为饱和溶液,故正确;b.两溶液质量甲<乙,故正确; c.t2℃时,甲物质的溶解度大于乙物质的溶解度,所以等质量的甲、乙饱和溶液中,甲的溶剂质量小于乙,所以降温后,两溶液中溶剂质量不相等,故错误;d.甲物质t1℃时的溶解度大于乙物质t2℃时的溶解度,所以两溶液溶质质量分数甲>乙,故正确.故选:abd. 9.(2019∙聊城)如图是a、b、c三种物质的溶解度曲线,据图回答下列问题: (1)三种物质的溶解度随着温度升高而减小的是c __。 (2)t2℃时,物质a的溶解度与物质__ b __的相等。 (3)t3℃时,把80g物质a加入到200g水中充分搅拌、静置,形成的是_不饱和 _溶液(填“饱和”或“不饱和”)。 (4)t3℃时,将等质量a和b的饱和溶液降到t1℃时,析出晶体的质量关系正确的是A(填字母序号)。 A. a>b B.a=b C.a查看更多
相关文章
- 当前文档收益归属上传用户
- 下载本文档