- 2021-04-19 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
东营市一中高考二轮复习专题训练十八 电化学原理及应用
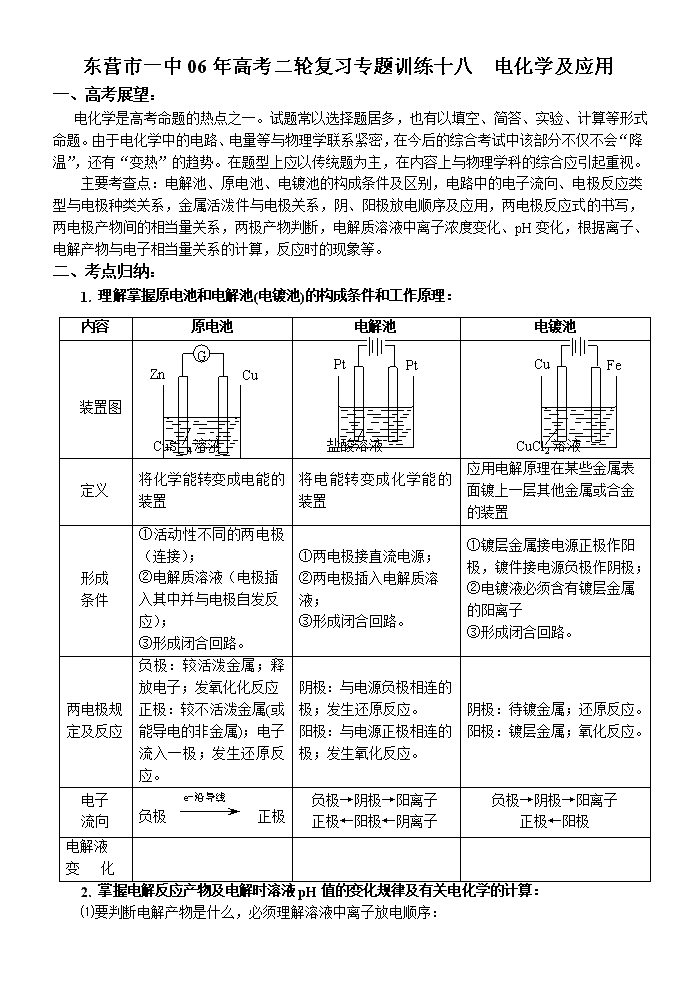
东营市一中06年高考二轮复习专题训练十八 电化学及应用 一、高考展望: 电化学是高考命题的热点之一。试题常以选择题居多,也有以填空、简答、实验、计算等形式命题。由于电化学中的电路、电量等与物理学联系紧密,在今后的综合考试中该部分不仅不会“降温”,还有“变热”的趋势。在题型上应以传统题为主,在内容上与物理学科的综合应引起重视。 主要考查点:电解池、原电池、电镀池的构成条件及区别,电路中的电子流向、电极反应类型与电极种类关系,金属活泼件与电极关系,阴、阳极放电顺序及应用,两电极反应式的书写,两电极产物间的相当量关系,两极产物判断,电解质溶液中离子浓度变化、pH变化,根据离子、电解产物与电子相当量关系的计算,反应时的现象等。 二、考点归纳: 内容 原电池 Pt Pt 电解池 Cu Fe 电镀池 装置图 G Zn Cu CuSO4溶液 盐酸溶液 CuCl2溶液 定义 将化学能转变成电能的装置 将电能转变成化学能的装置 应用电解原理在某些金属表面镀上一层其他金属或合金的装置 形成 条件 ①活动性不同的两电极(连接); ②电解质溶液(电极插入其中并与电极自发反应); ③形成闭合回路。 ①两电极接直流电源; ②两电极插入电解质溶液; ③形成闭合回路。 ①镀层金属接电源正极作阳极,镀件接电源负极作阴极; ②电镀液必须含有镀层金属的阳离子 ③形成闭合回路。 两电极规定及反应 负极:较活泼金属;释放电子;发氧化化反应 正极:较不活泼金属(或能导电的非金属);电子流入一极;发生还原反应。 阴极:与电源负极相连的 极;发生还原反应。 阳极:与电源正极相连的 极;发生氧化反应。 阴极:待镀金属;还原反应。 阳极:镀层金属;氧化反应。 电子 流向 e-沿导线 负极 正极 负极→阴极→阳离子 正极←阳极←阴离子 负极→阴极→阳离子 正极←阳极 电解液 变 化 1. 理解掌握原电池和电解池(电镀池)的构成条件和工作原理: 2. 掌握电解反应产物及电解时溶液pH值的变化规律及有关电化学的计算: ⑴要判断电解产物是什么,必须理解溶液中离子放电顺序: 阴极放电的总是溶液中的阳离子,与电极材料无关。放电顺序是: K+、Ca2+、Na+、Mg2+、Al3+、Zn2+、Fe2+(H+)、Cu2+、Hg2+、Ag+、Au3+ 放电由难到易 阳极:若是惰性电极作阳极,溶液中的阴离子放电,放电顺序是: S2-、I-、Br-、Cl-、OH-、含氧酸根离子(NO3-、SO42-、CO32-)、F- 失电子由易到难 若是非惰性电极作阳极,则是电极本身失电子。 要明确溶液中阴阳离子的放电顺序,有时还需兼顾到溶液的离子浓度。如果离子浓度相差十分悬殊的情况下,离子浓度大的有可能先放电。如理论上H+的放电能力大于Fe2+、Zn2+,但在电解浓度大的硫酸亚铁或硫酸锌溶液时,由于溶液[Fe2+]或[Zn2+]>>[H+],则先在阴极上放电的是Fe2+或Zn2+,因此,阴极上的主要产物则为Fe和Zn。但在水溶液中,Al3+、Mg2+、Na+等是不会在阴极上放电的。 ⑵电解时溶液pH值的变化规律: 电解质溶液在电解过程中,有时溶液pH值会发生变化。判断电解质溶液的pH值变化,有时可以从电解产物上去看。 ①若电解时阴极上产生H2,阳极上无O2产生,电解后溶液pH值增大; ②若阴极上无H2,阳极上产生O2,则电解后溶液pH值减小; ③若阴极上有H2,阳极上有O2,且V(H2)==2V(O2),则有三种情况:a 如果原溶液为中性溶液,则电解后pH值不变;b 如果原溶液是酸溶液,则pH值变小;c 如果原溶液为碱溶液,则pH值变大; ④若阴极上无H2,阳极上无O2产生,电解后溶液的pH可能也会发生变化。如电解CuCl2溶液(CuCl2溶液由于Cu2+水解显酸性),一旦CuCl2全部电解完,pH值会变大,成中性溶液。 ⑶进行有关电化学计算,如计算电极析出产物的质量或质量比,溶液pH值或推断金属原子量等时,一定要紧紧抓住阴阳极或正负极等电极反应中得失电子数相等这一规律。 3. 理解金属腐蚀的本质及不同情况,了解用电化学原理在实际生活生产中的应用: ⑴金属的腐蚀和防护: ①金属腐蚀的实质是铁等金属原子失去电子而被氧化成金属阳离子的过程,可分为化学腐蚀和电化学腐蚀。金属与氧化剂(一般非电解质)接触,直接发生化学反应引起的腐蚀叫化学腐蚀,如铁与氯气接触发生的腐蚀为化学腐蚀。而更普遍存在的,危害也更为严重的是电化学腐蚀,即不纯的金属或合金与电解质溶液发生原电池反应引起的腐蚀。如钢铁在水膜酸性较强条件下发生析氢腐蚀Fe-2e-=Fe2+,2H++2e-==H2↑;在水膜酸性很弱或中性条件下,则发生吸氧腐蚀: 2Fe-4e-=2Fe2+,2H2O+O2+4e-==4OH-。 ②金属的防护方法: a、改变金属的内部结构;b、覆盖保护层;c、使用电化学保护法 ⑵原电池原理的应用: ①制作多种化学电源,如干电池、蓄电池、高能电池、燃料电池; ②加快化学反应速率。如纯锌与盐酸反应制H2反应速率较慢,若滴入几滴CuCl2溶液,使置换出来的铜紧密附在锌表面,形成许多微小的原电池,可大大加快化学反应; ③金属的电化学保护,牺牲阳极的阴极保护法; ④金属活动性的判断。 ⑶电解原理的应用: ①制取物质:例如用电解饱和食盐水溶液可制取氢气、氯气和烧碱。 ②电镀:应用电解原理,在某些金属或非金属表面镀上一薄层其它金属或合金的过程。电镀时,镀件作阴极,镀层金属作阳极,选择含有镀层金属阳离子的盐溶液为电解质溶液。电镀过程中该金属阳离子浓度不变。 ③精炼铜:以精铜作阴极,粗铜作阳极,以硫酸铜为电解质溶液,阳极粗铜溶解,阴极 析出铜,溶液中Cu2+浓度减小 ④电冶活泼金属:电解熔融状态的Al2O3、MgCl2、NaCl可得到金属单质。 东营市一中2005-2006年高考二轮专题复习 电化学及应用 一、选择题: 1. 某溶液中含有两种溶质——氯化钠和硫酸,它们的物质的量之比为3:1。用石墨做电极电解溶液时,根据反应产物,电解可明显分为三个阶段,测下列叙述中不正确的是 ( ) A. 阴极只析出氢气 B. 阳极先析出氯气后析出氧气 C. 电解最后阶段为电解水 D. 电解过程中溶液的pH值不断增大,最后pH值为7 2. 实验室用铅蓄电池作电源电解饱和食盐水制氯气。已知铅蓄电池放电时发生如下反应: 负极:Pb+SO42--2e-==PbSO4 正极:PbO2+4H++SO42-+2e-==PbSO4+2H2O 今若制得Cl2 0.05mol,这时电池内消耗的H2SO4的物质的量至少是 ( ) A. 0.025mol B. 0.05mol C. 0.1mol D. 0.2mol 3. 把a、b、c、d4种金属浸泡在稀H2SO4中,用导线两两相连可构成各种原电池。若a、b相连时,a为负极;c、d相连时,c为负极;a、c相连时,c为正极;b、d相连时,b为正极。 那么这4种金属的活动性顺序为 ( ) A. a>b>c>d B. a>c>d>b C. c>a>b>d D. b>d>c>a 4. 用惰性电极电解下列物质的溶液,经过一段时间,溶液的物质的量浓度增大,pH减小的是( ) A. NaCl B. CuSO4 C. H2SO4 D. Na2SO4 5. 为保护地下钢管不受腐蚀,可采用的方法是 ( ) A. 将它与直流电源的负极相连接 B. 将它与交流电源相连接 C. 将它与Cu板相连接 D. 将它与Zn板相连接 6. 某原电池总反应离子方程式:2Fe3++Fe=3Fe2+,不能实现该反应的原电池是 ( ) A. 正极为Cu,负极为Fe,电解质溶液FeCl3 B. 正极为C,负极为Fe,电解质溶液Fe(NO3)3 C. 正极为Fe,负极为Zn,电解质溶液Fe2(SO4)3 D. 正极为Ag,负极为Fe,电解质溶液CuSO4 7. 100mL浓度为2mol/L的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的量,可采用的方法是 ( ) A. 加入适量的6mol/L的盐酸 B. 加入数滴氯化铜溶液 C. 加入适量蒸馏水 D. 加入适量的氯化钠溶液 8. 用两支惰性电极插入500mL AgNO3溶液中,通电电解。当电解液的pH值从6.0变为3.0 时(设电解阴极没有氢气析出,且电解液在电解前后体积变化可以忽略),则电极上析出的银的质量大约为 ( ) A. 27mg B. 54mg C. 108mg D. 216mg 9. X、Y、Z、M代表四种金属元素。金属X和Z用导线连接放入稀硫酸中时,Z极上有H2放出;若电解Y2+和Z2+共存的溶液时,Y先析出;又知M2+的氧化性强于Y2+。则这四种金属的活动性由强到弱的顺序为 ( ) A. X>Z>Y>M B. X>Y>Z>M C. M>Z>X>Y D. X>Z>M>Y 放电 充电 10. 钠硫电池是一种高能电池,它是以熔融的钠硫为两极,以可导电的固体作电解质,反应方程式为:2Na+xS Na2Sx,则以下说法正确的是( ) A. 放电时钠作负极,硫作正极 B. 放电时钠极发生还原反应 C. 充电时钠极与外电源的正极相连,硫与外电源的负极相连 D. 充电时,阴极发生的反应为:Sx2--2e-=xS 11. 用质量均为100g的铜作电极,电解AgNO3溶液,电解一段时间后,两极质量相差28g,此时阳极质量为 ( ) A. 121.6g B. 86g C. 93.6g D. 89.6g 0 时间 时间 0 7 7 pH pH 12. 用石墨电极电解AlCl3溶液时,下图所示的电解液变化曲线合理的是 ( ) 时间JIAN 间间 0 时间 0 沉淀量 A B C D 13. 用惰性电极电解下列溶液,一段时间后,再加入一定质量的另一种物质(中括号内),溶液能与原来溶液完全一样的是( ) A. CuCl2 [CuSO4] B. NaOH [NaOH] C. NaCl [HCl] D. CuSO4 [Cu(OH)2] 14. 以Pt作电极,用电源串联电解分别装在两个烧杯里的200mL 0.3mL/L NaCl溶液和300mL 0.1mol/L的AgNO3溶液,过一段时间取出电极,将两杯溶液混合,则对混合液的pH值判断正确的是 ( ) A. 小于7 B. 大于7 C. 等于7 D. 大于等于7 15.(05广东)一种新燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。下列对该燃料说法正确的是( ) A. 在熔融电解质中,O2-由负极移向正极 B. 电池的总反应是:2C4H10 + 13O2 → 8CO2 + 10H2O C. 通入空气的一极是正极,电极反应为:O2 + 4e- = 2O2- D. 通入丁烷的一极是正极,电极反应为:C4H10 + 26e- + 13O2 = 4CO2 + 5H2O 16.(05全国卷I)关于电解NaCl水溶液,下列叙述正确的是 ( ) A.电解时在阳极得到氯气,在阴极得到金属钠 B.若在阳极附近的溶液中滴入KI试液,溶液呈棕色 C.若在阴极附近的溶液中滴入酚酞试液,溶液呈无色 D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性 17.(05广东)下列于化学有关的叙述正确的是 ( ) A. 铜锌原电池中,铜为负极 B. 0.1molN2与0.3molH2在一定条件下反应达到平衡时,生成0.2molNH3。 C. 1mol/LAlCl3溶液中,铝离子物质的量浓度为1mol/L。 D. 18gH2O中含1mol氧原子 18.(05江苏)高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为 : 放电 充电 3Zn + 2K2FeO4 + 8H2O 3Zn(OH)2 + 2Fe(OH)3 + 4KOH 下列叙述不正确的是( ) A.放电时负极反应为:Zn—2e— +2OH—= Zn(OH)2 B.充电时阳极反应为:Fe(OH)3 —3e— + 5 OH— = FeO + 4H2O C.放电时每转移3 mol电子,正极有1mol K2FeO4被氧化 D.放电时正极附近溶液的碱性增强 19. (05上海)关于如右图所示装置的叙述,正确的是( ) A. 铜是阳极,铜片上有气泡产生 B. 铜片质量逐渐减少 C. 电流从锌片经导线流向铜片 D. 氢离子在铜片表面被还原 20.(05天津)金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+ ( ) A.阳极发生还原反应,其电极反应式:Ni2+ + 2e— == Ni B.电解过程中,阳极质量的减少与阴极质量的增加相等 C.电解后,溶液中存在的金属阳离子只有Fe2+ 和Zn2+ D.电解后,电解槽底部的阳极泥中只有Cu和Pt 21. 氢镍电池是近年开发出来的可充电电池,它可以取代会产生镉污染的镉镍电池。 放电 充 电 氢镍电池的总反应式是1/2H2+NiO(OH) Ni(OH)2。根据此反应式判断,下列叙述正确的是 A. 电池放电时,电池负极周围溶液的pH不断增大 B. 电池放电时,镍元素被氧化 C. 电池充电时,氢元素被还原 D. 电池充电时,阴极反应为Ni(OH)2+OH--e-===NiO(OH)+H2O 22. 将分别盛有熔融的氯化钾、氯化镁、氧化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钾、镁、铝的物质的量之比为( ) A. 1∶2∶3 B. 3∶2∶1 C. 6∶3∶1 D. 6∶3∶2 23. 以下现象与电化学腐蚀无关的是( ) A. 黄铜(铜锌合金)制作的铜锣不易产生铜绿 B. 生铁比软铁心(几乎是纯铁)容易生锈 C. 铁质器件附有铜质配件,在接触处易生铁锈 D. 银质奖牌长期放置后,奖牌的表面变暗 24.(03上海)右图是电解CuCl2溶液的装置,其中c、d为石墨电极,则下列有关判断正确的是( ) A. a为负极,b为正极 B. a为阳极,b为阴极 C. 电解过程中,d电极质量增加 D. 电解过程中,氯离子浓度不变 25. (00全国卷)下列关于实验现象的描述不正确的是( ) A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡 B.用锌片做阳极,铁片做阴极,电解氯化锌溶液,铁片表面出现一层锌 C.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁 D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快 26. 为研究金属腐蚀的条件和速率,某课外小组学生用金属丝将三根大小相同的铁钉分别固定在图示的三个装置,再放在玻璃钟罩里保存相同的一段时间,下列对实验结束时现象的描述不正确的是( ) A.装置Ⅰ左侧的液面一定会下降 B.左侧液面装置Ⅰ比装置Ⅱ的低 C.装置Ⅱ中的铁钉腐蚀最严重 D.装置Ⅲ中的铁钉几乎没被腐蚀 27. 大雪后使用融雪盐清除道路积雪,过去常用以氯化钠等无机盐,降低冰雪的冰点,而现在往往用环保型有机盐与缓蚀剂,但它们的融雪原理相同。下列叙述不正确的是 ( ) A.环保型有机盐与缓蚀剂的融雪原理为盐溶于水后,使冰雪的冰点降低 B.使用环保型融雪盐可以减缓对路面和桥梁中钢筋的腐蚀 C.使用环保型融雪盐可以减少对植物的危害 D.使用环保型融雪盐主要是给植物补充养分 100mL CuSO4溶液 ① Pt Pt 200mL 0.005molH2SO4溶液 ② Zn Zn 200mL CuCl2溶液 ③ C C 200mL NaCl饱和溶液 ④ Fe C 28.如图所示,图中四种装置工作一段时间后,测得导线上均通过了0.002mol电子,此时溶液的pH由小到大的排列顺序为(不考虑溶液的水解和溶液的体积变化)( ) A.①<②<③<④ B.②<①<③<④ C.②<①<④<③ D.①<②<④<③ 29.右图中x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无臭气体放出,符合这一情况的是 ( ) a极板 b极板 x电极 Z溶液 A 锌 石墨 负极 CuSO4 B 石墨 石墨 负极 NaOH C 银 铁 正极 AgNO3 D 铜 石墨 负极 CuCl2 30. 随着人们生活质量的不断提高,废电池必须进行集中处理的问题被提到议事日程,其首要原因是( ) A. 利用电池外壳的金属材料 B. 不使电池中渗泄的电解液腐蚀其他物品 C. 回收其中石墨电极 D. 防止电池中汞、镉和铅等重金属离子对土壤和水源的污染 31. 在外界提供相同电量的条件,Cu2+或Ag+分别按Cu2++2e-→Cu或Ag++e-→Ag在电极上放电,基析出铜的质量为1.92g,则析出银的质量为( ) A. 1.62g B. 6.48g C. 3.24g D. 12.96g 32. 用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入0.1mol Cu(OH)2后恰好恢复到电解前的浓度和PH。则电解过程中转移的电子数为( ) A. 0.1mol B. 0.2mol C. 0.3mol D. 0.4mol 33. 氨基乙酸在水溶液中存在如下平衡: CH2COO-+H3O+ CH2COOH+H2O CH2COOH+OH- NH2 NH2 NH3+ 若以Pt为电极,以强酸溶液或以强碱溶液为介质中电解氨基乙酸溶液,均能在电极上析出氨基乙酸,则析出的电极分别为( ) A.阳极、阴极 B. 阴极、阳极 C. 均在阴极 D. 均在阳极 34. 将Al片和Cu片用导线联接,一组插入浓硝酸中,一组插入稀氢氧化钠溶液中,分别形成的原电池。在这两个原电池中,负极分别为( ) A.Al片、Cu片 B.Cu片、Al片 C.Al片、Al片 D.Cu片、Cu片 35.CuI是一种不溶于水的白色固体。它可由反应:2 Cu2+ + 4I- == 2CuI+I2而得到,现以石墨为阴极,以铜为阳极电解KI溶液,通电前向电解质溶液中加入少量酚酞和淀粉溶液。电解开始不久阴极区溶液呈红色,而阳极区呈蓝色,对这个现象的正确解释是( ) A. 阴极电极反应:2H++2e-== H2↑,使C(OH-)> C(H+) B.阳极:2Cu+4I--4e-== 2CuI↓+ I2, I2使淀粉变蓝 C.阳极:Cu-2e-== Cu2+, Cu2+显蓝色 D.阳极:2I-+2e-== I2,碘遇淀粉变蓝 36.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌一锰碱性电池以氢 氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+ H2O(l)=Zn(OH)2(s)+Mn2O3(s)下列说 法正确的是( ) A.电池工作时,锌为正极 B.电池负极的电极反应式为:2MnO2(s)+ H2O(l)+2e-= Mn2O3(s)+2OH-(aq) C.电池工作时,电子由负极通过外电路流向正极 D.外电路中每通过0.1mol电子,锌的质量理论上减小6.5g 37.将羧酸的碱金属盐电解可生成烃类化合物,例如2CH3COOK+2H2O===CH3-CH3↑+2CO2↑+H2↑+2KOH。现充分电解ClCH2—COOK水溶液,并加热电解后的水溶液,则下列说法中合理的是( ) A.CO2气体在阴极放出 B.加热后有不溶于水的油状物生成 C.混合液蒸干后得到的固体物质是KOH D.混合液蒸干后得到的固体物质是KCl 38.图乙是根据图甲的电解池进行电解时某个量(纵坐标x)随时间变化的函数曲线(各电解池都 用石墨作电极,不考虑电解过程中溶液浓度变化对电极反应的影响),这个量x是表示( ) 甲 乙 A.各电池析出气体体积总数的变化 B.各电解池阳极质量的增加 C.各电解池阴极质量的增加 D.各电极上放电的离子总数的变化 39.按右图装置实验,若x轴表示流入阴极的电子的物质的量,则y轴可表示( ) ①c(Ag+) ②c(NO3-) ③a棒的质量 ④b棒的质量 ⑤ 溶液的pH A.①③ B.③④ C.①②④ D.①②⑤- 40.如图:X为单质硅,Y为金属铁,a为NaOH溶液,按图组装一个原电池,下列说法正确的是:( ) A.X为负极,电极反应为:Si—4e-==Si4+ B.X为正极,电极反应为:4H2O+4e-==4OH-+2H2↑ C.X为负极,电极反应为:Si+6OH-—4e-==SiO32-+3H2O D.Y为负极,电极反应为:Fe—2e-==Fe2+ 41.某装置中发生如下反应:Cu+2H2O Cu(OH)2+H2↑,关于该装置下列说法不正确的是( ) A.该装置一定为电解池 B.该装置一定为原电池 C.金属铜为电解池的阳极 D.电解质溶液可能是硫酸钠溶液 + - 好漂亮的 彩虹! Pt Pt 42. 以Li2CO3和Na2CO3熔融物为电解质,一极通入CO,另一极通入CO2和O2,组成燃料电池。则下列说法中,正确的是( ) A. 正极反应为:O2+2CO2+4e-→2CO32- B. 负极反应为:CO+4OH--2e-→CO32-+2H2O C. 正极反应为:O2+4e→2O2- D. 负极反应为:CO+CO32--2e-→2CO2 43. 如右图所示,在一U型管中装入含有紫色石蕊的Na2SO4试液,通直流电,一段时间后U型管内会形成一个倒立的三色 “彩虹”,从左到右颜色的次序是( ) A.蓝、紫、红 B.红、蓝、紫 C.红、紫、蓝 D.紫、红、蓝 44. 如图是2004年批量生产的笔记本电脑所用甲醇燃料电池的结构示意图。甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为2CH3OH+3O2—→2CO2+4H2O。下列说法正确的是( ) A.左电极为电池的负极,a处通入的物质是甲醇 B.右电极为电池的负极,b处通人的物质的空气 C.负极反应式为:CH3OH+H2O-6e →CO2十6H+ D.正极反应式为:O2+2H2O十4e-→4OH- 1.D 2.C 3.B 4.C 5.AD 6.CD 7.B 8.B 9.A 10.A 11.C 12.AD 13.C 14.D 15.BC 16.B 17.D 18.C 19.D 20.D 21.C 22.D 23.D 24.BC 25.C 26.B 27.D 28.A 29.A 30.D 31.C 32.D 33.B 34.B 35.AB 36.C 37.D 38.C 39.D 40.C 41.B 42.AD 43.C 44.AC查看更多