- 2021-04-17 发布 |
- 37.5 KB |
- 12页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
化学(选修)卷·2019届江苏省海安高级中学高二上学期中期考试(2017
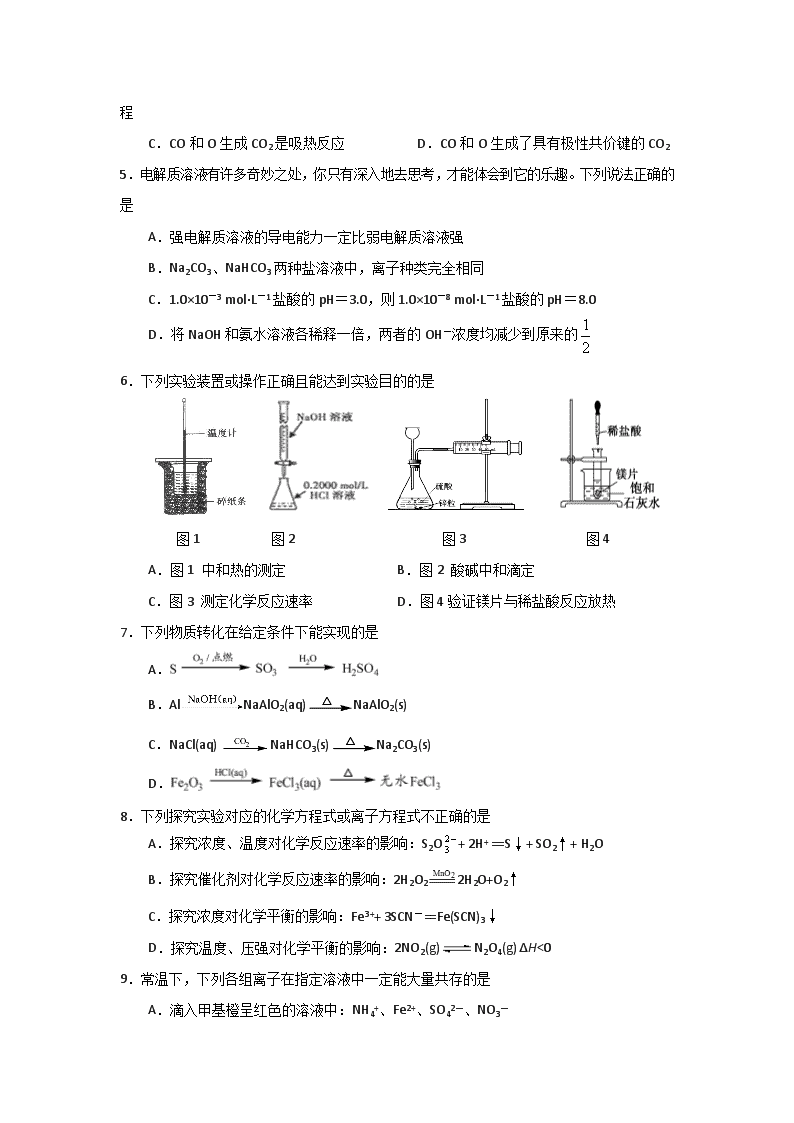
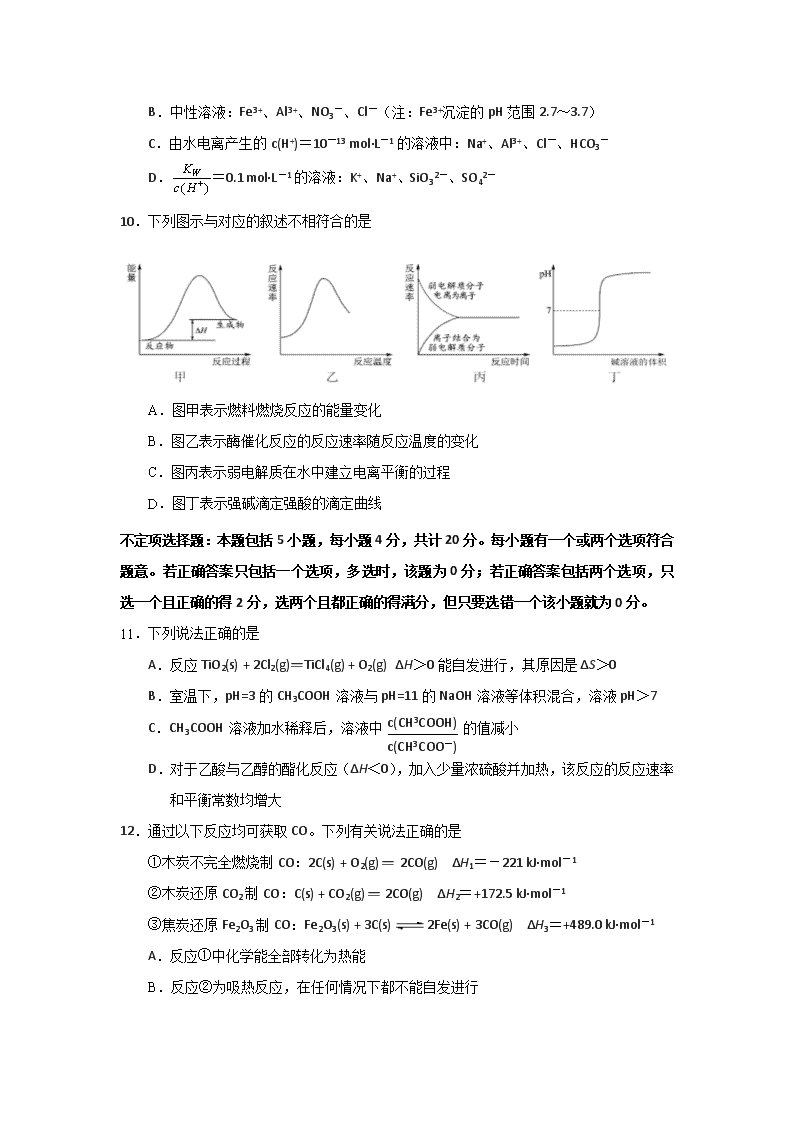
江苏省海安高级中学2017-2018学年度第一学期期中考试 高二化学(选修)试卷 注意事项: 1.本试卷包括第Ⅰ卷选择题和第Ⅱ卷非选择题两部分。满分120分,考试时间100分钟。 2.作答选择题,必须用2B铅笔把答题卡上对应选项的方框涂满涂黑;作答非选择题,必须用书写黑色字迹的0.5毫米签字笔写在答题卡上的指定位置,在其它位置作答一律无效。交卷时只交答题卡。 3.可能用到的相对原子质量:H 1 C 12 O 16 Na 23 S 32 Cl 35.5 Cu 64 Ag 108 第Ⅰ卷(选择题,共40分) 单项选择题:本题包括10小题,每小题2分,共计20分。每小题只有一个选项符合题意。 1.2017年5月18日,我国首次海域可燃冰试采成功。下列有关“可燃冰”的说法正确的是 A.可燃冰是一种可再生的新能源 B.用可燃冰做燃料会大大减弱温室效应 C.在海底和冻土层可能存在可燃冰 D.可燃冰实质是水变成的固态油 2.下列方程式中,属于水解反应的是 A.H2O+H2OH3O++OH- B.CO32-+H2OHCO3-+OH- C.CO2+H2OH2CO3 D.HCO3-+H2OH3O++CO32- 3.下列有关物质的性质与应用不相对应的是 A.氯化铝是一种电解质,可用于电解法制铝 B.明矾能水解生成Al(OH)3胶体,可用作净水剂 C.液氨汽化时要吸收大量的热,可用作制冷剂 D.碳酸钠水解呈碱性,可用热的纯碱溶液除去金属器件表面的油污 4.最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下: 下列说法正确的是 A.在该过程中,CO断键形成C和O B.状态Ⅰ→状态Ⅲ表示CO与O2 反应的过程 C.CO和O生成CO2是吸热反应 D.CO和O生成了具有极性共价键的CO2 5.电解质溶液有许多奇妙之处,你只有深入地去思考,才能体会到它的乐趣。下列说法正确的是 A.强电解质溶液的导电能力一定比弱电解质溶液强 B.Na2CO3、NaHCO3两种盐溶液中,离子种类完全相同 C.1.0×10-3 mol·L-1盐酸的pH=3.0,则1.0×10-8 mol·L-1盐酸的pH=8.0 D.将NaOH和氨水溶液各稀释一倍,两者的OH-浓度均减少到原来的 6.下列实验装置或操作正确且能达到实验目的的是 图1 图2 图3 图4 A.图1 中和热的测定 B.图2 酸碱中和滴定 C.图3 测定化学反应速率 D.图4验证镁片与稀盐酸反应放热 7.下列物质转化在给定条件下能实现的是 A. B.AlNaAlO2(aq)NaAlO2(s) C.NaCl(aq)NaHCO3(s)Na2CO3(s) D. 8.下列探究实验对应的化学方程式或离子方程式不正确的是 A.探究浓度、温度对化学反应速率的影响:S2O+ 2H+ == S↓+ SO2↑+ H2O B.探究催化剂对化学反应速率的影响:2H2O22H 2O+O2↑ C.探究浓度对化学平衡的影响:Fe3++ 3SCN-== Fe(SCN)3↓ D.探究温度、压强对化学平衡的影响:2NO2(g)N2O4(g) ΔH<0 9.常温下,下列各组离子在指定溶液中一定能大量共存的是 A.滴入甲基橙呈红色的溶液中:NH4+、Fe2+、SO42—、NO3— B.中性溶液:Fe3+、Al3+、NO3-、Cl-(注:Fe3+沉淀的pH范围2.7~3.7) C.由水电离产生的c(H+)=10-13 mol·L-1的溶液中:Na+、Al3+、Cl-、HCO3- D.=0.1 mol·L-1的溶液:K+、Na+、SiO32-、SO42- 10.下列图示与对应的叙述不相符合的是 A.图甲表示燃料燃烧反应的能量变化 B.图乙表示酶催化反应的反应速率随反应温度的变化 C.图丙表示弱电解质在水中建立电离平衡的过程 D.图丁表示强碱滴定强酸的滴定曲线 不定项选择题:本题包括5小题,每小题4分,共计20分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个该小题就为0分。 11.下列说法正确的是 A.反应TiO2(s) + 2Cl2(g)=TiCl4(g) + O2(g) ΔH>0能自发进行,其原因是ΔS>0 B.室温下,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,溶液pH>7 C.CH3COOH溶液加水稀释后,溶液中 的值减小 D.对于乙酸与乙醇的酯化反应(ΔH<0),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大 12.通过以下反应均可获取CO。下列有关说法正确的是 ①木炭不完全燃烧制CO:2C(s) + O2(g) = 2CO(g) ΔH1=-221 kJ·mol-1 ②木炭还原CO2制CO:C(s) + CO2(g) = 2CO(g) ΔH2=+172.5 kJ·mol-1 ③焦炭还原Fe2O3制CO:Fe2O3(s) + 3C(s)2Fe(s) + 3CO(g) ΔH3=+489.0 kJ·mol-1 A.反应①中化学能全部转化为热能 B.反应②为吸热反应,在任何情况下都不能自发进行 C.反应③中使用催化剂或移走部分CO,均可提高Fe2O3的转化率 D.反应Fe2O3(s) + 3CO(g)=2Fe(s) + 3CO2(g) ΔH=-28.5 kJ·mol-1 13.根据下列实验操作和现象所得到的结论正确的是 选项 实验操作和现象 结论 A 向醋酸中加入氢氧化钠溶液,无明显现象。 二者之间未发生反应 B 在0.1 mol·L-1Na2CO3溶液中,加2滴酚酞显浅红色,微热,红色加深。 盐类水解是吸热反应 C 等体积、pH=3的两种酸HA和HB分别与足量的Zn反应,酸HA放出的氢气多。 酸性A比B强 D 室温下,用pH试纸测得:0.1mol·L-1 Na2SO3溶液的 pH约为10;0.1mol·L-1 NaHSO3溶液的pH约为5。 HSO3-结合H+的能力比 SO32-的弱[] 14.下列溶液中微粒的物质的量浓度关系正确的是 A.pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+)+c(M+)=c(OH-)+c(A-) B.在0.1 mol·L-1Na2CO3溶液中:2 c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) C.在pH=8.37的NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) D.pH相同的三种溶液 ①NH4Cl、②(NH4)2SO4、③NH4HSO4中,c(NH4+)的大小关系是:①=②>③ 15.一定温度下,在三个容积均为2.0 L的恒容密闭容器中发生反应: 2NO(g)+2CO(g)N2(g)+2CO2(g)[] 各容器中起始物质的量与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随时间变化关系如右图所示。下列说法正确的是 容器 温度/℃ 起始物质的量/mol NO (g) CO (g) 甲 T1 0.20 0.20 乙 T1 0.30 0.30 丙 T2 0.20 0.20 A.该反应的正反应为吸热反应 B.达到平衡时,乙中CO2的体积分数比甲中的小 C.T1℃时,若起始时向甲中充入0.40 mol NO、0.40mol CO、0.40mol N2和0.40mol CO2 ,则反应达到新平衡前v(正)<v(逆) D.T2℃时,若起始时向丙中充入0.06mol N2和0.12 mol CO2,则达平衡时N2的转化率大于40% 第Ⅱ卷(非选择题,共80分) 16.(12分)活性氧化锌(ZnO)是一种面向21世纪的新型高功能精细无机产品。某校化学兴趣小组的同学参观了某厂用粗ZnO制备活性ZnO的流程,并回收铜以及副产品硫酸铵。 查阅资料: ①粗ZnO中常含有杂质FeO、CuO。 ②反应2温度控制在30℃左右,制得碱式碳酸锌[ZnCO3·2Zn(OH)2·H2O],碱式碳酸锌经焙烧可制得活性ZnO。 ③几种氢氧化物沉淀时的pH如下表: 物质 Fe(OH)2 Fe(OH)3 Zn(OH)2 Cu(OH)2 开始沉淀时pH 6.8 1.9 6.2 5.2 完全沉淀时pH 8.3 3.2 8.0[] 6.4 请回答下列问题: (1)提高粗ZnO酸浸速率的方法是 ▲ 。 (2)写出“反应1”的化学方程式 ▲ 。 (3)调节pH的范围是 ▲ 。 (4)写出“反应2”的离子方程式 ▲ 。 (5)反应2温度控制在30℃左右的可能原因是 ▲ 。 (6)补充完整由滤液D制备硫酸铵晶体的实验步骤: ▲ 、过滤、用冰水洗涤、干燥。 17.(15分)在一个2L的密闭容器中投入反应物,发生反应2SO3(g)2SO2(g) + O2(g) ΔH>0,其中SO3的变化如图所示: (1)写出该反应的平衡常数表达式K= ▲ 。 (2)用O2表示0~8min内该反应的平均速率v(O2)= ▲ 。 (3)8min时反应达平衡状态,下列能说明该反应已达到平衡状态的是 ▲ (填序号)。 A.n(SO3)∶n(SO2)∶n(O2)=2∶2∶1 B.容器内压强保持不变 C.v(SO2)逆=2v(O2)正 D.容器内密度保持不变 (4)升高温度,该反应的K值将 ▲ (填“增大”、“减小”或“不变”)。 (5)在第12min时,容器压缩到1L,则SO3的变化曲线为 ▲ (填a、b、c或d)。 (6)若保持容积不变,在第12min时加入SO3(g),则平衡向 ▲ (填“正”或“逆”)反应方向移动,SO3的体积分数 ▲ (填“增大”或“减小”)。 18.(12分)碱式氯化铜是重要的无机杀菌剂。 (1)碱式氯化铜有多种制备方法 ①方法1:45 ~ 50℃时,向CuCl悬浊液中持续通入空气得到Cu2(OH)2Cl2·3H2O,该反应的化学方程式为 ▲ 。 ②方法2:先制得CuCl2,再与石灰乳反应生成碱式氯化铜。Cu与稀盐酸在持续通入空气的条件下反应生成CuCl2,Fe3+对该反应有催化作用,其催化原理如图所示。M'的化学式为 ▲ 。 (2)碱式氯化铜有多种组成,可表示为Cua(OH)bClc·xH2O。为测定某碱式氯化铜的组成,进行下列实验: ①称取样品1.1160 g,用少量稀HNO3溶解后配成100.00 mL溶液A; ②取25.00 mL溶液A,加入足量AgNO3溶液,得AgCl 0.1722 g; ③另取25.00 mL溶液A,调节pH 4 ~ 5,用浓度为0.08000 mol·L−1的EDTA(Na2H2Y·2H2O)标准溶液滴定Cu2+ (离子方程式为Cu2++ H2Y2−=CuY2−+2H+),滴定至终点,消耗标准溶液30.00 mL。通过计算确定该样品的化学式。(写出计算过程) 19.(15分)我国国家标准(GB2760﹣2011)规定葡萄酒中SO2最大使用量为0.25g·L-1。某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定。 (1)仪器A的名称是 ▲ ,水通入A的进口为 ▲ 。 (2)B中加入300.00mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为 ▲ 。 (3)除去C中过量的H2O2,然后用0.0900mol·L-1NaOH标准溶液进行滴定,滴定前排气泡时,应选择图2中的 ▲ ;若滴定终点时溶液的pH=8.8,则选择的指示剂为 ▲ 。 (4)滴定至终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2含量为 ▲ g·L-1。 (5)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施 ▲ 。 20.(14分)草酸(H2C2O4)及其盐广泛用于医药、印染、塑料等工业。 (1)已知25℃时,几种常见弱酸的电离常数Ka如下表: 弱电解质 H2C2O4 CH3COOH HCN H2CO3 电离常数Ka K1=5.6×10-2 K2=5.4×10-3 K=1.7×10-5 K=6.2×10-10 K1=4.2×10-7 K2=5.6×10-11 ①写出草酸的电离方程式 ▲ 。 ②25℃时,浓度均为0.1mol·L-1的a. Na2C2O4、b. CH3COONa、c. NaCN、d. Na2CO3溶液的pH由大到小的顺序是 ▲ 。(填序号) ③Na2C2O4溶液中,c(Na+)/c(C2O42—)>2,原因是 ▲ (用离子方程式表示)。 (2)草酸在水中的存在形态有H2C2O4、HC2O4—、C2O42—,各形态的分布系数(浓度分数)α随溶液pH变化的关系如图所示。 ①图中曲线2表示 ▲ 的分布系数变化。 ②常温下,向10 mL 0.1 mol/L H2C2O4溶液中滴加0.1 mol/L NaOH溶液,随着NaOH溶液体积的增加,当溶液中c(Na+)=2c(C2O42—)+c(HC2O4—)时,溶液显 ▲ 性(填“酸”、“碱”或“中”),且V(NaOH) ▲ 10 mL(填“>”、“=”或“<”)。 ③下列关于0.1 mol·L-1NaHC2O4溶液的说法正确的是 ▲ (填序号)。 a.HC2O4—的电离程度大于水解程度,溶液显酸性 b.HC2O4—的水解程度大于电离程度程度,溶液显碱性[] c.溶液中c(Na+) + c(H+)=c(HC2O4—) + c(OH—) + c(C2O42—) d.溶液中c(H+)=c(OH—) + c(C2O42﹣)-c(H2C2O4) 21.(12分)化学反应与能量有着密不可分的关系,回答下列问题: (1)下列ΔH表示物质燃烧热的是 ▲ ;表示物质中和热的是 ▲ 。(填“ΔH1”、“ΔH2”和“ΔH3”等) ①2H2(g) + O2(g) = 2H2O(l) ΔH1 ②C(s) + 1/2O2(g) = CO(g) ΔH2 ③C(s) + O2(g) = CO2(g) ΔH3 ④CH4(g) + 2O2(g) = CO2(g) + 2H2O(g) ΔH4[] ⑤C6H12O6(s) + 6O2(g) = 6CO2(g) + 6H2O(l) ΔH5 ⑥NaOH(aq) + HCl(aq) = NaCl(aq) + H2O(l) ΔH6 ⑦2NaOH(aq) + H2SO4(aq) = Na2SO4(aq) + 2H2O(aq) ΔH7 (2)已知:C(s,金刚石) + O2(g) = CO2(g) ΔH=-395.41 kJ·mol-1 C(s,石墨) + O2(g) = CO2(g) ΔH=-393.51 kJ·mol-1 ①金刚石转化为石墨的热化学方程式为C(s,金刚石) = C(s,石墨) ΔH= ▲ kJ·mol-1 ②根据上述热化学方程式判断,更稳定的碳的同素异形体是 ▲ 。 (3)化学反应的能量变化(ΔH)与反应物和生成物的键能有关。键能可简单的理解为断开1 mol 化学键时所吸收的能量。下表是部分化学键的键能数据: 化学键 P-P P-O O=O P=O 键能/kJ•mol﹣1 197 360 499 X 已知白磷(P4)的燃烧热为2378.0kJ/mol,白磷完全燃烧的固体产物(P4O10)的结构如图所示,则白磷燃烧的热化学方程式为 ▲ ;上表中X= ▲ 。查看更多