- 2021-04-17 发布 |
- 37.5 KB |
- 7页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018届高考二轮复习人教版排查补漏提高专题12硅氯学案30(全国通用)
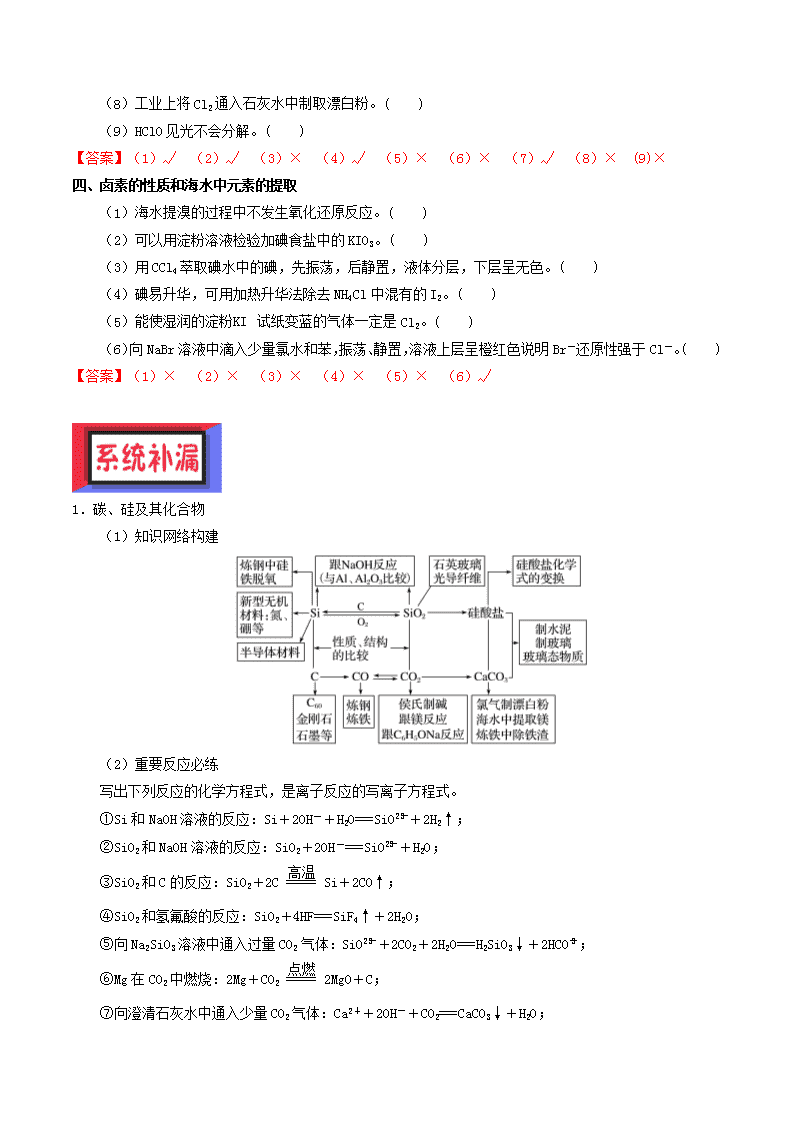
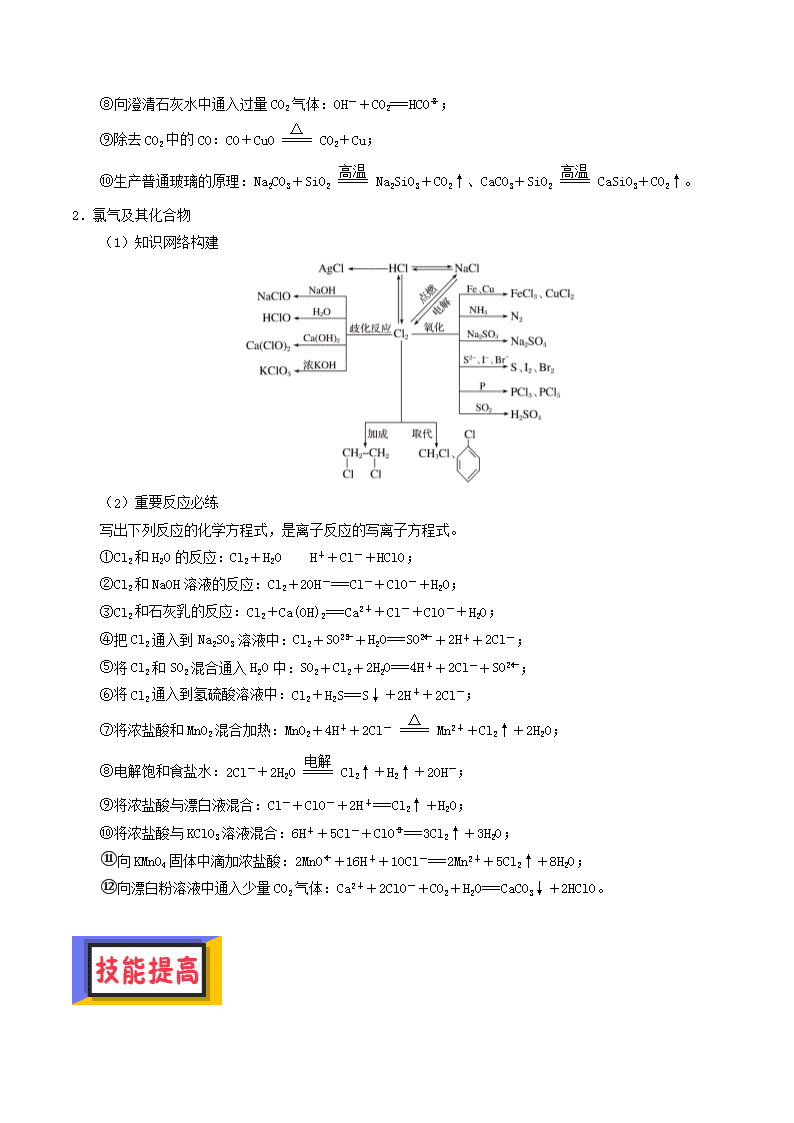
专题12 硅、氯 一、碳、硅单质及其重要化合物的性质 (1)用活性炭去除冰箱中的异味,没有发生化学反应。( ) (2)12C、13C、14C是碳的三种同素异形体。( ) (3)单质硅是将太阳能转变为电能的常用材料。( ) (4)SiO2既能和NaOH溶液反应又能和氢氟酸反应,所以是两性氧化物。 ( ) (5)元素C的单质只存在金刚石和石墨两种同素异形体。 ( ) (6)工业上用焦炭和石英制取粗硅反应的化学方程式为SiO2+CSi+CO2↑。( ) (7)可用磨口玻璃瓶保存NaOH溶液。 ( ) (8)硬度:晶体硅<金刚石。 ( ) 【答案】(1)√ (2)× (3)√ (4)× (5)× (6)× (7)× (8)√ 二、硅酸盐及无机非金属材料 (1)烧结黏土制陶瓷不涉及化学变化。( ) (2)向一定浓度的Na2SiO3溶液中通入适量CO2出现白色沉淀,证明H2CO3的酸性比H2SiO3的酸性强。( ) (3)依据Na2CO3+SiO2Na2SiO3+CO2↑,说明H2SiO3的酸性比H2CO3强。( ) (4)传统无机非金属材料是指玻璃、水泥、陶瓷等硅酸盐材料。( ) (5)合成纤维和光导纤维都是新型无机非金属材料。( ) (6)水泥、玻璃、青花瓷、水晶、玛瑙都属于硅酸盐工业产品。( ) 【答案】(1)× (2)√ (3)× (4)√ (5)× (6)× 三、氯及其化合物的性质和应用 (1)氯分子的电子式:。 ( ) (2)Cl2与H2O或NaOH的反应中氯气既是氧化剂又是还原剂。( ) (3)氯气溶于水的离子方程式为Cl2+H2O===2H++Cl-+ClO-。 ( ) (4)氯气可用于消灭田鼠,为此,可将氯气用软管通入到田鼠洞中,这是利用了氯气的毒性和密度比空气的大。( ) (5)生活中漂粉精用作消毒剂时,是应用了其还原作用。(2015·高考四川卷,1C改编)( ) (6)为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可。 ( ) (7)漂白粉和明矾都常用于处理自来水,二者的作用原理是不同的。( ) (8)工业上将Cl2通入石灰水中制取漂白粉。( ) (9)HClO见光不会分解。( ) 【答案】(1)√ (2)√ (3)× (4)√ (5)× (6)× (7)√ (8)× (9)× 四、卤素的性质和海水中元素的提取 (1)海水提溴的过程中不发生氧化还原反应。( ) (2)可以用淀粉溶液检验加碘食盐中的KIO3。( ) (3)用CCl4萃取碘水中的碘,先振荡,后静置,液体分层,下层呈无色。( ) (4)碘易升华,可用加热升华法除去NH4Cl中混有的I2。( ) (5)能使湿润的淀粉KI试纸变蓝的气体一定是Cl2。( ) (6)向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色说明Br-还原性强于Cl-。( ) 【答案】(1)× (2)× (3)× (4)× (5)× (6)√ 1.碳、硅及其化合物 (1)知识网络构建 (2)重要反应必练 写出下列反应的化学方程式,是离子反应的写离子方程式。 ①Si和NaOH溶液的反应:Si+2OH-+H2O===SiO+2H2↑; ②SiO2和NaOH溶液的反应:SiO2+2OH-===SiO+H2O; ③SiO2和C的反应:SiO2+2CSi+2CO↑; ④SiO2和氢氟酸的反应:SiO2+4HF===SiF4↑+2H2O; ⑤向Na2SiO3溶液中通入过量CO2气体:SiO+2CO2+2H2O===H2SiO3↓+2HCO; ⑥Mg在CO2中燃烧:2Mg+CO22MgO+C; ⑦向澄清石灰水中通入少量CO2气体:Ca2++2OH-+CO2===CaCO3↓+H2O; ⑧向澄清石灰水中通入过量CO2气体:OH-+CO2===HCO; ⑨除去CO2中的CO:CO+CuOCO2+Cu; ⑩生产普通玻璃的原理:Na2CO3+SiO2Na2SiO3+CO2↑、CaCO3+SiO2CaSiO3+CO2↑。 2.氯气及其化合物 (1)知识网络构建 (2)重要反应必练 写出下列反应的化学方程式,是离子反应的写离子方程式。 ①Cl2和H2O的反应:Cl2+H2OH++Cl-+HClO; ②Cl2和NaOH溶液的反应:Cl2+2OH-===Cl-+ClO-+H2O; ③Cl2和石灰乳的反应:Cl2+Ca(OH)2===Ca2++Cl-+ClO-+H2O; ④把Cl2通入到Na2SO3溶液中:Cl2+SO+H2O===SO+2H++2Cl-; ⑤将Cl2和SO2混合通入H2O中:SO2+Cl2+2H2O===4H++2Cl-+SO; ⑥将Cl2通入到氢硫酸溶液中:Cl2+H2S===S↓+2H++2Cl-; ⑦将浓盐酸和MnO2混合加热:MnO2+4H++2Cl-Mn2++Cl2↑+2H2O; ⑧电解饱和食盐水:2Cl-+2H2OCl2↑+H2↑+2OH-; ⑨将浓盐酸与漂白液混合:Cl-+ClO-+2H+===Cl2↑+H2O; ⑩将浓盐酸与KClO3溶液混合:6H++5Cl-+ClO===3Cl2↑+3H2O; ⑪向KMnO4固体中滴加浓盐酸:2MnO+16H++10Cl-===2Mn2++5Cl2↑+8H2O; ⑫向漂白粉溶液中通入少量CO2气体:Ca2++2ClO-+CO2+H2O===CaCO3↓+2HClO。 1.(1)无机非金属材料分类 (2)不要混淆二氧化硅和硅的用途 用于制作光导纤维的是SiO2,用于制作半导体材料、计算机芯片的是晶体硅。 (3)水晶、石英、玛瑙的主要成分是SiO2;珍珠的主要成分是CaCO3;钻石是金刚石;宝石的主要成分是Al2O3。 2.常见的用于漂白的物质的比较 用于漂白的物质 实际参与漂白的物质 漂白原理 变化类别 漂白特点 能漂白的物质 活性炭 活性炭 吸附漂白 物理变化 物理漂白不可逆 一般用于溶液漂白 氯气 次氯酸 利用次氯酸的强氧化性进行漂白 化学变化 氧化还原漂白,不可逆 可以漂白所有有机色质 次氯酸盐 次氯酸 过氧化钠 过氧化氢 过氧化氢的强氧化性 化学变化 氧化还原漂白不可逆 可以漂白所有有机色质 过氧化氢 二氧化硫 亚硫酸 亚硫酸与有色物质化合生成不稳定的无色物质 化学变化 非氧化还原漂白,可逆 具有选择性,如品红、棉、麻、草等 3.卤化银 (1)AgF易溶于水,AgCl白色、不溶于水,AgBr淡黄色、不溶于水,AgI黄色不溶于水。AgCl、AgBr、AgI也不溶于稀硝酸。 (2)除AgF外,均有感光性,其中AgBr作感光材料,可用于照相用的胶卷和相纸。 (3)AgI可用于人工降雨。 4.卤素单质在不同溶剂中的颜色 常温下 水中 C6H6中 CCl4中 汽油中 Cl2 黄绿色 浅黄绿色 黄绿色 黄绿色 黄绿色 Br2 深红棕色 黄→橙 橙→橙红 橙→橙红 橙→橙红 1.下列关于硅及二氧化硅的说法中正确的是( ) A.高纯度的硅可用于制造计算机芯片 B.SiO2的物理性质与CO2类似 C.熔融烧碱样品使用的器皿是石英坩埚 D.光导纤维的主要成分是Si 【答案】A 2.下列说法不正确的是 A.石英是良好的半导体材料,可以制成光电池,将光能直接转化成电能 B.向煤中加入适量的石灰石,可以减少燃烧产物中SO2的量 C.氮化硅是一种重要的结构陶瓷材料,化学式为Si3N4 D.二氧化硅能与氢氟酸反应,因此可用氢氟酸刻蚀玻璃 【答案】A 3.潮湿的氯气、新制的氯水及漂粉精的水溶液均能使有色布条褪色,因为它们都含有 A.Cl2 B.HClO C.ClO‾ D.HCl 【答案】B 【解析】氯气与水反应生成HClO、HCl,Cl2、HCl都没有漂白性, HClO具有漂白性,故B正确。 4.下列制取Cl2,用其氧化含I-废液,回收并提纯I2的装置和原理能达到实验目的的是 【答案】D 【解析】A、MnO2与浓盐酸反应制Cl2,故A错误;B、Cl2通入含I-溶液中,应长管进,短管出,故B错误;C、应用萃取的方法提取碘,过滤是分离固体与液体的,故C错误;D、可用升华法提取碘,故D正确;故选D。 5.25℃时,氯水中部分含氯的物种的分布分数(平衡时某物种的浓度占各物种浓度之和的百分数)与pH的关系如下图所示。下列叙述不正确的是( ) A.新制氯水中持续通入SO2,pH不断变小,溶液颜色不断变浅 B.新制的pH=l的氯水中,c(H+)>c(Cl3-)>c(HClO) C.25℃时,HC1OH++ClO-的电离常数Ka的对数值为lgKa=-7.54 D.pH=6的氯水中加入NaOH溶液,主要发生的离子反应方程式为Cl2+2OH-=ClO-+C1-+H2O 【答案】D查看更多