- 2021-04-17 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021届一轮复习鲁科版化学实验方案的设计与评价作业
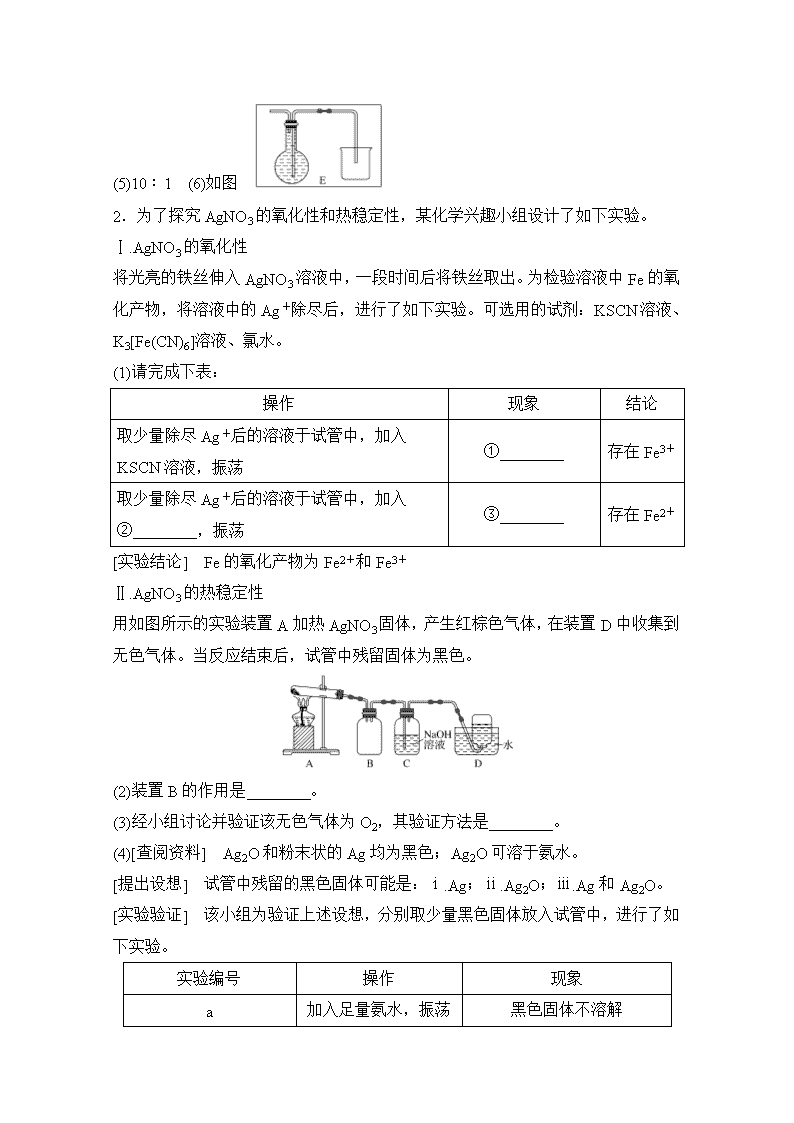
化学实验方案的设计与评价 1.氢化锂(LiH)在干燥的空气中能稳定存在,遇水或酸能够引起燃烧。某活动小组准备使用下列装置制备LiH固体。 甲同学的实验方案如下: (1)仪器的组装连接:上述仪器装置接口的连接顺序为________________,加入药品前首先要进行的实验操作是 ______________________________________________________________, (不必写出具体的操作方法);其中装置B的作用是 _____________________________________________________________。 (2)添加药品:用镊子从试剂瓶中取出一定量金属锂(固体石蜡密封),然后在甲苯中浸洗数次,该操作的目的是________________________________________ ___________________________________________________________, 然后快速把锂放入到石英管中。 (3)通入一段时间氢气后加热石英管,在加热D处的石英管之前,必须进行的实验操作是_________________________________________________ ___________________________________________________________。 (4)加热一段时间后停止加热,继续通氢气冷却,然后取出LiH,装入氮封的瓶里,保存于暗处。采取上述操作的目的是为了避免LiH与空气中的水蒸气接触而发生危险(反应方程式:LiH+H2O===LiOH+H2↑),分析该反应原理,完成LiH与无水乙醇反应的化学方程式:______________________________________ _________________________________________________________。 (5)准确称量制得的产品0.174 g,在一定条件下与足量水反应后,共收集到气体470.4 mL(已换算成标准状况),则产品中LiH与Li的物质的量之比为________。 (6)乙同学对甲的实验方案提出质疑,他认为未反应的H2不能直接排放,所以在最后连接了装置E用来收集H2,请将E装置补充完整。 解析 (1)A装置生成的H2含有HCl和H2O,所以用B装置中的碱石灰除去HCl和H2O,把纯净的H2通入D中制取LiH,后面连接C,防止外界中的H2O进入,所以连接顺序:e接a,b接f,g接d,或e接a,b接g,f接d;与气体相关的实验,在装入药品前首先要进行装置气密性的检查;A装置生成的H2含有HCl和H2O,所以B装置中的碱石灰除去HCl和H2O,得到纯净的H2。 (2)石蜡是有机物,易溶于甲苯等有机溶剂中,所以固体石蜡密封的金属锂在甲苯中浸洗数次的目的是除去锂表面的石蜡。 (3)必须是纯净的H2与Li反应,如果还有空气,H2与空气的混合气体有可能发生爆炸,所以在加热D处的石英管之前,必须进行的实验操作:收集c处排出的气体并检验H2纯度。 (4)分析LiH+H2O===LiOH+H2↑的反应原理,LiH中的H元素为-1价,与H2O中+1价的H元素发生氧化还原反应生成H2,所以LiH中的H元素也能与CH3CH2OH中—OH的H元素发生氧化还原反应,所以化学方程式为LiH+CH3CH2OH―→CH3CH2OLi+H2↑。 (5)气体的物质的量为0.470 4 L÷22.4 L·mol-1=0.021 mol,设LiH物质的量为x,Li物质的量为y,根据产品质量可得8x+7y=0.174 g,根据气体物质的量可得x+y=0.021 mol,解得x=0.02 mol,y=0.002 mol,所以产品中LiH与Li的物质的量之比为10∶1。 (6)利用排水法收集剩余的H2。 答案 (1)e,a,b,f,g,d,c(f和g可互换顺序) 检验装置的气密性 除去H2中的H2O和HCl (2)除去锂表面的石蜡 (3)收集c处排出的气体并检验H2纯度 (4)LiH+CH3CH2OH―→CH3CH2OLi+H2↑ (5)10∶1 (6)如图 2.为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验。 Ⅰ.AgNO3的氧化性 将光亮的铁丝伸入AgNO3溶液中,一段时间后将铁丝取出。为检验溶液中Fe的氧化产物,将溶液中的Ag+除尽后,进行了如下实验。可选用的试剂:KSCN溶液、K3[Fe(CN)6]溶液、氯水。 (1)请完成下表: 操作 现象 结论 取少量除尽Ag+后的溶液于试管中,加入KSCN溶液,振荡 ①________ 存在Fe3+ 取少量除尽Ag+后的溶液于试管中,加入②________,振荡 ③________ 存在Fe2+ [实验结论] Fe的氧化产物为Fe2+和Fe3+ Ⅱ.AgNO3的热稳定性 用如图所示的实验装置A加热AgNO3固体,产生红棕色气体,在装置D中收集到无色气体。当反应结束后,试管中残留固体为黑色。 (2)装置B的作用是________。 (3)经小组讨论并验证该无色气体为O2,其验证方法是________。 (4)[查阅资料] Ag2O和粉末状的Ag均为黑色;Ag2O可溶于氨水。 [提出设想] 试管中残留的黑色固体可能是:ⅰ.Ag;ⅱ.Ag2O;ⅲ.Ag和Ag2O。 [实验验证] 该小组为验证上述设想,分别取少量黑色固体放入试管中,进行了如下实验。 实验编号 操作 现象 a 加入足量氨水,振荡 黑色固体不溶解 b 加入足量稀硝酸,振荡 黑色固体溶解,并有气体产生 [实验评价] 根据上述实验,不能确定固体产物成分的实验是________(填实验编号)。 [实验结论] 根据上述实验结果,该小组得出AgNO3固体热分解的产物有________。 解析 (1)检验Fe3+可用KSCN溶液,现象为溶液呈红色。检验Fe2+可用K3[Fe(CN)6]溶液,Fe2+与K3[Fe(CN)6]反应可产生蓝色沉淀。(2)装置B的作用为防止溶液倒吸进入试管中。(3)O2的检验方法为用带火星的木条伸入集气瓶内,木条复燃。(4)由题干信息可知,Ag2O可溶于氨水,实验a加入足量氨水,固体不溶解,所以固体成分为Ag;而Ag和Ag2O都溶于稀HNO3,所以实验b不能确定固体成分。 答案 (1)①溶液呈红色 ②K3[Fe(CN)6]溶液 ③产生蓝色沉淀 (2)防倒吸 (3)用带火星的木条伸入集气瓶内,木条复燃,证明无色气体为O2 (4)b Ag、NO2、O2 3.2硝基1,3苯二酚由间苯二酚先磺化,再硝化,后去磺酸基生成。原理如下: 部分物质的相关性质如下: 名称 性状 熔点/℃ 相对分子质量 水溶性(常温) 间苯二酚 110 白色针状晶体 110.7 易溶 2硝基1,3苯二酚 155 桔红色针状晶体 87.8 难溶 制备过程如下: 第一步:磺化。称取71.5 g间苯二酚,碾成粉末放入烧瓶中,慢慢加入适量浓硫酸并不断搅拌,控制温度在一定范围内15 min(如图1)。 第二步:硝化。待磺化反应结束后将烧瓶置于冷水中,充分冷却后加入“混酸”,控制温度继续搅拌15 min。 第三步:蒸馏。将硝化反应混合物的稀释液转移到圆底烧瓶B中,然后用图2所示装置进行水蒸气蒸馏。 请回答下列问题: (1)实验室中把间苯二酚碾成粉末需要的玻璃仪器是________。 (2)磺化步骤中控制温度最合适的范围为(填字母)________。 a.30 ℃~60 ℃ b.60 ℃~65 ℃ c.65 ℃~70 ℃ d.70 ℃~100 ℃ (3)硝化步骤中制取“混酸”的具体操作是_______________________ ________________________________________________________。 (4)图2中,烧瓶A中长玻璃管起稳压作用,既能防止装置中 压强过大引起事故,又能防止________________________________________ _______________________________________________________; 直形冷凝管C中的现象是____________________________________________ ______________________________________________________, 反应一段时间后,停止蒸馏,此时的操作是______________________________ (填有关旋塞和酒精灯的操作)。 (5)水蒸气蒸馏是分离和提纯有机物的方法之一,被提纯物质必须具备的条件正确的是________。 a.不溶或难溶于水,便于最后分离 b.在沸腾下与水不发生化学反应 c.具有一定的挥发性 d.具有较低的熔点 (6)本实验最终获得12.0 g桔红色晶体,则2硝基1,3苯二酚的产率约为________。 答案 (1)研钵(含杵) (2)b (3)在锥形瓶中加入适量的浓硝酸,在摇荡下缓慢加入一定量的浓硫酸,冷却 (4)压强过小引起倒吸 直形冷凝管内壁有桔红色晶体析出 打开旋塞,撤去酒精灯 (5)abc (6)11.9% 4.某酸性工业废水中含有K2Cr2O7。光照下,草酸(H2C2O4)能将其中的Cr2O转化为Cr3+。某课题组研究发现,少量铁明矾[Al2Fe(SO4)4·24H2O]即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下: (1)在25 ℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,做对比实验,完成以下实验设计表(表中不要留空格)。 实验编号 初始pH 废水样品体积/mL 草酸溶液体积/mL 蒸馏水体积/mL ① 4 a=______ 10 30 ② 5 60 10 b=______ ③ 5 60 c=________ 20 测得实验①和②溶液中的Cr2O浓度随时间变化关系如图所示。 (2)上述反应后草酸被氧化为________(填化学式)。 (3)实验①和②的结果表明,其他条件不变时,____________________________。 (4)该课题组对铁明矾[Al2Fe(SO4)4·24H2O]中起催化作用的成分提出如下假设,请你完成假设三: 假设一:Fe2+起催化作用; 假设二:Al3+起催化作用; 假设三:________________________________________________________。 (5)请设计实验验证假设一,完成下表中的内容。 [除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4·Al2(SO4)3·24H2O、Al2(SO4)3等。溶液中Cr2O的浓度可用仪器测定] 实验方案(不要求写出具体操作过程) 预期实验结果和结论 取等物质的量的________代替实验①中的铁明矾,控制其他反应条件与实验①相同,进行对比实验 反应进行相同时间后,若溶液中c(Cr2O)的浓度________(填“>”“<”或“=”,下同)实验①中的Cr2O的浓度,则假设一成立; 若溶液中Cr2O的浓度________实验①中的Cr2O的浓度,则假设一不成立 (6)铁明矾长期存放,其中的亚铁离子可能会变质。为测定铁明矾中亚铁离子的质量分数进行如下实验: 取5.6 g铁明矾晶体,将其配成100 mL溶液,取20 mL溶液于锥形瓶中,用0.01 mol·L-1的标准KMnO4溶液进行滴定(还原产物为Mn2+),做4组平行实验所得数据如下表所示: 组数 1 2 3 4 消耗 V(KMnO4)/mL 20.04 20.00 18.90 19.96 则明矾中亚铁离子的质量分数为________(保留小数点后两位)。若滴定结束后,俯视读数,测定结果________(填“偏大”“偏小”或“不影响”)。 解析 (1)①、②中pH不同,探究pH对速率的影响;除pH外,其他条件必须完全相同,则a=60、b=30,溶液总体积相等(均为100 mL),则c=20。 (2)草酸还原性较强,遇到强氧化剂时被氧化为二氧化碳。 (3)由图可知,溶液pH越小,反应速率越快。 (4)根据铁明矾[Al2Fe(SO4)4·24H2O]的组成分析,假设三为SO起催化作用。 (5)要证明Fe2+起催化作用,需做没有Fe2+存在时的实验,应选用等物质的量的K2SO4·Al2(SO4)3·24H2O代替实验①中的铁明矾。反应进行相同时间后,若溶液中c(Cr2O)>实验①中c(Cr2O),则假设一成立;若两溶液中的c(Cr2O) 相同,则假设一不成立。 (6)第3组数据误差过大,舍去,消耗高锰酸钾溶液的平均体积为 mL=20.00 mL,根据关系式MnO~5Fe2+可知,100 mL溶液中n(Fe2+)=5×0.020 L×0.01 mol/L×=5.0×10-3 mol,m(Fe2+)=56 g/mol×5.00×10-3 mol=0.28 g,Fe2+的质量分数为×100%=5.00%。滴定后俯视读数,读数偏小,测定结果偏小。 答案 (1)①60 ②30 ③20 (2)CO2 (3)溶液的pH越小,反应速率越快 (4)SO起催化作用 (5)K2SO4·Al2(SO4)3·24H2O > = (6)5.00% 偏小查看更多