- 2021-04-17 发布 |
- 37.5 KB |
- 17页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
陕西省榆林市绥德县绥德中学2019-2020学年高二上学期期末考试化学试题
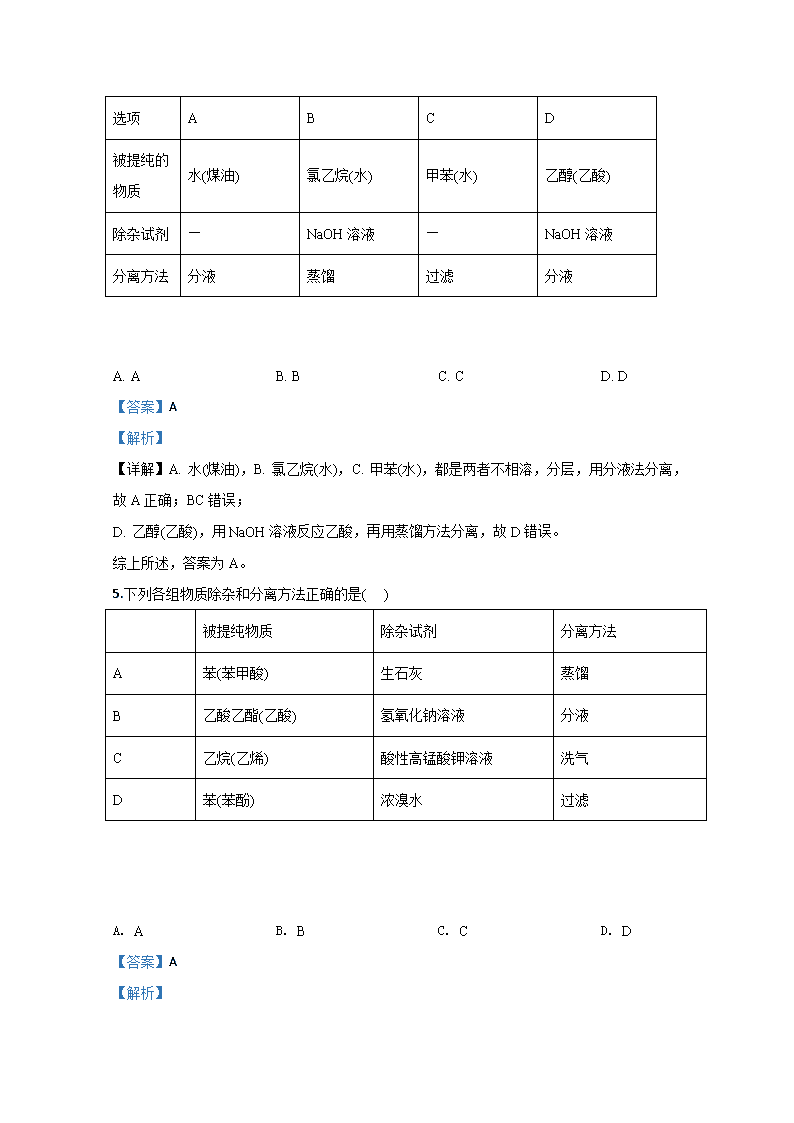
化 学 试 卷 第I 卷选择题(共54分) 相对原子质量:C:12 O:16 H:1 Cd:112.4 Cu:64 一.选择题(每题只有一个正确答案,每题3分,共3×18=54分) 1.“低碳经济”是以低能耗、低污染、低排放为基础的可持续发展经济模式。下列说法与“低碳经济”不符合的是( ) A. 大力研发新型有机溶剂替代水作为萃取剂 B. 加强对煤、石油、天然气等综合利用的研究,提高燃料的利用率 C. 利用CO2合成聚碳酸酯类可降解塑料,实现“碳”的循环利用 D. 开发太阳能以减少使用化石燃料排放气体对大气的污染 【答案】A 【解析】 【分析】 【详解】A. 有机溶剂一般比水污染大,大力研发新型有机溶剂替代水与“低碳经济”不符合,故A选; B. 加强对煤、石油、天然气等综合利用的研究,提高燃料的利用率,可减少化石燃料的使用,符合“低碳经济”模式,故B不选; C. 利用CO2合成聚碳酸酯类可降解塑料,实现“碳”的循环利用,能减少二氧化碳的排放,符合“低碳经济”模式,故C不选; D. 开发太阳能以减少使用化石燃料排放气体对大气的污染,也可以减少二氧化碳的排放,符合“低碳经济”模式,故D不选。 答案为A。 2.下列有机物命名正确的是( ) A. CH3CH2CH2CH2OH 1-丁醇 B. 间二甲苯 C. 2-甲基-2-丙烯 D. 2-乙基丙烷 A. A B. B C. C D. D 【答案】A 【解析】 【分析】 【详解】A. CH3CH2CH2CH2OH分子结构中,羟基在1号碳上,名称为1-丁醇,故A正确; B. 分子结构中,两个甲基在苯环对位,名称为对二甲苯,故B错误; C. 分子结构中,甲基在2号碳上,碳碳双键在1号碳上,名称为2-甲基丙烯或2-甲基-1-丙烯,故C错误; D. 分子结构中,主碳链为4,名称为2-甲基丁烷,故D错误。 综上所述,答案为A。 3.分子式为 C4H10O并能与金属钠反应放出氢气的有机化合物有( ) A. 3种 B. 4种 C. 5种 D. 6 种 【答案】B 【解析】 【详解】分子式为 C4H10O并能与金属钠反应放出氢气的有机化合物是丁醇,其中丁基-C4H9可能的结构有:-CH2CH2CH2CH3、-CH(CH3)CH2CH3、:-CH2CH(CH3)2 、-C(CH3)3 ,丁基异构数目等于丁醇的异构体数目,该有机物的可能结构有4种;故选B。 4.为提纯下列物质(括号内的物质为杂质),所选用的除杂试剂和分离方法都正确的是( ) 选项 A B C D 被提纯的物质 水(煤油) 氯乙烷(水) 甲苯(水) 乙醇(乙酸) 除杂试剂 — NaOH溶液 — NaOH溶液 分离方法 分液 蒸馏 过滤 分液 A. A B. B C. C D. D 【答案】A 【解析】 【详解】A. 水(煤油),B. 氯乙烷(水),C. 甲苯(水),都是两者不相溶,分层,用分液法分离,故A正确;BC错误; D. 乙醇(乙酸),用NaOH溶液反应乙酸,再用蒸馏方法分离,故D错误。 综上所述,答案为A。 5.下列各组物质除杂和分离方法正确的是( ) 被提纯物质 除杂试剂 分离方法 A 苯(苯甲酸) 生石灰 蒸馏 B 乙酸乙酯(乙酸) 氢氧化钠溶液 分液 C 乙烷(乙烯) 酸性高锰酸钾溶液 洗气 D 苯(苯酚) 浓溴水 过滤 A. A B. B C. C D. D 【答案】A 【解析】 【分析】 【详解】A.苯甲酸和生石灰反应生成苯甲酸钙和水,通过蒸馏的方式得到苯,能达到除杂的目的,A正确; B.加入试剂氢氧化钠溶液,不仅乙酸被反应掉,乙酸乙酯也会水解,不能达到除杂目的,B错误; C. 酸性高锰酸钾溶液与乙烯反应会生成二氧化碳气体,又引入了新的杂质,不能达到除杂目的,C错误; D.苯酚与溴水反应生成三溴苯酚,但溴、三溴苯酚均易溶于苯,不能除杂,应选NaOH、分液,D错误。 答案选A。 6.核糖是合成核酸的重要原料,结构简式为:CH2OH-CHOH-CHOH-CHOH-CHO,下列关于核糖的叙述正确的是( ) A. 可以与银氨溶液作用形成银镜 B. 与葡萄糖互为同分异构体 C. 可以跟氯化铁溶液作用显色 D. 可以使紫色石蕊试液变红 【答案】A 【解析】 【分析】 【详解】A.核糖中含有醛基,可以与银氨溶液作用形成银镜,A正确; B.核糖分子式为,葡萄糖分子式为,分子式不同,不能互为同分异构体,B错误; C.跟氯化铁溶液作用显色是酚的特征反应,而核糖中的羟基为醇羟基,C错误; D.核糖官能团为羟基和醛基,都不能电离出氢离子,不具有酸性,不能使使紫色石蕊试液变红,D错误。 答案选A。 7.下列叙述错误的是( ) A. 福尔马林、葡萄糖与银氨溶液共热都有光亮的银镜生成 B. 油脂和纤维素都是能发生水解反应的高分子化合物 C. 鸡蛋清溶液中加入饱和(NH4)2SO4溶液后产生沉淀,是因为蛋白质发生了盐析 D. 沾附在试管内壁上的油脂,用热碱液洗涤 【答案】B 【解析】 【分析】 醛基能与银氨溶液发生银镜反应,油脂为大分子有机物,含有酯基,能与碱性溶液发生水解反应,蛋白质与非金属盐发生盐析反应,据此回答问题。 【详解】A. 福尔马林主成分为甲醛、葡萄糖为多羟基醛,均含有醛基,与银氨溶液共热都有光亮的银镜生成,A正确; B 油脂能发生水解反应,但不属于高分子化合物,碳原子数有限,分子式明确,B错误; C. 鸡蛋清溶液中加入饱和(NH4)2SO4溶液后产生沉淀,是因为蛋白质发生了盐析,C正确; D. 沾附在试管内壁上的油脂,含有酯基,用热碱液洗涤能发生水解,D正确。 答案为B。 8.有机物的结构简式如下图: 则此有机物可发生的反应类型有 ①取代 ②加成 ③消去 ④酯化 ⑤水解 ⑥氧化 ⑦中和 A. ①②③⑤⑥ B. ②③④⑤⑥ C. ①②③④⑤⑥⑦ D. ②③④⑤⑥⑦ 【答案】C 【解析】 【详解】分子中含有碳碳双键,能发生加成反应、氧化反应、加聚反应;含醇羟基,能发生取代反应、酯化反应、氧化反应、消去反应等;含羧基,能发生中和反应、取代反应、酯化反应;含酯基,能发生水解等;答案选C。 9.有机物分子中原子间(或原子与原子团间)的相互影响会导致物质化学性质的不同。下列各项的事实不能说明上述观点的是 A. 甲苯能使酸性高锰酸钾溶液褪色,而甲烷不能使酸性高锰酸钾溶液褪色 B. 乙基对羟基的影响,使羟基的活性变弱,电离H+的能力不及H2O C. 乙烯能发生加成反应,而乙烷不能发生加成反应 D. 苯酚中的羟基氢能与NaOH溶液反应,而醇羟基氢不能与NaOH溶液反应 【答案】C 【解析】 【详解】A.甲基连接在苯环上,可被氧化,说明苯环对甲基影响,故A错误; B.羟基所连的原子团不同,乙醇分子中醇羟基中氢原子的活泼性小于水中氢原子,能说明上述观点,故B错误; C.乙烯和乙烷结构不同,乙烯含有C=C,可发生加成反应,不能用上述观点证明,故C正确; D.在苯酚中,由于苯环对-OH的影响,酚羟基具有酸性,对比乙醇,虽含有-OH,但不具有酸性,能说明上述观点,故D错误。 故答案选C。 10.已知C—C键可以绕键轴自由旋转,结构简式如下的烃,下列说法中正确的是( ) A. 分子中至少有8个碳原子处于同一平面上 B. 分子中至少有9个碳原子处于同一平面上 C. 该烃的一氯取代物最多有8种 D. 该烃是苯的同系物 【答案】B 【解析】 【分析】 有机物结构中具有2个苯环,无官能团,结构对称,一共有5种环境氢原子。 【详解】A. 分子中含有苯环和甲基,苯环为平面结构,两个苯环相连的C—C键可以绕键轴自由旋转,故至少有9个碳原子处于同一平面上,A错误; B. 分子中至少有9个碳原子处于同一平面上,B正确; C. 结构对称,一共有5种环境的氢原子,该烃的一氯取代物最多有5种,C错误; D. 同系物要求为官能团结构和数量相同,分子式差n个CH2的有机物,该烃不是苯的同系物, D错误。 答案为B。 11.CH3CH3→CH2=CH2+H2的反应热为( ) 化学键 C-H C=C C-C H-H 键能kJ/mol 414.4 615.3 347.4 435.3 A. -125.6kJ/mol B. +125.6kJ/mol C. +46.1kJ/mol D. -46.1kJ/mol 【答案】B 【解析】 【分析】 根据反应热与键能公式回答问题。 【详解】反应热=反应物总键能-生成物总键能,即反应热=。 答案为B。 12.分子式为C5H12O的某醇与溴化钠、硫酸混合加热得卤代烃,该卤代烃与强碱醇溶液共热后,不能发生消去反应,该醇可能是 A. 2,2-二甲基-1-丙醇 B. 2-甲基-2-丁醇 C. 1-戊醇 D. 3-戊醇 【答案】A 【解析】 【详解】分子式为C5H12O的某醇与溴化钠、硫酸混合加热得卤代烃,该卤代烃与强碱醇溶液共热后,不能发生消去反应,则醇也不能发生消去反应,说明羟基相连的碳原子的相邻碳原子上不含H原子,则中间的碳原子中连接3个-CH3和一个-CH2OH,所以其结构简式为(CH3)3CCH2OH,其名称为2,2-二甲基-1-丙醇。答案选A。 【点睛】 本题考查醇和卤代烃的消去反应,注意醇不能发生消去反应的结构特点是:与羟基相连的碳原子的相邻碳原子上不含H原子。 13.下列的叙述中,正确的是( ) A. 检验溴乙烷中的溴元素,加入NaOH溶液共热,冷却后加入AgNO3溶液,观察有无浅黄色沉淀生成 B. 苯酚钠溶液中通入少量二氧化碳:2C6H5O-+ CO2 + H2O→2C6H5OH + C. 苯酚能与FeCl3溶液反应生成紫色沉淀 D. 苯酚有强腐蚀性,沾在皮肤上可用酒精清洗 【答案】D 【解析】 【分析】 有机物中溴元素以原子形式存在,不与银离子反应,故常用氢氧化钠水解后,用硝酸酸化的硝酸银发生沉淀进行检验;利用强酸制弱酸的原理,二氧化碳溶于水生成碳酸制苯酚;酚羟基与氯化铁有显色反应;苯酚能溶于酒精,据此回答问题。 【详解】A. 检验溴乙烷中的溴元素,加入NaOH溶液共热,因银离子在碱性环境下产生氢氧化银沉淀,故冷却后加入硝酸酸化的AgNO3溶液,观察有无浅黄色沉淀硫化银生成,A错误; B. 苯酚钠溶液中通入少量二氧化碳:C6H5O-+ CO2 + H2O→C6H5OH +,B错误; C. 苯酚能与FeCl3溶液反应生成紫色溶液,C错误; D. 苯酚有强腐蚀性,利用相似相容原理,沾在皮肤上可用酒精清洗,D正确; 答案为D。 14.酒精检测仪可帮助执法交警测试驾驶员饮酒的多少,其工作原理示意图如图所示。反应原理为:CH3CH2OH+O2=CH3COOH+H2O,被测者呼出气体中所含的酒精被输送到电池中反应产生微小电流,该电流经电子放大器放大后在液晶显示屏上显示其酒精含量。下列说法正确的是 A. b为正极,电极反应式为:O2+4H++4e-=2H2O B. 电解质溶液中的H+移向a电极 C. 若有0.4mol电子转移,则在标准状况下消耗4.48L氧气 D. 呼出气体中酒精含量越高,微处理器中通过的电流越小 【答案】A 【解析】 燃料电池中,负极上燃料失电子发生氧化反应,氧化剂在正极上发生还原反应;A.b为正极,正极上氧气得电子和氢离子反应生成水,所以电极反应式为O2+4e-+4H+=2H2O,故A正确;B.该燃料电池中,a是负极,b是正极,电解质溶液中氢离子向b极移动,故B错误;C.b为正极,电极反应式为O2+4e-+4H+=2H2O,所以有0.4 mol电子转移,则在标准状况下消耗2.24L氧气,故C错误;D.单位时间内,人呼出的气体中酒精含量越多,酒精失电子数越多,所以微处理器中通过的电流越大,故D错误;故选A。 15.自2016年1月1日起,无线电动工具中使用的镍镉电池将在欧盟全面退市。镍镉电池放电时的总反应为Cd+2NiO(OH)+2H2O===2Ni(OH)2+Cd(OH)2,下列说法正确的是( ) A. 电池的电解液为碱性溶液,正极为NiO(OH)、负极为Cd B 放电时,每通过2 mol电子,负极质量减轻112.4g C. 放电时,电子从正极流向电源的负极 D. 充电时,Cd极板应与外电源的正极相接 【答案】A 【解析】 【详解】A.在镍镉蓄电池中,Cd是负极,2NiO(OH)是正极,由于生成Ni(OH)2和Cd(OH)2,则电解液为碱性溶液,故A正确;B.放电时,负极反应为Cd+2OH--2e-===Cd(OH)2,忽视了Cd(OH)2在极上析出,该极质量应该增加而非减小,故B错误;C.放电时,电子从电池的负极流向电池的正极,故C错误;D.镍镉电池放电时的负极和充电时的阴极是同一极,应与外电源的负极相连,故D错误;答案选A。 【点睛】在分析电极的质量变化时不仅要考虑放电的材料,还要注意放电后产生的离子与电解质溶液中的某些离子反应生成沉淀而导致电极的质量反而增加,如本题中的Cd电极、铅蓄电池的负极等。 16.沼气是一种能源,它的主要成分是CH4。0.5molCH4完全燃烧生成CO2气体和液体H2O时,放出445kJ热量,则下列热化学方程式中正确的是( ) A. CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890kJ·mol-1 B. CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=+890kJ·mol-1 C. CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890kJ·mol-1 D. CH4(g)+O2(g)= CO2(g)+H2O(l) △H=-890kJ·mol-1 【答案】C 【解析】 【分析】 【详解】0.5mol CH4完全燃烧生成CO2和液态水时,放出445kJ热量,所以1molCH4在氧气中燃烧生成CO2和液态水,放出890kJ热量,放热反应焓变小于0,所以热化学方程式可以是CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890kJ·mol-1或CH4(g)+O2(g)=CO2(g)+H2O(l)△H=-445kJ·mol-1。 故答案为C。 17.微型钮扣电池在现代生活中有广泛应用。有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH,电极反应为:Zn+2OH--2e-=ZnO+H2O;Ag2O+H2O+2e-=2Ag+2OH-,根据上述反应式,判断下列叙述中正确的是:( ) A. 在使用过程中,电池负极区溶液的pH增大 B. 使用过程中,电子由Ag2O极经外电路流向Zn极 C. Zn是负极,Ag2O是正极 D. Zn电极发生还原反应,Ag2O电极发生氧化反应 【答案】C 【解析】 【分析】 原电池中正极得电子发生还原反应,负极失电子发生氧化反应,所以Zn为负极,Ag2O为负极。 【详解】A.负极发生反应Zn+2OH--2e-=ZnO+H2O,消耗氢氧根,电极附近pH减小,故A错误; B.原电池中电子由负极经外电路流向正极,即从Zn极到Ag2O,故B错误; C.原电池中正极得电子发生还原反应,负极失电子发生氧化反应,所以Zn为负极,Ag2O为负极,故C正确; D.Zn为负极,发生氧化反应,Ag2O为正极,发生还原反应,故D错误; 故答案为C。 18.如图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽.接通电路后发现B上的c点显红色.为实现铁上镀铜,接通K后,使c、d两点短路.下列叙述正确的是( ) A. a为直流电源的负极 B. c极发生的反应为2Cl--2e-=Cl2↑ C. f电极为铜板 D. e极发生氧化反应 【答案】D 【解析】 【分析】 B为浸透饱和氯化钠溶液和酚酞试液滤纸,接通电路后发现B上的c点显红色,说明c点处水电离出的氢离子放电产生氢气,同时产生OHˉ,所以c为阴极,则d是阳极,a为电源正极,b为电源负极;短接后e为阳极,f为阴极。 【详解】A.根据分析可知a为直流电源的正极,故A错误; B.c电极上氢离子放电生成氢气,电极反应式为2H++2e-=H2↑,故B错误; C.为实现铁上镀铜,需要铁作阴极,铜离子放电生成铜单质,为补充电解质溶液中的铜离子,需要铜板作阳极,即e为铜板,故C错误; D.e电极与电源正极相连为阳极,发生氧化反应,故D正确; 故答案为D。 第II 卷 非选择题(共46分) 二.填空题 19. 某化学课外小组用下图装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。 (1)写出A中反应的化学方程式______________________。 (2)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是________________,写出有关的化学方程式__________________________________________________。 (3)C中盛放CCl4的作用是__________________。 (4)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法是向试管D中加入________,现象是______________。 【答案】 (1). (2). 除去溶于溴苯中的溴 (3). Br2+2NaOH=NaBr+NaBrO+H2O (4). 除去溴化氢气体中的溴蒸气 (5). 石蕊试液 (6). 溶液变红色(其他合理答案亦可) 【解析】 【分析】 苯和液溴在铁粉催化作用下发生取代反应生成溴苯和溴化氢:,由于反应放热,苯和液溴均易挥发,导致所得溴苯不纯净,溴化氢易溶于水电离出H+和Br-,溴离子遇到银离子会发生反应生成AgBr沉淀,以此来解答。 【详解】(1 )在催化剂的作用下,苯环上的氢原子被溴原子所取代,生成溴苯,同时有溴化氢生成,故答案为:; (2)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是除去溶于溴苯中的溴,反应的方程式是Br2+2NaOH=NaBr+NaBrO+H2O,故答案为:除去溶于溴苯中的溴;Br2+2NaOH=NaBr+NaBrO+H2O; (3)根据相似相溶原理,溴极易溶于四氯化碳,而溴化氢则不溶,所以C中盛放CCl4的作用是除去溴化氢气体中的溴蒸气,故答案为:除去溴化氢气体中的溴蒸气; (4)如果发生取代反应,生成溴化氢,溴化氫易溶于水电离出H+和Br-,只要检验含有氢离子或溴离子即可,溴离子的检验:取溶液滴加硝酸银溶液,如果生成淡黄色沉淀就证明是溴离子;氢离子的检验:如果能使紫色石蕊试液变红,就证明含有氢离子,故答案为:石蕊试液;溶液变红色。 20.是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成。 请回答下列问题: (1)A与银氨溶液反应有银镜生成,则A的结构简式是__________________ (2)B→C的反应类型是______________ (3)写出F和过量NaOH溶液共热时反应的化学方程_______________________________ (4)下列关于G的说法正确的是______________ a.能与溴单质反应 b.能与金属钠反应 c.1molG最多能和3mol氢气反应 d.分子式是C9H7O3 (5)与D互为同分异构体且含有酚羟基、酯基的有_____________种 (6)根据已学知识和获取的信息,写出以CH3COOH,为原料合成重要的化工产品的路线流程图__________________________(无机试剂任选)合成路线流程图示例如下:CH3CH2OHCH2=CH2 【答案】 (1). CH3CHO (2). 取代反应 (3). +3NaOH +CH3COONa+CH3OH+H2O (4). a、b (5). 三种 (6). 【解析】 【分析】 A与银氨溶液反应有银镜生成,被氧化生成乙酸,则A为CH3CHO;B中羟基被氯原子取代生成C;D和甲醇在浓硫酸作用下发生酯化反应生成E,则E的结构简式为E为;C与E在催化剂作用下发生取代反应生成F,F经系列反应生成G。 【详解】(1)根据分析可知A为CH3CHO; (2)对比B和C结构简式,B中羟基被氯原子取代生成C,所以为取代反应; (3)F含有酯基可以在NaOH溶液中水解,水解后产生羧基和酚羟基和NaOH溶液反应,所以化学方程式为+3NaOH +CH3COONa+CH3OH+H2O; (4)a.G中含有碳碳双键,所以能与溴单质反应,故a正确; b.G中含有醇羟基,所以能与金属钠反应生成氢气,故b正确; c.苯环和碳碳双键均可以和氢气加成,1molG最多能和4mol氢气反应,故c错误; d.分子式是C9H6O3,故d错误; 故选:ab; (5)与D互为同分异构体且含酚羟基、属于酯类,则应为甲酸酯,苯环上有酚羟基和酯基有邻、间、对三种结构; (6)以CH3COOH,为原料合成重要的化工产品,应先制备,可由经消去、加成、水解后生成,则反应的流程为。 【点睛】第3题书写化学方程式时要注意水解后产生的酚羟基也可以与NaOH反应;烃的含氧衍生物所含氢原子个数不可能为奇数。 21.下图是一个电化学过程的示意图,请按要求填空: (1)通入CH3CH2OH的电极名称是______________,B电极的名称是_____________。 (2)通入CH3CH2OH一极的电极反应式为_____________________________________。 (3)乙池中总反应的化学方程式为___________________________________________。 (4)当乙池中A(Fe)极的质量增加12.8g时,甲池中消耗O2 _______ mL(标况下) (5)火箭发射时可用肼(N2H4)为燃料,以二氧化氮做氧化剂,它们相互反应生成氮气和水蒸气。 ①写出在碱性条件下负极反应式为:___________________________________________。 ②已知:N2(g)+2O2(g)=2NO2(g),ΔH=+67.7 kJ·mol-1;N2H4(g)+O2(g)=N2(g)+2H2O(g),ΔH=-534 kJ·mol-1,则N2H4和NO2反应的热化学方程式__________________________________________。 【答案】 (1). 负极 (2). 阳极 (3). C2H5OH-12e-+16OH-=2CO+11H2O (4). 2CuSO4+2H2O2Cu+O2↑+2H2SO4 (5). 2240 (6). N2H4-4e-+ 4OHˉ=N2+4H2O (7). 2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7kJ•mol-1 【解析】 【分析】 甲池为乙醇燃料电池,放电过程中乙醇被氧化作负极,由于电解质溶液显碱性,所以生成CO和水;氧气被还原作正极,碱性电解质溶液中生成OHˉ;乙池为电解池装置,B电极与原电池正极相连为阳极,失电子发生氧化反应,A电极与原电池负极相连为阴极,得电子发生还原反应。 【详解】(1)通入乙醇的电极失电子发生氧化反应,为原电池的负极;B电极与原电池正极相连为阳极; (2)乙醇被氧化作负极,由于电解质溶液显碱性,所以生成CO和水,电极方程式为C2H5OH-12e-+16OHˉ=2CO+11H2O; (3)乙池中阳极上水电离出的氢氧根放电生成氧气,同时产生氢离子,阴极上铜离子放电生成铜单质,所以电池总反应的化学方程式为2CuSO4+2H2O2Cu+O2↑+2H2SO4; (4)乙池中A电极为阴极,电极反应为Cu2++2e-=Cu,析出铜的物质的量为=0.2mol,所以转移的电子为0.4mol,甲池中通入氧气的一极的电极反应为O2+2H2O+4e-=4OHˉ,所以转移0.4mol电子时消耗0.1mol氧气,标况下体积为0.1mol×22.4L/mol=2.24L=2240mL; (5)①原电池中负极失电子发生氧化反应,该电池中N2H4被NO2氧化,所以N2H4为负极原料,电解质溶液显碱性,所以电极方程式为N2H4-4e-+ 4OHˉ=N2+4H2O; ②已知i:N2(g)+2O2(g)=2NO2(g),△H=+67.7kJ•mol-1; ii:N2H4(g)+O2(g)=N2(g)+2H2O (g),△H=-534kJ•mol-1 根据盖斯定律,2×②-①可得2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) △H=2(-534kJ•mol-1)-(+67.7kJ•mol-1)=-1135.7kJ•mol-1。 【点睛】有关电解池和原电池串联装置的计算,要注意把握“电路中各处转移电子数相等”进行计算。 22.如下图所示,A、F为石墨电极,B、E为铁片电极。按要求回答下列问题。 (1)打开K2,合并K1。B为________极,A的电极反应为________________________。 写出U型管中涉及的两个主要化学反应方程式为_______________________;________________________。 (2)打开K1,合并K2。E为________极,F极的电极反应为_____________________ (3)若往U形管中滴加酚酞,进行(1)(2)操作时,A、B、E、F电极周围能变红的是________ 【答案】 (1). 负 (2). O2+2H2O+4e-=4OH- (3). 2Fe+O2+2H2O=2Fe(OH)2 (4). 4Fe(OH)2+O2+2H2O=4Fe(OH)3 (5). 阴 (6). 2Cl--2e-=Cl2↑ (7). AE 【解析】 【分析】 当打开K2,合并K1,左侧U形管为原电池装置,发生铁的吸氧腐蚀,A为正极,B为负极;打开K1,合并K2,右侧U形管为电解池装置,E与电源负极相连为阴极,F与电源正极相连为阳极。 【详解】(1)当打开K2,闭合K1时,铁片、石墨和NaCl溶液构成原电池,发生铁的吸氧腐蚀,所以负极为铁,即B为负极,电极反应式为:Fe-2e-=Fe2+,正极为石墨,正极的电极反应式为:O2+2H2O+4e-=4OH-;负极产生的Fe2+会与正极产生的OH-反应生成Fe(OH)2,而Fe(OH)2容易被氧化成Fe(OH)3,所以U型管中涉及的两个主要化学反应方程式为2Fe+O2+2H2O=2Fe(OH)2、4Fe(OH)2+O2+2H2O=4Fe(OH)3; (2)当打开K1,闭合K2时,铁片、石墨和NaCl溶液构成电解池,E与电源负极相连,所以为阴极,F极与电源正极相连为阳极,氯离子放电生成氯气,电极方程式为2Cl--2e-=Cl2↑; (3)由于A极O2得到电子产生OH-,E极上水放电产生H2和OH-,均导致电极区域呈碱性,所以A、E电极周围遇酚酞变红。查看更多