- 2021-04-17 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
吉林省延边市长白山第一高级中学2019-2020学年高一下学期验收考试化学试题
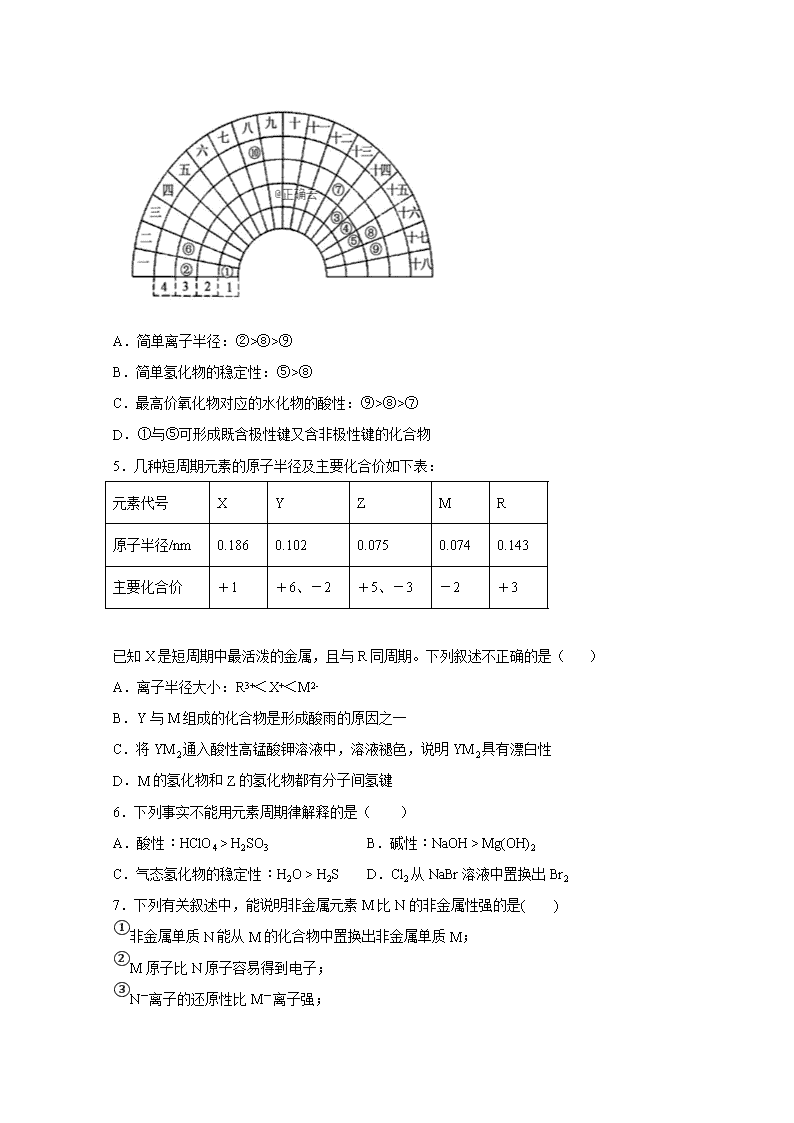
长白山第一高级中学2019-2020学年高一下学期验收考试 化学试卷 时间:90分钟 分值:100分 相对原子原子质量:C-12 H-1 O-16 Ag-108 一、单选题 1.对于下列事实的解释正确的是( ) A.在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有吸水性 B.浓硝酸在光照下颜色变黄,说明浓硝酸具有挥发性 C.常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应 D.氨气可以完成喷泉实验,说明氨气极易溶于水 2.根据侯氏制碱原理制备少量NaHCO3的实验,经过制取氨气、制取NaHCO3、分离NaHCO3、干燥NaHCO3四个步骤,下列图示装置和原理能达到实验目的的是( ) A.制取氨气 B.制取碳酸氢钠 C.分离碳酸氢钠 D.干燥碳酸氢钠 3.2016年IUPAC命名117号元素为Ts(中文名“钿”,tián),Ts的原子核外最外层电子数是7。下列说法不正确的是( ) A.Ts是第七周期第ⅦA族元素 B.Ts的同位素原子具有相同的电子数 C.Ts在同族元素中非金属性最弱 D.中子数为176的Ts核素符号是Ts 4.元素周期表的形式多种多样,如下图所示是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表,思考扇形元素周期表的填充规律,下列说法不正确的是( ) A.简单离子半径:②>⑧>⑨ B.简单氢化物的稳定性:⑤>⑧ C.最高价氧化物对应的水化物的酸性:⑨>⑧>⑦ D.①与⑤可形成既含极性键又含非极性键的化合物 5.几种短周期元素的原子半径及主要化合价如下表: 元素代号 X Y Z M R 原子半径/nm 0.186 0.102 0.075 0.074 0.143 主要化合价 +1 +6、-2 +5、-3 -2 +3 已知X是短周期中最活泼的金属,且与R同周期。下列叙述不正确的是( ) A.离子半径大小:R3+<X+<M2- B.Y与M组成的化合物是形成酸雨的原因之一 C.将YM2通入酸性高锰酸钾溶液中,溶液褪色,说明YM2具有漂白性 D.M的氢化物和Z的氢化物都有分子间氢键 6.下列事实不能用元素周期律解释的是( ) A.酸性:HClO4 > H2SO3 B.碱性:NaOH > Mg(OH)2 C.气态氢化物的稳定性:H2O > H2S D.Cl2从NaBr溶液中置换出Br2 7.下列有关叙述中,能说明非金属元素M比N的非金属性强的是( ) ①非金属单质N能从M的化合物中置换出非金属单质M; ②M原子比N原子容易得到电子; ③N-离子的还原性比M-离子强; ④气态氢化物水溶液的酸性HmM>HnN; ⑤氧化物水化物的酸性HmMOx>HnNOy; ⑥单质熔点M>N。 A.②⑤ B.②③ C.①②③ D.①②③⑤ 8.已知钡的金属活动性处于钾和钠之间。则下列变化中可能实现的是( ) A.钡可从氯化钠溶液中置换出金属钠 B.钡可从冷水中置换出氢气 C.钡可从硫酸铜溶液中置换出铜 D.在溶液中Ba2+可氧化金属锌,生成Zn2+ 9.下列物质的电子式书写正确的是( ) A. B. C. D. 10.下列变化中有化学键的断裂的是( ) A.HCl溶于水 B.酒精的挥发 C.干冰的升华 D.裁剪布料 11.下列反应既属于氧化还原反应,又属于吸热反应的是( ) A.铝片和稀盐酸反应 B.Ba(OH)2·8H2O与NH4Cl的反应 C.灼热的碳与二氧化碳的反应 D.甲烷在氧气中的燃烧 12.已知反应X+Y=M+N为吸热反应,对这个反应的下列说法中正确的是( ) A.X的能量一定低于M的,Y的能量一定低于N的 B.因为该反应为吸热反应,故一定要加热反应才能进行 C.破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量 D.X和Y的总能量一定低于M和N的总能量 13.下列图像分别表示有关反应的反应过程与能量变化的关系。据此判断下列说法正确的是( ) A.石墨转变为金刚石的反应是吸热反应 B.白磷比红磷稳定 C.S(g)=S(s) ΔH>0 D.H2(g)+I2(g)2HI(g) ΔH>0 14.如图在盛有水的烧杯中,铁圈和铜圈的连接处吊着一根绝缘的细丝,使之平衡。小心地从烧杯中央滴入硫酸铜溶液。片刻后可观察到的现象是(指悬吊的金属圈)( ) A.铁圈和铜圈左右摇摆不定 B.保持平衡状态不变 C.铁圈向下倾斜 D.铜圈向下倾斜 15.汽车的启动电源常用铅蓄电池。其结构如图所示,放电时的电池反应为PbO2+Pb+2H2SO4=2PbSO4+2H2O。根据此反应判断下列说法正确的是( ) A.PbO2是电池的负极 B.Pb是电池的负极 C.PbO2得电子,被氧化 D.电池放电时,溶液的酸性增强 16.如图所示,电流表指针发生偏转,同时A极质量减少,B极上有气泡产生,C为电解质溶液, 下列说法错误的是( ) A.B极为原电池的正极 B.A、B、C可能分别为Zn、Cu、稀盐酸 C.C中阳离子向A极移动 D.A极发生氧化反应 17.某同学根据化学反应,并利用实验室材料制备原电池.下列关于该原电池的组成及现象描述正确的是( ) A.A B.B C.C D.D 选项 A B C D 正极 碳棒 碳棒 铁棒 碳棒 负极 铁棒 铁棒 锌片 铁棒 电解质 溶液 溶液 溶液 溶液 现象 铁棒变细,碳棒周围溶液黄色变浅 铁棒变细,碳棒变粗 锌棒变细,铁棒变粗 铁棒变细,碳棒不变 18.分析下图所示的四个原电池装置,其中结论正确的是( ) A.①②中Mg作负极,③④中Fe作负极 B.②中Mg作正极,电极反应式为6H2O+6e−6OH−+3H2↑ C.③中Fe作负极,电极反应式为Fe−3e−Fe3+ D.④中Cu作正极,电极反应式为2H++2e−H2↑ 二、填空题 19.元素周期表是指导化学学习的重要工具,下图为元素周期表的一部分,请按要求填空: (1)N在元素周期表中的位置是______________ ;N和F处于同一行,是由于它们的 __________ 相同。 (2)以上元素中,原子半径最小的是 ________ (写元素符号);最高价氧化物对应水化物中酸性最强的是 ______________ (写化学式)。 (3)Mg和Al中,金属性较强的是 __________ (写元素符号),写出一条能说明该结论的事实_________________________________。 (4) S和Cl中,非金属性较强的是 __________ (写元素符号),不能说明该结论的事实是_________。 a.氯气与铁反应生成 FeCl3,硫与铁反应生成FeS b.把 Cl2通入 H2S溶液中能发生置换反应 c.受热时 H2S易分解,HCl不易分解 d.单质硫是固体,氯的单质是气体 20.(1)用电子式表示H2O和MgBr2的形成过程: H2O_________ MgBr2__________ (2)写出CO2、Na2O2、H2O2的电子式: CO2___________Na2O2________ H2O2________ 21.现有我们熟悉的物质:①O2;②金刚石;③NaBr;④H2SO4;⑤Na2CO3;⑥NH4Cl;⑦NaHSO4;⑧Ne;⑨Na2O2;⑩NaOH。 (1)这些物质中,只含共价键的是___________(填序号,下同);只含离子键的是____________;既含共价键又含离子键的是__________;不存在化学键的是_________。 (2)属于共价化合物的是__________(填序号,下同);属于离子化合物的是______________。 (3)将NaHSO4溶于水,破坏了NaHSO4中的_____________,写出电离方程式______________________;NaHSO4熔融状态下电离,破坏了________,写出电离方程式_________________。 22.理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“Cu+2Ag+=2Ag +Cu2+”设制一个化学电池(正极材料用碳棒),回答下列问题: (1)该电池的负极材料是______,发生______反应(填“氧化”或“还原”),电解质溶液是_______; (2)正极上出现的现象是____________; (3)若导线上转移电子1 mol,则生成银______克。 23.如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管中开始放入几小块镁片,再滴入5mL稀盐酸。 回答下列问题: (1)实验中观察到的现象是________________。 (2)产生上述现象的原因是________________。 (3)写出有关反应的离子方程式____________。 (4)由实验推知,MgCl2溶液和H2的总能量________(填“大于”、“小于”或“等于”)镁片和盐酸的总能量。 参考答案 1.D2.C3.D4.A5.C6.A7.B8.B9.D10.A 11.C12.D13.A14.D15.B16.C17.A18.B 23.第二周期第ⅤA族 电子层数 F HClO4 Mg Mg(OH)2碱性强于Al(OH)3 Cl d 24. NH4++OH-=H2O+NH3 25. ①②④ ③ ⑤⑥⑦⑨⑩ ⑧ ④ ③⑤⑥⑦⑨⑩ 离子键和共价键 NaHSO4=Na++H++SO42- 离子键 NaHSO4(熔融)=Na++HSO4- 26.铜棒 氧化 AgNO3 有Ag析出 108 27.镁片上有大量气泡产生,镁片逐渐溶解,烧杯中溶液变浑浊 镁与盐酸反应生成氢气,且该反应放热,Ca(OH)2的溶解度随温度升高而减小,故有固体析出 Mg+2H+=Mg2++H2↑、Ca2++2OH-=Ca(OH)2↓ 小于 查看更多