- 2021-04-17 发布 |
- 37.5 KB |
- 11页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021版高考化学一轮复习核心素养测评十九化学反应与能量的变化含解析新人教版
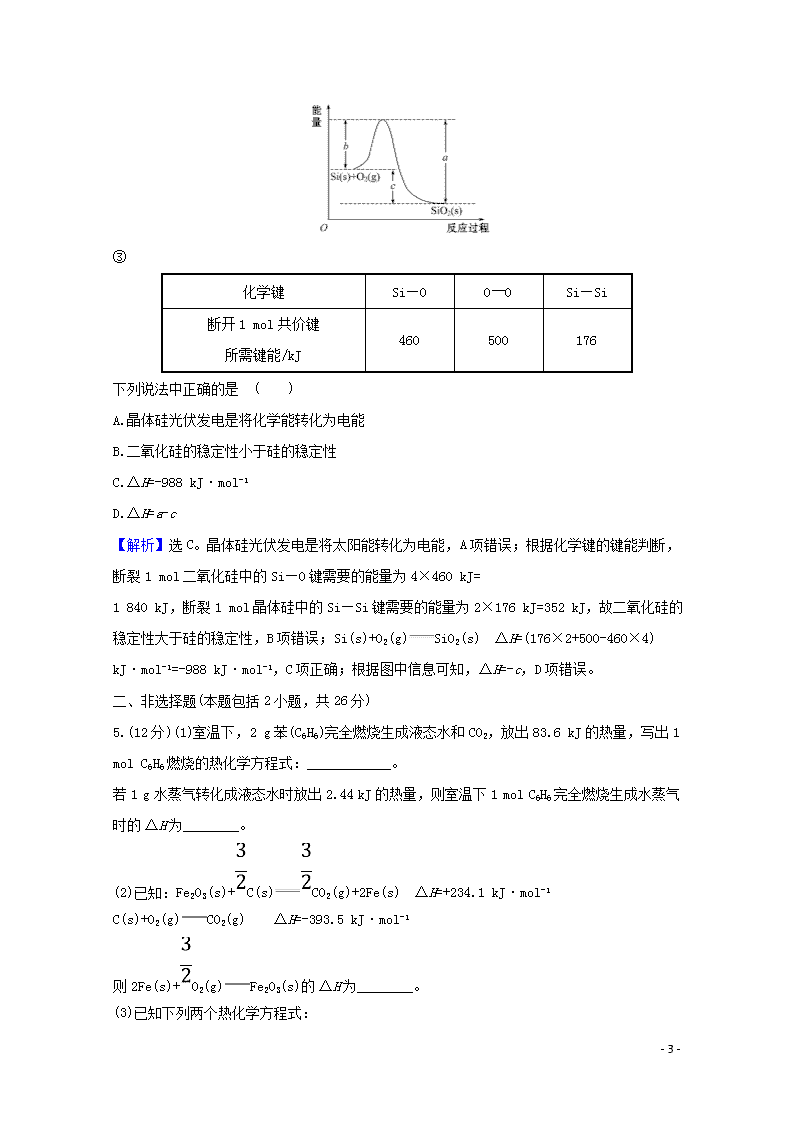
化学反应与能量的变化 一、选择题(本题包括4小题,每题6分,共24分) 1.(双选)(2020·北京平谷区模拟改编)中国研究人员研制一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水,主要过程如图所示: 下列说法不正确的是 ( ) A.整个过程实现了光能向化学能的转化 B.过程Ⅱ吸收能量并生成了O—O键 C.总反应2H2O2H2↑+O2↑ D.过程Ⅲ属于分解反应也是吸热反应 【解析】选B、D。A.由图可知,利用太阳光在催化剂表面实现水分解为氢气和氧气,光能转化为化学能,故A正确;B.过程Ⅱ生成了O—O键,释放能量,故B错误;C.该过程的总反应是水分解为氢气和氧气,故C正确;D.由图可知,过程Ⅲ既有O—H键断裂,也有H—H键形成,由能量高、不稳定的H2O2,转化为能量低、稳定的H2、O2,释放能量,故D错误。 2.根据图中的能量关系,可求得C—H的键能为 ( ) A.414 kJ·mol-1 B.377 kJ·mol-1 C.235 kJ·mol-1 D.197 kJ·mol-1 【解析】选A。根据图示可知1 mol CH4分解变为1 mol C(g)原子和4 mol H(g)原子共吸收的能量是(75+717+864) kJ=1 656 kJ的能量,则C—H键的键能为 1 656 kJ÷4 mol=414 kJ·mol-1。 3.(2020·乌鲁木齐模拟)下列热化学方程式正确的是 ( ) A.CH4的燃烧热为890 kJ·mol-1:CH4(g)+2O2(g)CO2(g)+2H2O(g) - 11 - ΔH=-890 kJ·mol-1 B.中和热ΔH=-57.3 kJ·mol-1:CH3COOH(aq)+NaOH(aq)H2O(l)+CH3COONa(aq) ΔH=-57.3 kJ·mol-1 C.一定条件下,0.5 mol N2与1.5 mol H2充分反应后放出35.5 kJ的热量:N2(g)+3H2(g)2NH3(g) ΔH=-71 kJ·mol-1 D.96 g O2的能量比96 g O3的能量低b kJ:3O2(g)2O3(g) ΔH=+b kJ·mol-1 【解析】选D。表示燃烧热时,生成的水必须为液态, A错误;强酸强碱的稀溶液反应只生成1 mol液态水时放出的热量叫中和热,醋酸为弱酸, B错误;可逆反应不能彻底,0.5 mol N2与1.5 mol H2充分反应后放出35.5 kJ的热量,则1 mol N2与3 mol H2充分反应后放出的热量比71 kJ要大,C错误;反应热与化学计量数成正比关系,反应物总能量比生成物低则为吸热反应,3O2(g)2O3(g) ΔH=+b kJ·mol-1, D正确。 4.(2020·临沂模拟)Li/Li2O体系的能量循环图如图所示。下列说法正确的 是 ( ) A.ΔH3<0 B.ΔH3+ΔH4+ΔH5=ΔH6 C.ΔH6>ΔH5 D.ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=0 【解析】选C。断裂化学键吸收能量,氧气断裂化学键变为氧原子过程中吸热,ΔH3>0, A错误;由盖斯定律分析可知:反应一步完成与分步完成的热效应相同,ΔH1+ΔH2+ΔH3+ΔH4+ΔH5=ΔH6, B错误;由能量转化关系和盖斯定律的计算可知,反应一步完成与分步完成的热效应相同,ΔH1+ΔH2+ΔH3+ΔH4+ΔH5=ΔH6,ΔH6>ΔH5, C正确;由盖斯定律计算得到,反应过程中的焓变关系为ΔH1+ΔH2+ΔH3+ΔH4+ΔH5=ΔH6,D错误。 【加固训练】 已知:①1 mol晶体硅中含有2 mol Si—Si键。②Si(s)+O2(g)SiO2(s) ΔH,其反应过程与能量变化如图所示。 - 11 - ③ 化学键 Si—O OO Si—Si 断开1 mol共价键 所需键能/kJ 460 500 176 下列说法中正确的是 ( ) A.晶体硅光伏发电是将化学能转化为电能 B.二氧化硅的稳定性小于硅的稳定性 C.ΔH=-988 kJ·mol-1 D.ΔH=a-c 【解析】选C。晶体硅光伏发电是将太阳能转化为电能,A项错误;根据化学键的键能判断,断裂1 mol二氧化硅中的Si—O键需要的能量为4×460 kJ= 1 840 kJ,断裂1 mol晶体硅中的Si—Si键需要的能量为2×176 kJ=352 kJ,故二氧化硅的稳定性大于硅的稳定性,B项错误;Si(s)+O2(g)SiO2(s) ΔH=(176×2+500-460×4) kJ·mol-1=-988 kJ·mol-1,C项正确;根据图中信息可知,ΔH=-c,D项错误。 二、非选择题(本题包括2小题,共26分) 5.(12分)(1)室温下,2 g苯(C6H6)完全燃烧生成液态水和CO2,放出83.6 kJ的热量,写出1 mol C6H6燃烧的热化学方程式:____________。 若1 g 水蒸气转化成液态水时放出2.44 kJ的热量,则室温下1 mol C6H6完全燃烧生成水蒸气时的ΔH为________。 (2)已知:Fe2O3(s)+C(s)CO2(g)+2Fe(s) ΔH=+234.1 kJ·mol-1 C(s)+O2(g)CO2(g) ΔH=-393.5 kJ·mol-1 则2Fe(s)+O2(g)Fe2O3(s)的ΔH为________。 (3)已知下列两个热化学方程式: - 11 - H2(g)+O2(g)H2O(l) ΔH=-285.8 kJ·mol-1 C3H8(g)+5O2(g)3CO2(g)+4H2O(l) ΔH=-2 220.0 kJ·mol-1 ①实验测得H2和C3H8的混合气体共5 mol,完全燃烧生成液态水时放热 6 262.5 kJ,则混合气体中H2和C3H8的体积之比约为________。 ②已知:H2O(l)H2O(g) ΔH=+44.0 kJ·mol-1,求丙烷燃烧生成CO2和气态水的ΔH为________。 【解析】(1)C6H6(l)+O2(g)3H2O(l)+6CO2(g) ΔH=-83.6 kJ÷= -3 260.4 kJ·mol-1。若1 g 水蒸气转化成液态水时放出2.44 kJ的热量,则H2O(l)H2O(g) ΔH=+2.44 kJ÷=43.92 kJ·mol-1,故1 mol C6H6完全燃烧生成水蒸气时的ΔH=-3 260.4 kJ·mol-1+3×43.92 kJ·mol-1= -3 128.64 kJ·mol-1。 (2)由第二个热化学方程式×-第一个热化学方程式得2Fe(s)+O2(g)Fe2O3(g) ΔH=×(-393.5 kJ·mol-1)-(+234.1 kJ·mol-1)=-824.35 kJ·mol-1。 (3)①设氢气和丙烷的物质的量分别为x mol和y mol,则有,解得x≈2.5,y≈2.5,故x∶y≈1∶1。 ②H2O(l)H2O(g) ΔH=+44.0 kJ·mol-1,C3H8(g)+5O2(g)3CO2(g)+4H2O(l) ΔH=-2 220.0 kJ·mol-1,根据盖斯定律,由上面第一个热化学方程式×4+上面第二个热化学方程式可得出丙烷燃烧生成CO2和H2O(g)的热化学方程式为C3H8(g)+5O2(g)3CO2(g)+4H2O(g) ΔH=-2 044.0 kJ·mol-1。 答案:(1)C6H6(l)+O2(g)3H2O(l)+6CO2(g) ΔH=-3 260.4 kJ·mol-1 -3 128.64 kJ·mol-1 (2)-824.35 kJ·mol-1 - 11 - (3)①1∶1 ②-2 044.0 kJ·mol-1 6.(14分)(2020·九江模拟)已知E1=134 kJ·mol-1、E2=368 kJ·mol-1,请参考题中图表,按要求填空: (1)图甲是1 mol NO2(g)和1 mol CO(g)反应生成CO2(g)和NO(g)过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率加快,E1的变化是________(填“增大”“减小”或“不变”,下同),ΔH的变化是________。请写出NO2和CO反应的热化学方程式:_________________。 (2)捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应: 反应Ⅰ:2NH3(l)+H2O(l)+CO2(g)(NH4)2CO3(aq) ΔH1 反应Ⅱ:NH3(l)+H2O(l)+CO2(g)NH4HCO3(aq) ΔH2 反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)2NH4HCO3(aq) ΔH3 则ΔH3与ΔH1、ΔH2之间的关系是ΔH3=____________________。 (3)下表所示是部分化学键的键能参数。 化学键 P—P P—O OO PO 键能/kJ·mol-1 a b c x 已知P4(g)+5O2(g)P4O10(g) ΔH=-d kJ·mol-1,P4及P4O10的结构如图乙所示。表中x=________ kJ·mol-1。(用含a、b、c、d的代数式表示) 【解析】(1)加入催化剂,降低反应的活化能,即E1减小,反应的焓变不变。由图示知,1 mol NO2(g)与1 mol CO(g)反应的焓变ΔH=E1-E2=-234 kJ·mol-1,由此可写出反应的热化学方程式。(2)由盖斯定律知,反应Ⅲ=2×反应Ⅱ-反应Ⅰ,故ΔH3=2ΔH2-ΔH1。(3)P4(g)+5O2(g)P4O10(g) ΔH=-d kJ·mol-1,由“反应焓变=反应物键能之和—生成物键能之和”可得-d=6a+5c-(12b+4x),解得x=(d+6a+5c-12b)。 - 11 - 答案:(1)减小 不变 NO2(g)+CO(g)CO2(g)+NO(g) ΔH=-234 kJ·mol-1 (2)2ΔH2-ΔH1 (3)(d+6a+5c-12b) 一、选择题(本题包括3小题,每题6分,共18分) 1.(双选)(2020年山东等级考模拟)热催化合成氨面临的两难问题是采用高温增大反应速率的同时会因平衡限制导致NH3产率降低。我国科研人员研制了Ti·H·Fe双温区催化剂(Ti-H区域和Fe区域的温度差可超过100 ℃)。Ti-H-Fe双温区催化合成氨的反应历程如图所示,其中吸附在催化剂表面上的物质用*标注。下列说法正确的是 ( ) A.①为氮氮三键的断裂过程 B.①②③在高温区发生,④⑤在低温区发生 C.④为N原子由Fe区域向Ti-H区域的传递过程 D.使用Ti-H-Fe双温区催化剂使合成氨反应转变为吸热反应 【解析】选B、C。A选项,经历①过程之后氮气分子被催化剂吸附,并没有变成氮原子,所以A错误。B选项,①为催化剂吸附N2的过程,②为形成过渡态的过程,③为N2解离为N的过程,以上都需要在高温时进行。④⑤在低温区进行是为了增加平衡产率,所以B正确。C选项,由题中图示可知,过程④完成了 Ti—H—Fe—*N到Ti—H—*N—Fe两种过渡态的转化,N原子由Fe区域向Ti—H区域传递,C正确。D选项,化学反应不会因加入催化剂而改变吸放热情况,所以D错误。 2.(双选)已知:①CO(g)+2H2(g)CH3OH(g) ΔH1=-116 kJ·mol-1 ②H2(g)+O2(g)H2O(g) ΔH2=-242 kJ·mol-1 CO具有类似N2结构,某些化学键的键能数据如表: 化学键 C—H H—H C—O H—O - 11 - 键能/kJ·mol-1 413 436 358 463 下列叙述正确的是 ( ) A.CO键的键能为728 kJ·mol-1 B.可求CH3OH(g)+O2(g)CO2(g)+2H2O(g)的反应热ΔH C.OO键的键能为496 kJ·mol-1 D.H2的燃烧热大于242 kJ·mol-1 【解析】选C、D。由CO(g)+2H2(g)CH3OH(g) ΔH1=-116 kJ·mol-1,焓变=反应物键能之和-生成物键能之和,依据图表提供的化学键的键能计算得到:ΔH1=ECO+2EH-H-3EC-H-EC-O-EH-O=ECO+2×436 kJ·mol-1-(3×413 kJ·mol-1+ 358 kJ·mol-1+463 kJ·mol-1)=-116 kJ·mol-1,可得CO键的键能为1 072 kJ·mol-1,A错误;要求CH3OH(g)+O2(g)CO2(g)+2H2O(g)的反应热ΔH,利用化学键的键能计算,则需CO键的键能数据。若要利用盖斯定律计算,需要知道CO(g)+O2(g)CO2(g)的反应热ΔH,要求此反应的ΔH,也需CO键的键能数据,B错误;H2(g)+O2(g)H2O(g) ΔH2=-242 kJ·mol-1,焓变=反应物键能之和-生成物键能之和,依据图表提供的化学键的键能计算得到:ΔH2=EH-H+-2EH-O=436 kJ·mol-1+-2×463 kJ·mol-1=-242 kJ·mol-1,可得OO键的键能为496 kJ·mol-1,C正确;由燃烧热的定义知,D正确。 3.常温下,0.01 mol·L-1MOH溶液的pH为10。已知:2MOH(aq)+H2SO4(aq)M2SO4(aq)+2H2O(l) ΔH1=-24.2 kJ·mol-1;H+(aq)+OH-(aq)H2O(l) ΔH2=-57.3 kJ·mol-1。则MOH在水溶液中电离的ΔH为 ( ) A.+33.1 kJ·mol-1 B.+45.2 kJ·mol-1 C.-81.5 kJ·mol-1 D.-33.1 kJ·mol-1 【解析】选B。根据题中0.01 mol·L-1 MOH溶液的pH=10,知MOH为弱碱,MOH溶液与硫酸的中和反应可以看作两个过程:MOH(aq)M+(aq)+OH-(aq) ΔH、H+(aq)+OH-(aq)H2 - 11 - O(l) ΔH2,根据盖斯定律知ΔH1=2(ΔH+ΔH2),则ΔH=ΔH1-ΔH2=(-24.2 kJ·mol-1)×-(-57.3 kJ·mol-1)=+45.2 kJ·mol-1,B正确。 【加固训练】 下列图示与对应的叙述相符的是 ( ) A.图甲中的ΔH1>ΔH2 B.图乙表示可逆反应A(s)+3B(g)2C(g) ΔH>0 C.图丙表示充满NO2气体的试管,倒置于水槽中,向其中缓慢通入氧气直至试管中全部充满水,假设溶质不扩散,溶质的物质的量浓度与通入氧气的体积关系 D.由图丁可说明烯烃与H2的加成反应是放热反应,虚线表示在有催化剂的条件下进行 【解析】选C。ΔH1、ΔH2、ΔH3均小于零,且ΔH1=ΔH2+ΔH3,故A错误;平衡常数不会随压强的改变而改变,故B错误;试管中发生的总反应为4NO2+O2+2H2O4HNO3,所以随氧气通入,溶质的物质的量浓度不变,故C正确;催化剂会降低反应的活化能,故D错误。 二、非选择题(本题包括2小题,共32分) 4.(16分)(2019·石家庄模拟)碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质。请回答下列问题: (1)有机物M经过太阳光照射可转化成N,转化过程如下: 该反应的ΔH=+88.6 kJ·mol-1。则M、N相比,较稳定的是________。 - 11 - (2)已知CH3OH(l)的燃烧热ΔH=-726.5 kJ·mol-1, CH3OH(l)+O2(g)CO2(g) +2H2(g) ΔH=-a kJ·mol-1,则a________(填“>”“<”或“=”)726.5。 (3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145 kJ热量,写出该反应的热化学方程式: __。 (4)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s) 2Al2O3(s)+3TiC(s) ΔH=-1 176 kJ·mol-1,反应过程中,每转移1 mol电子放出的热量为________。 【解析】(1)有机物M经过太阳光照射可转化成N,该反应的ΔH=+88.6 kJ·mol-1,是吸热反应,N在暗处转化为M,是放热反应,物质的能量越低越稳定,说明M较稳定。(2)燃烧热是指1 mol纯物质完全燃烧生成稳定氧化物时放出的热量,甲醇燃烧生成CO2(g)和H2(g)属于不完全燃烧,放出的热量小于燃烧热。(3)已知有1 mol Cl2参与反应时释放出145 kJ热量,则2 mol氯气参与反应放热 290 kJ,故Cl2和H2O(g)通过灼热的炭层发生反应的热化学方程式为2Cl2(g) +2H2O(g) +C(s)4HCl(g) +CO2(g) ΔH=-290 kJ·mol-1。 (4)由4Al(s) +3TiO2(s) +3C(s)2Al2O3(s)+3TiC(s) ΔH=-1 176 kJ·mol-1,可知转移12 mol电子放热1 176 kJ,则反应过程中,每转移1 mol电子放热98 kJ。 答案:(1)M (2)< (3)2Cl2(g)+2H2O(g)+C(s)4HCl(g) +CO2(g) ΔH=-290 kJ·mol-1 (4)98 kJ 5.(16分) (1)下列三个反应在某密闭容器中进行: 反应①:Fe(s)+CO2(g)FeO(s)+CO(g) ΔH1=a kJ·mol-1 反应②:2CO(g)+O2(g)2CO2(g) ΔH2=b kJ·mol-1 反应③:2Fe(s)+O2(g)2FeO(s) ΔH3=________ kJ·mol-1(用含a、b的代数式表示)。 (2)焦炭与CO、CO2、H2均是重要的化工原料,由CO2制备甲醇的过程可能涉及的反应如下: 反应Ⅰ:CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH1=-49.58 kJ·mol-1 反应Ⅱ:CO2(g)+H2(g)CO(g)+H2O(g) ΔH2=+41.19 kJ·mol-1 反应Ⅲ:CO(g)+2H2(g)CH3OH(g) ΔH3 则反应Ⅲ的ΔH3=________ kJ·mol-1。 - 11 - (3)一种煤炭脱硫技术可以把硫元素以CaSO4的形式固定下来,但产生的CO又会与CaSO4发生化学反应,相关的热化学方程式如下: ①CaSO4(s)+CO(g)CaO(s)+SO2(g)+CO2(g) ΔH1=+210.5 kJ·mol-1 ②CaSO4(s)+CO(g)CaS(s)+CO2(g) ΔH2=-47.3 kJ·mol-1 反应:CaO(s)+3CO(g)+SO2(g)CaS(s)+3CO2(g)的ΔH=________ kJ·mol-1。 (4)根据下列3个热化学方程式: ①Fe2O3(s)+3CO(g)2Fe(s)+3CO2(g) ΔH1=-24.8 kJ·mol-1 ②3Fe2O3(s)+CO(g)2Fe3O4(s)+CO2(g) ΔH2=-47.2 kJ·mol-1 ③Fe3O4(s)+CO(g)3FeO(s)+CO2(g) ΔH3=+19.4 kJ·mol-1 写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学方程式:__________。 【解析】(1)分析反应①和②,根据盖斯定律,由①×2+②可得2Fe(s)+ O2(g)2FeO(s),则有ΔH3=2ΔH1+ΔH2=2a kJ·mol-1+b kJ·mol-1=(2a+b) kJ·mol-1。(2)分析反应Ⅰ、Ⅱ及Ⅲ,根据盖斯定律,由反应Ⅰ-Ⅱ可得反应Ⅲ,则有ΔH3=ΔH1-ΔH2=(-49.58 kJ·mol-1)-(+41.19 kJ·mol-1)=-90.77 kJ·mol-1。(3)根据盖斯定律,由②×4-①可得CaO(s)+3CO(g)+SO2(g)CaS(s)+3CO2(g),则有ΔH=4ΔH2-ΔH1=(-47.3 kJ·mol-1)×4-(+210.5 kJ·mol-1)=-399.7 kJ·mol-1。 (4)分析已知的三个热化学方程式,根据盖斯定律,由①×3-②-③×2可得6CO(g)+6FeO(s)6Fe(s)+6CO2(g),则有ΔH=(-24.8 kJ·mol-1)×3- (-47.2 kJ·mol-1)-(+19.4 kJ·mol-1)×2=-66 kJ·mol-1,从而可得热化学方程式:CO(g)+FeO(s)Fe(s)+CO2(g) ΔH=-11 kJ·mol-1。 答案:(1)(2a+b) (2)-90.77 (3)-399.7 (4)CO(g)+FeO(s)Fe(s)+CO2(g) ΔH=-11 kJ·mol-1 - 11 - - 11 -查看更多