- 2021-04-17 发布 |
- 37.5 KB |
- 36页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018届高考二轮复习第二篇答题评分原则二、压轴题评分细则示例学案
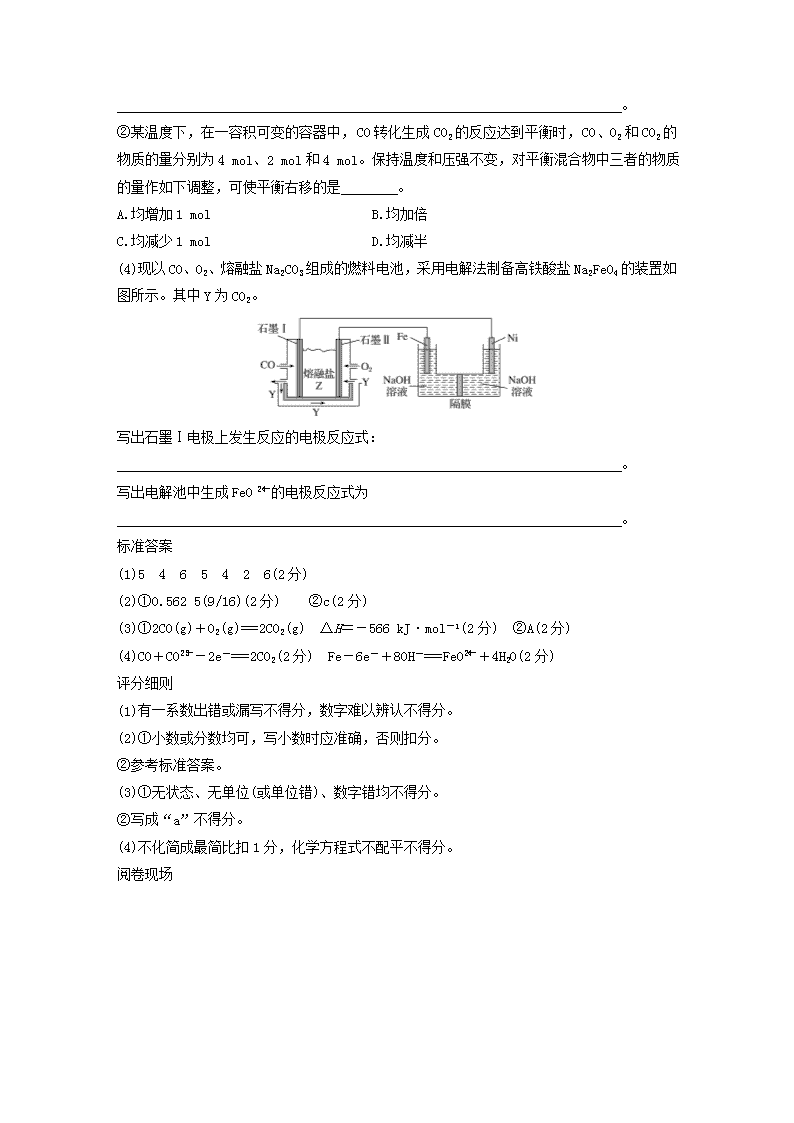
二、压轴题评分细则示例 (一)基本概念、基本理论综合题 (14分)《华北电力大学学报(社会科学版)》2014年第2期的文章《欧盟暂停征收航空碳排放税的法律思考》,该文章从欧盟暂停征收航空碳排放税的背景入手,分析了欧盟征收航空碳排放税的争议焦点所在,最后对欧盟暂停征收航空碳排放税进行了评析,并提出征收航空碳排放税是未来趋势的观点,希望在反对声中换一个视角来阐述征收航空碳排放税对于环境保护、技术革新和国际法的促进作用。 (1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式: C+ KMnO4+ H2SO4=== CO2↑+ MnSO4+ K2SO4+ H2O (2)活性炭可处理大气污染物NO。在2 L密闭容器中加入NO和活性炭(无杂质),生成气体E和F。当温度分别在T1和T2时,测得各物质平衡时物质的量如下表: 物质 n/mol T/℃ 活性炭 NO E F 初始 2.030 0.100 0 0 T1 2.000 0.040 0.030 0.030 T2 2.005 0.050 0.025 0.025 上述反应T1 ℃时的平衡常数为K1,T2 ℃时的平衡常数为K2。 ①计算K1= 。 ②根据上述信息判断,温度T1和T2的关系是(填序号) 。 a.T1大于T2 b.T1小于T2 c.无法比较 (3)工业上利用CO和水蒸气在一定条件下发生反应制取氢气: CO(g)+H2O(g)CO2(g)+H2(g) ΔH=-41 kJ·mol-1 [已知:2H2O (g)===2H2 (g)+O2 (g) ΔH=+484 kJ·mol-1] ①写出CO完全燃烧生成CO2的热化学方程式: 。 ②某温度下,在一容积可变的容器中, CO转化生成CO2的反应达到平衡时, CO、O2和CO2的物质的量分别为4 mol、2 mol和4 mol。保持温度和压强不变,对平衡混合物中三者的物质的量作如下调整,可使平衡右移的是 。 A.均增加1 mol B.均加倍 C.均减少1 mol D.均减半 (4)现以CO、O2、熔融盐Na2CO3组成的燃料电池,采用电解法制备高铁酸盐Na2FeO4的装置如图所示。其中Y为CO2。 写出石墨Ⅰ电极上发生反应的电极反应式: 。 写出电解池中生成FeO的电极反应式为 。 标准答案 (1)5 4 6 5 4 2 6(2分) (2)①0.562 5(9/16)(2分) ②c(2分) (3)①2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1(2分) ②A(2分) (4)CO+CO-2e-===2CO2(2分) Fe-6e-+8OH-===FeO+4H2O(2分) 评分细则 (1)有一系数出错或漏写不得分,数字难以辨认不得分。 (2)①小数或分数均可,写小数时应准确,否则扣分。 ②参考标准答案。 (3)①无状态、无单位(或单位错)、数字错均不得分。 ②写成“a”不得分。 (4)不化简成最简比扣1分,化学方程式不配平不得分。 阅卷现场 得分技巧 (1)读题要求:坚持三读。 ①泛读,明确有几个条件及求解的问题。 ②细读,圈出关键字、关键词,把握数量关系。 ③精读,深入思考,挖掘隐含信息,尤其是图像、图表中的信息。 (2)做题要求:①看准题目要求,不要答非所问。 ②卷面整洁规范,不要潦草了事。 ③遇难而过,不要强攻拦路虎。 (3)心理要求:“我易人易不大意,人难我难不畏难”——向细心要分数。 类型一 热化学、速率平衡综合题 1.(17分)恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示。[已知:2SO2(g)+O2(g)2SO3(g) ΔH=-196.6 kJ·mol-1] 请回答下列问题: (1)写出能表示硫的燃烧热的热化学方程式: 。 (2)ΔH2= 。 (3)恒温恒容时,1 mol SO2和2 mol O2充分反应,放出热量的数值比|ΔH2| (填“大”、“小”或“相等”)。 (4)将Ⅲ中的混合气体通入足量的NaOH溶液中消耗NaOH的物质的量为 ,若溶液中发生了氧化还原反应,则该过程的离子方程式为 。 (5)恒容条件下,对于反应:2SO2(g)+O2(g)2SO3(g),下列措施中能使n(SO3)/n(SO2)增大的有 (填编号)。 A.升高温度 B.充入He气 C.再充入1 mol SO2(g)和1 mol O2(g) D.使用催化剂 (6)某SO2(g)和O2(g)体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图2所示,若不改变SO2(g)和O2(g)的量,则图中t4时引起平衡移动的条件可能是 ;图中表示平衡混合物中SO3的含量最高的一段时间是 。 (7)各阶段平衡时对应的平衡常数如下表所示: t1~t2 t3~t4 t5~t6 t6~t7 K1 K2 K3 K4 K1、K2、K3、K4之间的关系为 。 类型二 热化学、电化学综合题 2.(13分)利用电化学法生产硫酸,可使绝大多数硫黄直接转化为SO3,在生产硫酸的同时还能化学发电,请回答下列问题: (1)已知下列反应的能量变化示意图: ①1 mol S(g)与O2(g)完全反应生成SO2(g),反应的ΔH (填“>”或“<”)。-297.0 kJ·mol-1 ②写出S(s)与O2(g)反应生成SO3(g)的热化学方程式: 。 (2)下图为电化学法生产硫酸的工艺示意图,电池以固体金属氧化物作电解质,该电解质能传导O2-粒子。 ①正极反应式为 。 ②S(g)在负极发生的反应为 、 。 ③用化学方程式解释装置中稀硫酸转变为浓硫酸的原因 。 ④每生产1 L浓度为98%、密度为1.84 g·mL-1的浓硫酸,理论上可向用电器提供 mol电子,将消耗 mol氧气。 ⑤已知S(g)在负极发生的反应为可逆反应,请分析为提高硫黄蒸气的转化率,该工艺采取的措施有 。 类型三 热化学、电化学、速率平衡、电解质溶液综合题 3.(14分)以下是对化学反应变化过程及结果的研究。请按要求回答问题: (1)关于能量变化的研究 已知:①2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g) ΔH=-a kJ·mol-1 ②CH3OH(l)+O2(g)===CO(g)+2H2O(l) ΔH=-b kJ·mol-1 ③H2O(g)===H2O(l) ΔH=-c kJ·mol-1 则:2CO(g)+O2(g)===2CO2(g) ΔH= kJ·mol-1。 (2)关于反应速率和限度的研究 ①已知25 ℃时有关弱酸的电离平衡常数: 弱酸化学式 CH3COOH HCN H2CO3 电离平衡常数(25 ℃) 1.8×10-5 4.9×10-10 K1=4.3×10-7 K2=5.6×10-11 则等物质的量浓度的a.CH3COONa、b.NaCN、c.Na2CO3、d.NaHCO3溶液的pH由大到小的顺序为 (填编号)。 ②已知: 2SO2(g)+O2(g)2SO3(g) ΔH=-196.6 kJ·mol-1,在一个容积为2 L的容器中加入2 mol SO2和1 mol O2,在某温度下充分反应,经过30 min达到平衡,放出热量176.94 kJ。如果用SO2表示该反应的反应速率,则v(SO2)= 。 ③下图为某温度下,CuS(s)、ZnS(s)、FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液中S2-的浓度、金属阳离子浓度变化情况。如果向三种沉淀中加盐酸,最先溶解的是 (填化学式,下同);向新生成的ZnS浊液中滴入足量含相同浓度的Cu2+、Fe2+的溶液,振荡后,ZnS沉淀会转化为 沉淀。 (3)关于电化学的研究 全钒液流电池是一种新型的绿色环保储能电池。其电池总反应为VO+2H++V2+V3++VO2++H2O。 则充电时阳极反应式为 。 用此电池电解1 L 1 mol·L-1的CuSO4溶液,当转移0.1 mol 电子时,溶液的pH= (不考虑溶液体积的变化)。 [类型一] 标准答案 (1)S(s)+O2(g)===SO2(g) ΔH=-297 kJ·mol-1(2分) (2)-78.64 kJ·mol-1(2分) (3)大(2分) (4)2 mol(2分) 2SO2+O2+4OH-===2SO+2H2O(1分) (5)C(2分) (6)升高温度(2分) t3~t4(2分) (7)K4=K3查看更多