- 2021-04-17 发布 |
- 37.5 KB |
- 4页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019学年高一化学下学期第一次月考试题 新人教版-新版
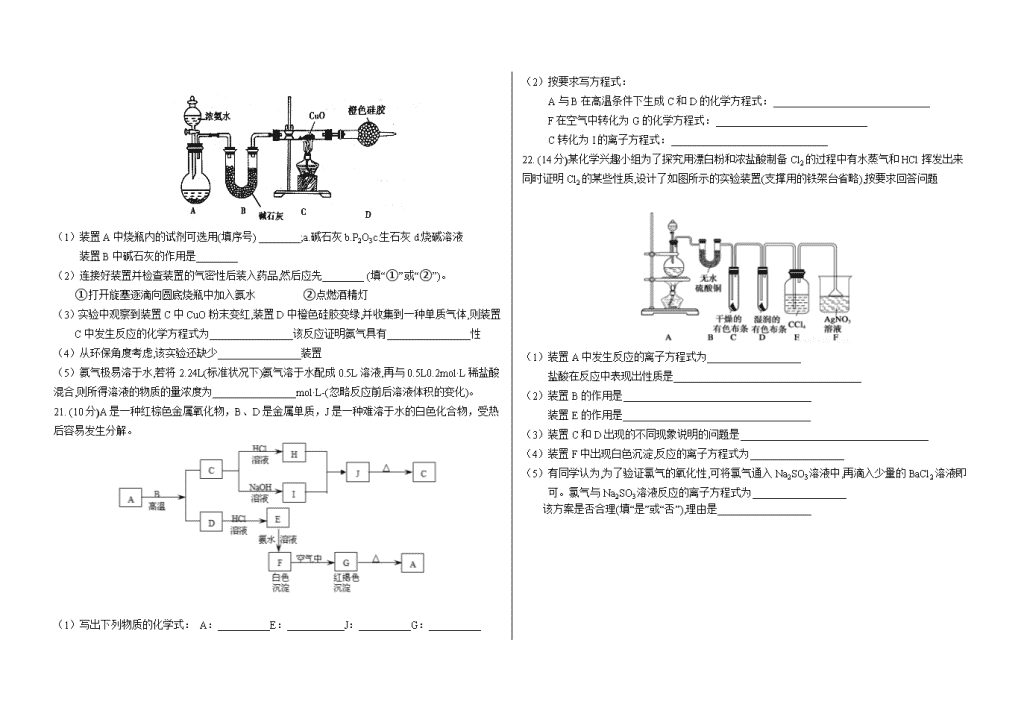
2019 学年高一化学下学期第一次月考试题 试题说明: 1、本试题满分 100 分,答题时间 90 分钟。 2、请将答案填写在答题卡上,考试结束后只交答题卡。 3、可能用到的相对原子质量: H 1 C 12 N 14 O 16 Na 23 Mg 24 Si 28 S 32 Cl 35.5 Ca 40 Fe 56 Cu 64 Ba 137 第Ⅰ卷(选择题 共 54 分) 选择题(本部分共 18 小题,每小题只有一个选项最符合题意,每小题 3 分,共计 54 分) 1.下列说法正确的是( ) A.金属钠着火燃烧时,用泡沫灭火器灭火 B.CO2 通入可溶性硅酸盐中析出硅酸沉淀,所以硅酸的酸性小于碳酸 C.铝比铁活泼,所以铝比铁更容易被腐蚀 D.正常雨水 PH 等于 7,酸雨的 PH 小于 7 2.下列应用涉及氧化还原反应的是( ) A.纯碱用于制造玻璃 B.打磨磁石制指南针 C.工业上利用合成氨实现人工固氮 D.医疗上用小苏打治疗胃酸过多 3.实验室里不同化学试剂的保存方法不尽相同,①KOH 溶液②大理石③NaCl 溶液④硝酸银溶液 4 种试剂通常各自存放在下列图示的某种试剂瓶中,按照试剂瓶的顺序存放试剂序号正确的是 ( ) A. ②③④① B. ②③①④ C. ②①③④ D. ①②③④ 4. 以下实验装置一般不用于分离物质的是( ) 5.下列离子方程式,书写正确的是( ) A.向硝酸银溶液中加盐酸 Ag++C1-=AgCl↓ B.向氢氧化钡溶液中加硫酸溶液 Ba2++SO42-=BaSO4 C.碳酸钙和盐酸反应 CO32-+2H+=H20+CO2↑ D.向稀盐酸溶液中加铁粉 3Fe+6H+=2Fe3++3H2↑ 6. 下列说法正确的是( ) A.SO2有漂白性,所以能使品红溶液、溴水、KMnO4溶液褪色 B.SO2、漂白粉、活性炭、Na2O2 都能使红墨水褪色,其原理相同 C.能使品红溶液褪色的不一定是 SO2 D.SO2 和 Cl2 都能漂白,若将两种气体同时通入,漂白效果会更好 7.在 pH=1 的溶液中,可以大量共存的离子是( ) A. K+、Na+、SO42-、SO32- B. K+、Na+、AlO2-、NO3- C. Na+、K+、HCO3-、Cl- D. NH4+、Mg2+、SO42-、Cl- 8. 下列物质露置于空气中易变质的是 ①氯水②水玻璃③烧碱④漂白粉⑤绿矾⑥亚硫酸钠 A.除⑤外 B.除②③外 C.除②③⑥外 D.全部易变质 9. 下列物质分类的正确组合是( ) 分类组合 纯净物 强电解质 盐 碱性氧化物 A 碱石灰 氨水 纯碱 氧化铝 B 漂白粉 碳酸钙 小苏打 氧化镁 C 水玻璃 硝酸 苏打 过氧化钠 D 液氨 氯化氢 碱式碳酸铜 氧化钠 10.在真空密闭装置中,亚氯酸钠(NaClO2)固体在一定条件下发生分解反应,不可能形成的产物 是( ) A.NaClO3 和 Cl2 B.NaCl 和 O2 C. NaClO3 和 NaClO D.NaClO3 和 NaCl 11.下列各组物质的稀溶液相互反应,无论是前者滴入后者,还是后者滴入前者,反应现象都相同的 是( ) A.NaHSO4 和 Ba(OH)2 B.AlO2 和 H2SO4 C.AlCl3 和 NaOH D.Na2CO3 和 H2SO4 12.某混合气体中可能含有 Cl2、O2、SO2、NO、NO2 中的两种或多种气体。现将此无色透明的混合 气体通过品红溶液后,品红溶液褪色,把剩余气体排入空气中,很快变为红棕色。对于原混合气体 成分的判断正确的是( ) A.肯定有 O2 和 NO B.肯定没有 Cl2、O2 和 NO2 C.可能有 Cl2 和 O2 D.肯定只有 NO 13. 实验室除去 Cl2 中混有的水蒸气和 HCl 气体选用的药品及顺序正确的是( ) A.水 碱石灰 B.无水氯化钙 饱和食盐水 C.饱和食盐水 浓硫酸 D.饱和食盐水 碱石灰 14.CO2 气体中含有少量 SO2,欲得到干燥纯净的 CO2,通过如图所示的洗气瓶,(1)(2)两瓶中所装的 试剂应该是( ) A.(1)NaOH(2)浓 H2SO4 B. (1)浓 H2SO4(2)NaOH C.(1)饱和 NaHCO3(2)浓 H2SO4 D.(1)浓 H2SO4(2)Na2CO3 15. 定量的浓硝酸与过量的铜充分反应,生成的气体是( ) A. 只有 NO2 B. NO2 和 NO C. 只有 NO D. NO2 和 H2 16.把少量 NO2 气体通入过量小苏打溶液中,再使逸出的气体通过装有足量的过氧化钠颗粒的干燥 管,最后收集到的气体是( ) A. 氧气 B. 二氧化氮 C. 二氧化氮和氧气 D.二氧化氮和一氧化氮 17. 下列叙述正确的是( ) A.浓硫酸是一种干燥剂,能够干燥氢气、氧气、氨气等气体,但不能干燥有较强还原性的 HI、 H2S 等气体 B.浓硫酸与单质硫反应的化学方程式为:S+2H2SO4(浓) 3SO2↑+2H2O,在此反应中,浓硫 酸既表现了其强氧化性又表现了其酸性 C.把足量铜粉投入到只含 2 mol H2SO4 的浓硫酸中,得到气体体积在标准状况下为 22.4L D.常温下能够用铁、铝等容器盛放浓 H2SO4,是因为浓 H2SO4 的强氧化性使铁铝等发生钝化 18.0.3molCu2S 和足量 HNO3 反应生成 Cu(NO3)2、H2SO4、NO 和 H2O,则参加反应的 HNO3 中未被还 原的 HNO3 的物质的量为( ) A.2.2 mol B.1.2 mol C.1.0 mol D.0.6 mol 第Ⅱ卷(非选择题 共 46 分) 19.(12 分) (1)洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常 用的消毒剂。 ①工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式_______________________ ②漂白粉溶于水后,受空气中的 CO2 作用,即产生有漂白、杀菌作用的次氯酸,化学反应方 程式为________________________________ (2)按要求书写下列方程式 ①实验室制取氯气化学方程式______________________________ ②实验室制取氨气化学方程式______________________________ ③氨的催化氧化化学方程式______________________ ④碳与浓硫酸化学方程式____________________ 20. (10 分)氨气是一种重要的化工原料,某研究性学习小组利用如图所示的装置制备并探究氨气的 某些性质。请回答下列问题: (1)装置 A 中烧瓶内的试剂可选用(填序号) ________;a.碱石灰 b.P2O3c.生石灰 d.烧碱溶液 装置 B 中碱石灰的作用是________ (2)连接好装置并检查装置的气密性后装入药品,然后应先________ (填“①”或“②”)。 ①打开旋塞逐滴向圆底烧瓶中加入氨水 ②点燃酒精灯 (3)实验中观察到装置 C 中 CuO 粉末变红,装置 D 中橙色硅胶变绿,并收集到一种单质气体,则装置 C 中发生反应的化学方程式为________________该反应证明氨气具有________________性 (4)从环保角度考虑,该实验还缺少________________装置 (5)氨气极易溶于水,若将 2.24L(标准状况下)氨气溶于水配成 0.5L 溶液,再与 0.5L0.2mol·L 稀盐酸 混合,则所得溶液的物质的量浓度为________________mol·L-(忽略反应前后溶液体积的变化)。 21. (10 分)A 是一种红棕色金属氧化物,B、D 是金属单质,J 是一种难溶于水的白色化合物,受热 后容易发生分解。 (1)写出下列物质的化学式: A:__________E:___________J:__________G:__________ (2)按要求写方程式: A 与 B 在高温条件下生成 C 和 D 的化学方程式:______________________________ F 在空气中转化为 G 的化学方程式:_____________________________ C 转化为 I 的离子方程式:______________________________ 22. (14 分)某化学兴趣小组为了探究用漂白粉和浓盐酸制备 Cl2 的过程中有水蒸气和 HCl 挥发出来 同时证明 Cl2 的某些性质,设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题 (1)装置 A 中发生反应的离子方程式为__________________ 盐酸在反应中表现出性质是____________________________________ (2)装置 B 的作用是____________________________________ 装置 E 的作用是____________________________________ (3)装置 C 和 D 出现的不同现象说明的问题是____________________________________ (4)装置 F 中出现白色沉淀,反应的离子方程式为__________________ (5)有同学认为,为了验证氯气的氧化性,可将氯气通入 Na2SO3 溶液中,再滴入少量的 BaCl2 溶液即 可。氯气与 Na2SO3 溶液反应的离子方程式为__________________ 该方案是否合理(填“是”或“否”),理由是__________________ 参考答案 试题说明:1、本试题满分 100 分,答题时间 90 分钟。 2、请将答案填写在答题卡上,考试结束后只交答题卡。 一、选择题(每小题只有一个选项正确,每小题 3 分,共 54 分。) 1 2 3 4 5 6 7 8 9 B C C D A C D B D 10 11 12 13 14 15 16 17 18 A A B C C B C D B 二、填空题(每空 2 分;第 19 题,12 分;第 20 题,10 分。共 22 分) 19. (1)①工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O ②漂白粉溶于水后,受空气中的 CO2 作用,即产生有漂白、杀菌作用的次氯酸,化 学反应方程式为 Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO (2)①实验室制取氯气化学方程式 MnO2+4HCl Cl2↑+MnCl2+2H2O ②实验室制取氨气化学方程式 Ca(OH)2+2NH4Cl CaCl2+2NH3↑+2H2O ③氨的催化氧化化学方程式 4NH3 + 5O2=(催化剂,△) 4NO + 6H2O ④碳与浓硫酸化学方程式 C+2H2SO4 CO2↑+2SO2↑+2H2O 20. (10 分) (1)ac 干燥氨气 (2)① (3)3CuO+ 2 NH3 3Cu +N2 + 3H2O ;还原 (4)尾气吸收 (5)0.1 三、推断题(10 分) 21.(1)Fe2O3;FeCl2;Al(OH)3;Fe(OH)3 (2)2Al+Fe2O3 2Fe+Al2O3;4Fe(OH)2+O2+2H2O==4Fe(OH)3; Al2O3+2OH-==2AlO2-+H2O 四、实验题(14 分) 22. (1)ClO-+ Cl-+ 2H+= H2O+H2 还原性,酸性 (2)证明有水蒸气产生,并吸收水蒸气,避免对后面探究氯气的性质实验产生干 扰 吸收氯气 (3)干燥氯气无漂白性,次氯酸有漂白性 (4)Ag++Cl-= AgCl↓ (5)Cl2 +SO3 +H2SO4 = 2Cl-+ SO42-+2H+ 否 若 Na2SO3 溶液过量,BaCl2 与也能 BaSO3 生成干扰实验查看更多