- 2021-04-17 发布 |
- 37.5 KB |
- 3页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高中化学历年高考题分类汇编5化学反应与热量-选择题-练习
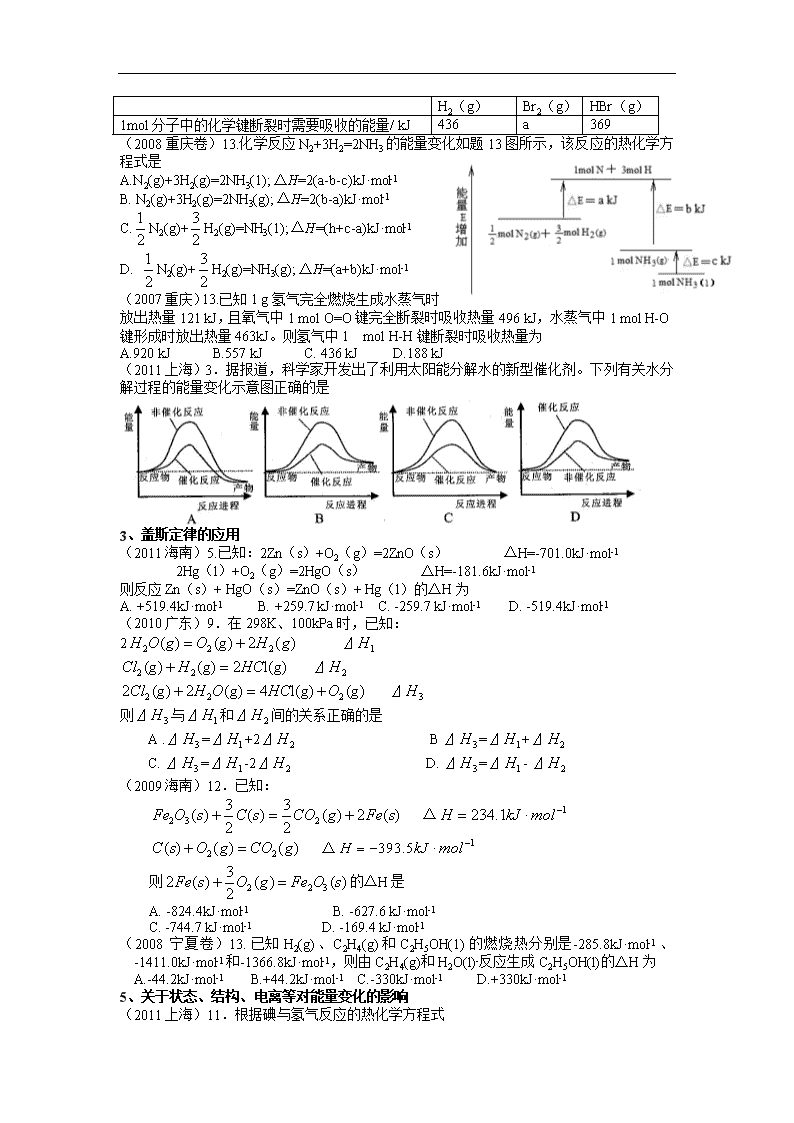
五、化学反应与热量 选择题 练习 1、基本概念 (2010山东)10.下列与化学反应能量变化相关的叙述正确的是 A.生成物总能量一定低于反应物总能量 B.放热反应的反应速率总是大于吸热反应的反应速率 C.应用盖斯定律,可计算某些难以直接测量的反应焓变 D.同温同压下,H2(g)+Cl2(g) 2HCl(g)在光照和点燃条件下的△H不同 (2009上海)5.下列对化学反应的认识错误的是 A.会引起化学键的变化 B.会产生新的物质 C.必然引起物质状态的变化 D.必然伴随着能量的变化 (2009天津)6.已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol Na2O2(s)+CO2(g)=Na2CO3(s)+ O2(g) ΔH=-226 kJ/mol 根据以上热化学方程式判断,下列说法正确的是 A.CO的燃烧热为283 kJ B.右图可表示由CO生成CO2的反应过程和能量关系 C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-452 kJ/mol D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023 (2009重庆)12.下列热化学方程式书写正确的是(ΔH的绝对值均正确) A.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g);△H=-1367.0 kJ/mol(燃烧热) B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);△H=+57.3kJ/mol(中和热) C.S(s)+O2(g)=SO2(g);△H=-296.8kJ/mol(反应热) D. 2NO2=O2+2NO;△H=+116.2kJ/mol(反应热) (2008四川卷)7.下列关于热化学反应的描述中正确的是 A.HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热 ΔH=2×(-57.3)kJ/mol B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g) =2CO(g)+O2(g)反应的 ΔH=+2×283.0kJ/mol C.需要加热才能发生的反应一定是吸热反应 D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷燃烧热 (2008上海卷)17.已知:H2(g)+F2(g)→2HF(g) ΔH=-270kJ/mol,下列说法正确的是 A.2L氟化氢气体分解成1L氢气与1L氟气吸收270kJ热量 B.1mol氢气与1mol氟气反应生成2mol液态氟化氢放出热量小于270kJ C.在相同条件下,1mol氢气与1mol氟气的能量总和大于2mol氟化氢气体的能量 D.1个氢气分子与1个氟气分子反应生成2个氟化氢气体分子放出270热量 (2007全国2)9.已知:①1 mol H2分子中化学键断裂时需要吸收436kJ的能量 ②1 mol Cl2分子中化学键断裂时需要吸收243kJ的能量 ③由H原子和Cl原子形成1 mol HCl分子时释放431kJ的能量 下列叙述正确的是 A.氢气和氯气反应生成氯化氢气体的热化学方程式是H2(g)+Cl2(g)=2HCl(g) B.氢气和氯气反应生成2 mol氯化氢气体,反应的△H=183kJ/mol C.氢气和氯气反应生成2 mol氯化氢气体,反应的△H=-183kJ/mol D.氢气和氯气反应生成1 mol氯化氢气体,反应的△H=-183kJ/mol 2、吸热、放热的解释 (2011重庆)13.SF6是一种优良的绝缘气体,分子结构中存在S-F键。已知1molS(s)转化为气态硫原子吸收能量280kJ,断裂1molF-F、S-F键需吸收的能量分别为160kJ、330kJ,则S(s) + 3F2(g)= SF6(g)的反应热△H为 A.-1780 kJ·mol-1 B.-1220 kJ·mol-1 C.-450 kJ·mol-1 D.+430 kJ·mol-1 (2010重庆)12.已知H2(g)+Br2 (l)=2HBr(g);△H= -72KJ/mol,蒸发1molBr2 (l)需要吸收的能量为30KJ,其它相关数据如下表,则表中a为 ( ) A 404 B 260 C 230 D 200 H2(g) Br2(g) HBr(g) 1mol分子中的化学键断裂时需要吸收的能量/ kJ 436 a 369 (2008重庆卷)13.化学反应N2+3H2=2NH3的能量变化如题13图所示,该反应的热化学方程式是 A.N2(g)+3H2(g)=2NH3(1); △H=2(a-b-c)kJ·mol-1 B. N2(g)+3H2(g)=2NH3(g); △H=2(b-a)kJ·mol-1 C.N2(g)+H2(g)=NH3(1); △H=(h+c-a)kJ·mol-1 D. N2(g)+H2(g)=NH3(g); △H=(a+b)kJ·mol-1 (2007重庆)13.已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H-O键形成时放出热量463kJ。则氢气中1 mol H-H键断裂时吸收热量为 A.920 kJ B.557 kJ C. 436 kJ D.188 kJ (2011上海)3.据报道,科学家开发出了利用太阳能分解水的新型催化剂。下列有关水分解过程的能量变化示意图正确的是 3、盖斯定律的应用 (2011海南)5.已知:2Zn(s)+O2(g)=2ZnO(s) △H=-701.0kJ·mol-1 2Hg(l)+O2(g)=2HgO(s) △H=-181.6kJ·mol-1 则反应Zn(s)+ HgO(s)=ZnO(s)+ Hg(l)的△H为 A. +519.4kJ·mol-1 B. +259.7 kJ·mol-1 C. -259.7 kJ·mol-1 D. -519.4kJ·mol-1 (2010广东)9.在298K、100kPa时,已知: 2 ⊿ ⊿ ⊿ 则⊿与⊿和⊿间的关系正确的是 A .⊿=⊿+2⊿ B ⊿=⊿+⊿ C. ⊿=⊿-2⊿ D. ⊿=⊿- ⊿ (2009海南)12.已知: △· △· 则的△H是 A. -824.4kJ·mol-1 B. -627.6 kJ·mol-1 C. -744.7 kJ·mol-1 D. -169.4 kJ·mol-1 (2008宁夏卷)13.已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是-285.8kJ·mol-1、-1411.0kJ·mol-1和-1366.8kJ·mol-1,则由C2H4(g)和H2O(l)-反应生成C2H5OH(l)的△H为 A.-44.2kJ·mol-1 B.+44.2kJ·mol-1 C.-330kJ·mol-1 D.+330kJ·mol-1 5、关于状态、结构、电离等对能量变化的影响 (2011上海)11.根据碘与氢气反应的热化学方程式 (i) I2(g)+ H2(g) 2HI(g) △H=-9.48 kJ (ii) I2(s)+ H2(g)2HI(g) △H=+26.48 kJ 下列判断正确的是 A.254g I2(g)中通入2gH2(g),反应放热9.48 kJ B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ C.反应(i)的产物比反应(ii)的产物稳定 D.反应(ii)的反应物总能量比反应(i)的反应物总能量低 (2010新课标)11.己知:HCN(aq)与NaOH(aq)反应的△H=-12.1kJ·mol-1;HCl(aq)与NaOH(aq)反应的△H=-55.6kJ·mol-1。则HCN在水溶液中电离的△H等于 A.-66.7kJ·mol-1 B.-43.5kJ·mol-1 C.+43.5kJ·mol-1 D. +66.7kJ·mol-1 (2007上海)14. 已知:CH3CH2CH2CH3(g)+6.5O2(g)→4CO2(g)+5H2O(l)△H=-2878kJ/mol (CH3)2CHCH3(g)+6.5O2(g)→4CO2(g)+5H2O(l) △H=-2869kJ/mol 下列说法正确的是 A 正丁烷分子储存的能量大于异丁烷分子 B 正丁烷的稳定性大于异丁烷 C 异丁烷转化为正丁烷的过程是一个放热过程 D 异丁烷分子中的碳氢键比正丁烷的多 6、其它综合性问题 (2011北京)10.25℃、101kPa 下:①2Na(s)+1/2O2(g)=Na2O △H=-414kJ·mol-1 ②2Na(s)+ O2(g)=Na2O2 △H=-511kJ·mol-1 下列说法正确的是 A.①和②产物的阴阳离子个数比不相等 B.①和②生成等物质的量的产物,转移电子数不同 C.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快 D.25℃、101kPa 下:Na2O2(s)+2 Na(s)= 2Na2O(s) △H =-317kJ/mol (2011浙江)12.下列说法不正确的是 A.已知冰的熔化热为6.0kJ﹒mol-1,冰中氢键键能为20 kJ﹒mol-1,假设每摩尔冰中有2mol氢键,且熔化热完全用于打破冰的氢键,则最多只能破坏冰中15%的氢键。 B.已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为。若加入少量CH3COONa固体,则电离平衡CH3COOH CH3COO-+H+向左移动,а减小,Ka变小。 C.检测得环己烷(l)环己烯(l)和苯(l)的标准燃烧热分别为-3916kJ·mol-1、-3747kJ·mol-1和-3265kJ·mol-1,可以证明在苯分子中不存在独立的碳碳双键。 D.已知:2Fe2O3(s) + 3C(石墨)= 2Fe(s) +3CO(g) △H=-489.0kJ·mol-1 CO(g) + 1/2O2(g)=CO2(g) △H=-283.0kJ·mol-1 C(石墨)+O2(g)=CO2(g) △H=-393.5kJ·mol-1 则:4Fe(s)+3O2(g)=2Fe2O3(s) △H=-1641.0kJ·mol-1 (2009全国二)11. 已知:2H2(g)+ O2(g)=2H2O(l) ΔH= -571.6KJ· mol-1 CH4(g)+ 2O2(g)=CO2(g)+2H2O(l) ΔH= -890KJ· mol-1 现有H2与CH4的混合气体112L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3695KJ,则原混合气体中H2与CH4的物质的量之比是 A.1∶1 B.1∶3 C.1∶4 D.2∶3 答案 (2010山东)10.C(2009上海)5.C(2009天津)6.C(2009重庆)12.C (2008四川卷)7.B(2008上海卷)17.C(2007全国2)9.C (2011重庆)13.B(2010重庆)12.D(2008重庆卷)13.A(2007重庆)13.C (2011上海)3.B (2011海南)5. C(2010广东)9.A(2009海南)12.A(2008宁夏卷)13.A (2011上海)11.D(2010新课标)11.C(2007上海)14. A (2011北京)10.D(2011浙江)12.B(2009全国二)11.B查看更多