- 2021-04-16 发布 |
- 37.5 KB |
- 8页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
全国版2021高考化学一轮复习课时作业45晶体结构与性质含解析
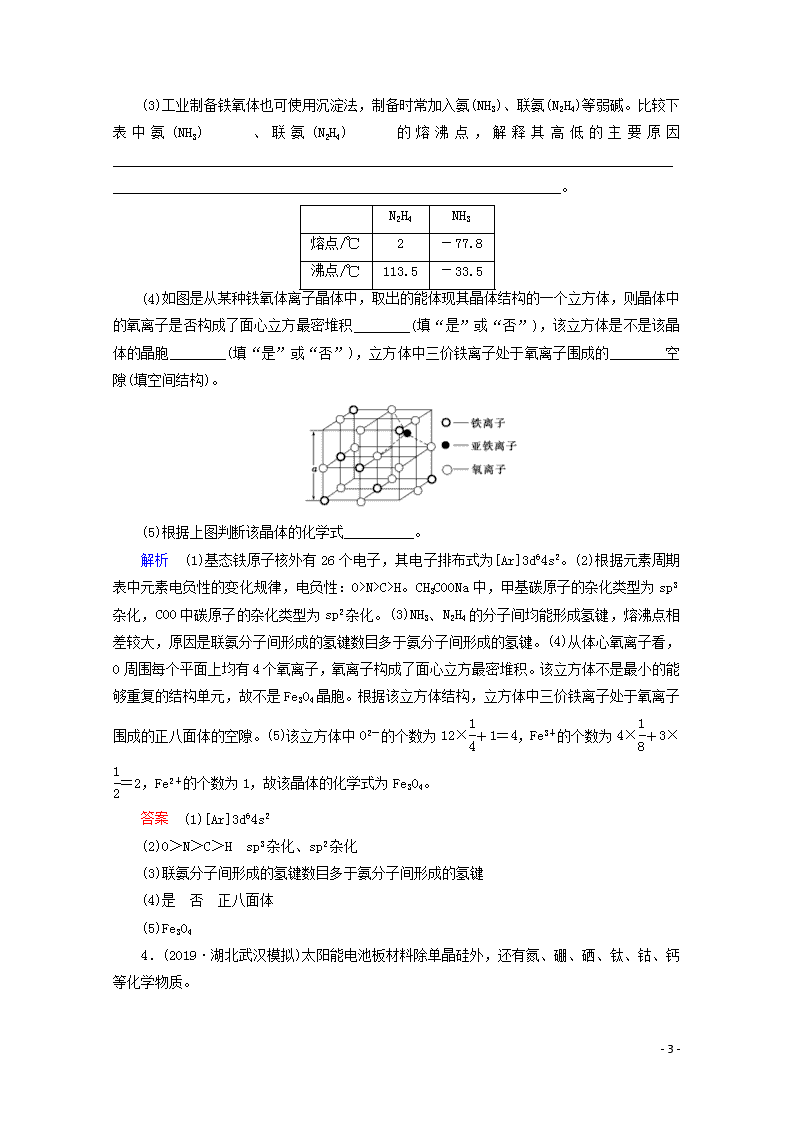
课时作业(四十五) 晶体结构与性质 1.(1)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为________,微粒间存在的作用力是__________。SiC晶体和晶体Si的熔、沸点高低顺序是________。 (2)氧化物MO的电子总数与SiC的相等,则M为______(填元素符号)。MO是优良的耐高温材料,其晶体结构与NaCl晶体相似。MO的熔点比CaO的高,其原因是________________________________________________________________。 (3)C、Si为同一主族的元素,CO2和SiO2的化学式相似,但结构和性质有很大的不同。CO2中C与O原子间形成σ键和π键,SiO2中Si与O原子间只能形成σ键,不形成上述π键。从原子半径大小的角度分析,为何C、O原子间能形成上述π键,而Si、O原子间不能形成上述π键:_____________________________________________________,SiO2属于________晶体,CO2属于________晶体,所以熔点CO2______(填“<”“=”或“>”)SiO2。 (4)金刚石、晶体硅、二氧化硅、MgO、CO2、Mg六种晶体的构成微粒分别是______________________________________________,熔化时克服的微粒间的作用力分别是________________________________________________________________________。 解析 (1)SiC中Si和C原子均形成四个单键,形成正四面体结构,所以C原子杂化方式是sp3。非金属原子之间形成的化学键是共价键。因为Si—C 的键长小于Si—Si,所以熔点碳化硅>晶体硅。 (2)SiC电子总数是20个,则该氧化物为MgO;晶格能与所构成离子所带电荷成正比,与离子半径成反比,MgO与CaO的离子电荷数相同,Mg2+半径比Ca2+小,MgO晶格能大,熔点高。 (4)金刚石、晶体硅、二氧化硅均为原子晶体,构成微粒均为原子,熔化时破坏共价键;Mg为金属晶体,由金属阳离子和自由电子构成,熔化时克服金属键;CO2为分子晶体,由分子构成,分子间以分子间作用力结合;MgO为离子晶体,由Mg2+和O2-构成,熔化时破坏离子键。 答案 (1)sp3 共价键 SiC>Si (2)Mg Mg2+半径比Ca2+小,MgO晶格能大 (3)Si的原子半径较大,Si、O原子间距离较大,p-p轨道肩并肩重叠程度较小,不能形成上述稳定的π键 原子 分子 < (4)原子、原子、原子、阴阳离子、分子、金属阳离子与自由电子 共价键、共价键、共价键、离子键、分子间作用力、金属键 2.(2019·辽宁沈阳质检)(1)钠、钾、铬、钼、钨等金属晶体的晶胞属于体心立方,则该晶胞中属于1个体心立方晶胞的金属原子数目是________。氯化铯晶体的晶胞如图1,则Cs+位于该晶胞的________,而Cl-位于该晶胞的________,Cs+的配位数是______。 (2)铜的氢化物的晶胞结构如图2所示,写出此氢化物在氯气中燃烧的化学方程式:________________________________________________________________________。 (3)图3为F-与Mg2+、K+ - 8 - 形成的某种离子晶体的晶胞,其中“○”表示的离子是________(填离子符号)。 (4)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图4所示),已知3种离子晶体的晶格能数据如下表: 离子晶体 NaCl KCl CaO 晶格能/kJ·mol-1 786 715 3 401 则这4种离子晶体(不包括NaCl)熔点从高到低的顺序是______________________,其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有_________________个。 解析 (1)体心立方晶胞中,1个原子位于体心,8个原子位于立方体的顶点,故1个晶胞中金属原子数为8×+1=2;氯化铯晶胞中,Cs+位于体心,Cl-位于顶点,Cs+的配位数为8。(2)由晶胞可知,粒子个数比为1∶1(铜为8×+6×=4,H为4),化学式为CuH,+1价的铜与-1价的氢均具有较强的还原性,氯气具有强氧化性,产物为CuCl2和HCl。(3)由晶胞结构可知,黑球有1个,灰球有1个,白球有3个,由电荷守恒可知n(Mg2+)∶n(K+)∶n(F-)=1∶1∶3,故白球为F-。(4)从3种离子晶体的晶格能数据知道,离子所带电荷越大、离子半径越小,离子晶体的晶格能越大,离子所带电荷数:Ti3+>Mg2+,离子半径:Mg2+<Ca2+,所以熔点:TiN>MgO>CaO>KCl;MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有12个。 答案 (1)2 体心 顶点 8 (2)2CuH+3Cl22CuCl2+2HCl (3)F- (4)TiN>MgO>CaO>KCl 12 3.(2019·吉林吉林联考)铁氧体是一种磁性材料,具有广泛的应用。 (1)基态铁原子的核外电子排布式为____________。 (2)工业制备铁氧体常使用水解法,制备时常加入尿素[CO(NH2)2]、醋酸钠等碱性物质。尿素分子中四种不同元素的电负性由大至小的顺序是________;醋酸钠中碳原子的杂化类型是________。 - 8 - (3)工业制备铁氧体也可使用沉淀法,制备时常加入氨(NH3)、联氨(N2H4)等弱碱。比较下表中氨(NH3)、联氨(N2H4)的熔沸点,解释其高低的主要原因________________________________________________________________________________________________________________________________________________。 N2H4 NH3 熔点/℃ 2 -77.8 沸点/℃ 113.5 -33.5 (4)如图是从某种铁氧体离子晶体中,取出的能体现其晶体结构的一个立方体,则晶体中的氧离子是否构成了面心立方最密堆积________(填“是”或“否”),该立方体是不是该晶体的晶胞________(填“是”或“否”),立方体中三价铁离子处于氧离子围成的________空隙(填空间结构)。 (5)根据上图判断该晶体的化学式__________。 解析 (1)基态铁原子核外有26个电子,其电子排布式为[Ar]3d64s2。(2)根据元素周期表中元素电负性的变化规律,电负性:O>N>C>H。CH3COONa中,甲基碳原子的杂化类型为sp3杂化,COO中碳原子的杂化类型为sp2杂化。(3)NH3、N2H4的分子间均能形成氢键,熔沸点相差较大,原因是联氨分子间形成的氢键数目多于氨分子间形成的氢键。(4)从体心氧离子看,O周围每个平面上均有4个氧离子,氧离子构成了面心立方最密堆积。该立方体不是最小的能够重复的结构单元,故不是Fe3O4晶胞。根据该立方体结构,立方体中三价铁离子处于氧离子围成的正八面体的空隙。(5)该立方体中O2-的个数为12×+1=4,Fe3+的个数为4×+3×=2,Fe2+的个数为1,故该晶体的化学式为Fe3O4。 答案 (1)[Ar]3d64s2 (2)O>N>C>H sp3杂化、sp2杂化 (3)联氨分子间形成的氢键数目多于氨分子间形成的氢键 (4)是 否 正八面体 (5)Fe3O4 4.(2019·湖北武汉模拟)太阳能电池板材料除单晶硅外,还有氮、硼、硒、钛、钴、钙等化学物质。 - 8 - 图1 图2 (1)基态钙原子的电子排布式为_______________________________________________, 金属钴的堆积方式与镁相似,都属于六方最密堆积,其配位数是________。 (2)如图1是晶体硼的正二十面体结构单元,每个单元中有12个硼原子,其中有两个原子为10B,其余为11B,则该结构单元有________种不同的结构类型,该结构单元含有________个B—B键。 (3)六方相氮化硼的结构与石墨相似,B的杂化方式是________,其不导电的原因是________________________________________________________________________。 (4)人工氮化钛晶体的晶胞与NaCl晶胞相似,如图2所示。 ①该晶体中与Ti原子距离最近且相等的Ti原子有________个,与Ti原子距离最近且相等的N原子有________个,这几个N原子形成的空间形状是________。 ②该晶体的熔点高于NaCl晶体的熔点,其原因是 ________________________________________________________________________ ________________________________________________________________________ ______________________________________________________________________。 解析 (1)基态钙原子核外有20个电子,电子排布式为1s22s22p63s23p64s2或[Ar]4s2。镁、钴是六方最密堆积,其配位数为12。(2)晶体硼的结构类型取决于两个10B原子的相对位置,两个10B相邻、相间或相对,所以共有3种结构类型。1个硼原子形成5个B—B键,则1个硼原子占有的B—B键为5×=2.5,该结构单元含有B—B键的数目为2.5×12=30。(3)六方相氮化硼中1个硼与3个氮原子结合,硼原子的杂化类型为sp2杂化。六方相氮化硼不导电的原因是层状结构中没有自由移动的电子。(4)①与Ti原子距离最近且相等的Ti原子有12个,与Ti原子距离最近且相等的N原子有6个(在Ti的上、下、左、右、前、后)。②氮化钛晶体中阴阳离子的电荷数均高于氯化钠晶体中阴阳离子的电荷数,氮化钛晶体的晶格能高于氯化钠晶体的晶格能,因此氮化钛晶体的熔点高于NaCl晶体的熔点。 答案 (1)1s22s22p63s23p64s2 12 (2)3 30 (3)sp2杂化 层状结构中没有自由移动的电子 (4)①12 6 正八面体 ②氮化钛晶体中阴阳离子的电荷数均高于氯化钠晶体中阴阳离子的电荷数,氮化钛晶体的晶格能高于氯化钠晶体的晶格能 - 8 - 5.(2019·山东青岛模拟)钛对酸、碱具有较强的耐腐蚀性,密度小,比强度高,已成为化工生产中重要的材料。回答下列问题: (1)基态钛原子的价电子排布式为________,其原子核外未成对电子有________个。金属钛晶胞如图所示,晶胞参数为a=b=295.08 pm,c=468.55 pm,α=β=90°,γ=120°,则金属钛为________堆积(填堆积方式),其中钛原子的配位数为________。 (2)用熔融的镁在氩气中还原TiCl4可得到多孔的海绵钛。已知TiCl4在通常情况下是无色液体,熔点为-25℃,沸点为136℃,由此可知TiCl4为________晶体。 (3)通过X-射线探明KCl、CaO、TiN晶体与NaCl晶体结构相似,且知两种离子晶体的晶格能数据如下: 离子晶体 KCl CaO 晶格能/(kJ·mol-1) 715 3 401 解释KCl晶格能小于CaO的原因: ________________________________________________________________________ ________________________________________________________________________ ________________________________________________________________________。 (4)钛可与C、N、O等元素形成二元化合物,C、N、O元素的电负性由大到小的顺序是______________________________________。 (5)钙钛矿晶体的晶胞结构如图所示,则该晶体的化学式为________。晶胞中的原子可用x、y、z组成的三数组来表示它在晶胞中的位置,称为原子坐标。已知原子坐标为A(0,0,0),B;则Ca的原子坐标为________。 解析 (1)钛原子的核电荷数为22,其电子排布式为[Ar]3d24s2,则价电子排布式为3d24s2,其原子核外的d轨道有2个未成对电子。如题图所示,金属钛为六方最密堆积,其中钛原子的配位数为12。(2)TiCl4在通常情况下是无色液体,熔点为-25℃,沸点为136℃,熔、沸点较低,由此可判断TiCl4是由共价键结合的分子,属于分子晶体。(3)离子晶体的离子半径越小,所带电荷数越多,晶格能越大。KCl、CaO均是离子晶体,而K+的半径大于Ca2+、K+的电荷数小于Ca2+,Cl-的半径大于O2-、Cl-的电荷数小于O2- - 8 - ,故KCl的晶格能小于CaO的晶格能。(4)元素的非金属性越强,电负性越大,C、N、O三种元素非金属性的强弱顺序为O>N>C,则电负性由大到小的顺序是O>N>C。(5)根据钙钛矿晶胞结构图,晶胞中Ti原子数为8×=1,O原子数为12×=3,Ca原子数为1,所以该化合物的化学式为CaTiO3。Ca位于晶胞的体心,则Ca的原子坐标为。 答案 (1)3d24s2 2 六方最密 12 (2)分子 (3)KCl、CaO均是离子晶体,而K+的半径大于Ca2+、K+的电荷数小于Ca2+,Cl-的半径大于O2-、Cl-的电荷数小于O2-,故KCl的晶格能小于CaO的晶格能 (4)O>N>C (5)CaTiO3 6.(2019·河南开封模拟)钛(Ti)、钒(V)、镍(Ni)、镧(La)等在储氢材料方面具有广泛的用途。下面是一些晶体材料的结构示意图。 请回答下列问题: (1)写出镍原子的核外电子排布式:________________________________________。 (2)钛金属晶体的原子堆积方式如图1所示,则每个钛原子周围有______个紧邻的钛原子,该晶体中原子的堆积方式为____________________。 (3)镧系合金是稀土系储氢合金的典型代表。某合金储氢后的晶胞如图2所示,该合金的化学式为________,1 mol镧形成的该合金能储存____mol氢气。 (4)嫦娥三号卫星上的PTC元件(热敏电阻)的主要成分——钡钛矿晶体结构如图3所示,该晶体经X射线分析鉴定,重复单位为立方体,边长为a cm。顶点位置被Ti4+所占据,体心位置被Ba2+所占据,所有棱心位置被O2-所占据。 ①该晶体中的O元素与H形成的化合物的中心原子的杂化类型为________,其分子空间构型为________。 ②写出该晶体的化学式:________。 解析 (1)Ni是28号元素,其原子的核外电子排布式是1s22s22p63s23p63d84s2。 (2)由晶胞结构图可知,以顶点原子为研究对象,与之最近的原子处于面心上,每个顶点原子为12个面共用,故晶胞中该原子的配位数为12,该单质晶体中原子的堆积方式为面心立方最密堆积。 (3)根据某合金储氢后的晶胞结构示意图可知该合金中含有:La:8×=1;Ni:8× - 8 - +1=5,所以化学式是LaNi5;1 mol该合金吸附氢气的物质的量是8 mol×+2mol×=3 mol。 (4)①该晶体中的O元素与H元素形成的化合物H2O的中心原子O 原子的杂化类型为sp3杂化,其分子空间构型为V形;②根据晶胞结构示意图可知:Ba:1;Ti:8×=1;O:12×=3,所以该晶体的化学式是:BaTiO3。 答案 (1)1s22s22p63s23p63d84s2 (2)12 面心立方最密堆积 (3)LaNi5 3 (4)①sp3 V形 ②BaTiO3 7.(2019·山西太原检测)碳和硅属于同主族元素,在生活生产中有着广泛的用途。 (1)在基态14C原子中,核外存在________对自旋方向相反的电子。 (2)Fe(CO)5又名羰基铁,常温下为黄色油状液体,则Fe(CO)5的晶体类型是________,与CO互为等电子体的分子的分子式为________。 (3)C、O和Si的成键情况如下: 化学键 C—O C===O Si—O Si===O 键能/(kJ·mol-1) 360 803 464 640 C和O之间易形成含有双键的CO2分子晶体,而Si和O之间则易形成含有单键的SiO2原子晶体,请结合数据分析其原因为 ________________________________________________________________________ ________________________________________________________________________ ________________________________________________________________________ ________________________________________________________________________ ________________________________________________________________________ ________________________________________________________________________。 (4)观察C60晶胞(如图所示),回答下列问题: ①与每个C60分子距离最近且相等的C60分子有________个,其距离为______________cm(列出计算式即可)。 ②C60晶体中C60和C60间的作用力属于________________(填“离子键”“共价键”或“分子间作用力”) ③已知C60晶体内相邻C60球体间的距离是304 pm,则与石墨层间距离(335 - 8 - pm)相比较,两者数据存在差异的原因是___________________________________________________。 (5)一种石英晶体的晶胞结构如图所示,可以看成是在晶体硅的晶胞中每两个硅原子间插入一个氧原子而得到的。其中硅原子的配位数为________。 解析 (1)碳原子的电子排布图为,有两对自旋方向相反的电子。(2)Fe(CO)5常温下为液体,熔、沸点较低,则为分子晶体。与CO互为等电子体的分子为N2。(4)①C60晶胞为面心立方最密堆积,与C60分子距离最近且相等的C60分子有12个(分别在同层、上层、下层,各四个),其距离为晶胞面对角线的一半,即××1.41×10-7cm=0.71××10-7cm。②C60晶体为分子晶体,晶体中C60和C60间的作用力属于分子间作用力。③C60的摩尔质量大于C的摩尔质量,C60分子间作用力较大,间距较小。(5)该晶胞中1个Si原子与4个O原子结合,故Si的配位数为4。 答案:(1)2 (2)分子晶体 N2 (3)碳与氧之间形成双键的分子放出的能量(803 kJ·mol-1×2=1 606 kJ·mol-1)大于形成单键的原子晶体放出的能量(360 kJ·mol-1×4=1 440 kJ·mol-1);硅与氧之间形成双键的分子放出的能量(640 kJ·mol-1×2=1 280 kJ·mol-1)小于形成单键的原子晶体放出的能量(464 mol·L-1×4=1 856 kJ·mol-1) (4)①12 0.71××10-7cm(或7.1××10-8cm) ②分子间作用力 ③C60的摩尔质量大于C的摩尔质量,C60分子间作用力较大,间距较小 (5)4 - 8 -查看更多