- 2021-04-16 发布 |
- 37.5 KB |
- 12页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
山东省烟台市2020届高三化学高考适应性练习(一)试题(Word版附答案)
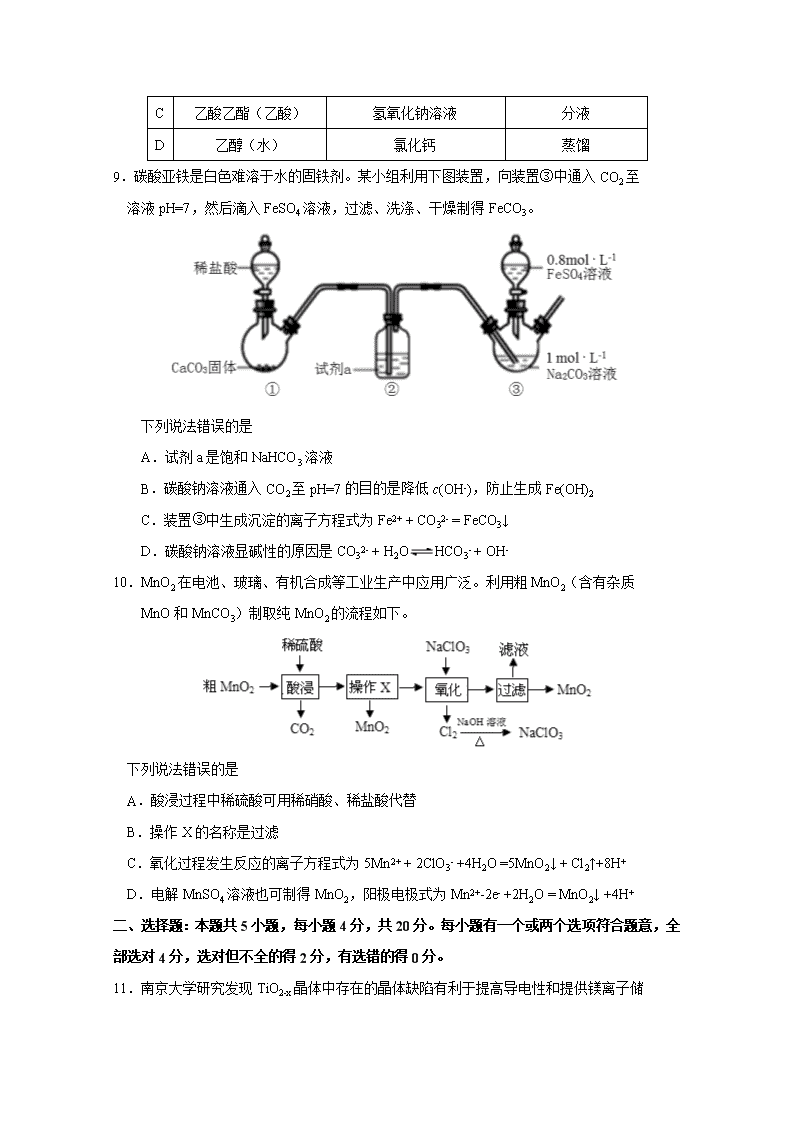
2020 年高考适应性练习(一) 化 学 1.答题前,考生先将自己的姓名、考生号、座号填写在相应位置,认真核对姓名、考生号 和座号。 2.选择题答案必须使用 2B 铅笔(按填涂样例)正确填涂;非选择题答案必须使用 0.5 毫 米黑色签字笔书写,字体工整、笔迹清楚。 3.请按照题号在各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿纸、试 题卷上答题无效。保持卡面清洁,不折叠、不破损。 可能用到的相对原子质量:H1 C12 N14 O16 Na23 Cl35.5 Fe56 Ga70 Zr91 一、选择题:本题共 10 小题,每小题 2 分,共 20 分。每小题只有一个选项符合题意。 1.化学与生活、生产、社会可持续发展密切相关,下列说法错误的是 A.用灼烧闻气味的方法可区别棉织物和纯毛织物 B.《本草纲目》记载“用浓酒和糟入甑,蒸令气上,用器承滴露”,其原理与蒸馏相同 C.用聚氯乙烯代替木材生产快餐盒,可减少木材的使用 D.用来制作 N95 口罩“熔喷布”的原料聚丙烯是混合物 2.按系统命名法,下列有机物的命名正确的是 A.2,4,4-三甲基戊烷 B.2-乙基-1-丁烯 C.2-甲基-3-戊炔 D.2,2-二甲基-3-丁醇 3.下列关于原子结构与元素周期表的说法正确的是 A.电负性最大的元素位于周期表的左下角 B.基态原子最外层电子排布为 ns2 的元素都位于周期表 IIA C.某基态原子的电子排布式为[Ar]3d104s24p1,该元素位于周期表第四周期 IIIA D. 基态原子 p 能级电子半充满的原子第一电离能一定大于 p 能级有一对成对电子的 4.关于实验室中的仪器①试管、②烧杯、③容量瓶、④量筒、⑤分液漏斗、⑥滴定管、 ⑦蒸馏烧瓶、⑧蒸发皿,下列说法错误的是 A.能直接加热的有①⑧ B.常用于物质分离的有⑤⑦⑧ C.使用前应进行检漏的有③⑤⑥ D.标有使用温度的有③④⑥⑦ 5.已知某种锂盐的结构如图,它是一种新型锂离子电池的电解质,其阴离子由 W、X、 Y、Z 四种同周期主族元素构成,Y 原子的最外层电子数是 X 的次外层电子数的 3 倍(箭头 指向表示共用电子对由 W 提供)。下列说法错误的是 A.元素非金属性强弱顺序是 W>Y>Z>X B.阴离子中 X 与 Z 的杂化方式相同 C.原子半径 X> Z > Y >W D.该物质中含有极性键、非极性键、配位键和离子键 6.法匹拉韦(Favipiravir)是一种 RNA 聚合酶抑制剂,被用于治疗新型和复发型流感, 主要通过阻断病毒核酸复制的方法抑制病毒增殖,其结构如下图。下列关于法匹拉韦 的说法错误的是 A.分子式为 C5H4FN3O2 B.所有原子可能在同一平面上 C.所有碳原子的杂化方式都是 sp2 杂化 D.一定条件下能与氢氧化钠溶液、盐酸、氢气等发生反应 7.我国有世界储量第一的天然石膏(主要成分 CaSO4),同时也有大量磷酸工业副产品 石膏,可用于硫酸及水泥的联合生产。硫酸钙在高温下被 CO 还原,发生的反应有: I.CaSO4(s)+4CO(g) CaS(s) +4CO2(g) K1 II.CaSO4(s) +CO(g) CaO(s) +SO2(g)+CO2(g) K2 III.3CaSO4(s)+CaS(s) 4CaO(s) +4SO2(g) K3 上述反应的平衡常数的对数值(lgK)与温度(T)的关系 如右图所示。下列说法错误的是 A.反应 II 的 △ H >0 B.lgK3= 4lgK2 − lgK1 C.使用适当的催化剂能够加快反应速率,提高原料的平衡转化率 D.调控适当的温度可以抑制反应 I 促进反应 III 而得到较纯净的 CaO 8.为提纯下列物质(括号内的物质是杂质),所选用的除 杂 试剂和分离方法都正确的是 被提纯的物质 除杂试剂 分离方法 A 甲烷(乙烯) 酸性高锰酸钾溶液 洗气 B 苯(苯酚) 氢氧化钠溶液 分液 C 乙酸乙酯(乙酸) 氢氧化钠溶液 分液 D 乙醇(水) 氯化钙 蒸馏 9.碳酸亚铁是白色难溶于水的固铁剂。某小组利用下图装置,向装置③中通入 CO2 至 溶液 pH=7,然后滴入 FeSO4 溶液,过滤、洗涤、干燥制得 FeCO3。 下列说法错误的是 A.试剂 a 是饱和 NaHCO3 溶液 B.碳酸钠溶液通入 CO2 至 pH=7 的目的是降低 c(OH-),防止生成 Fe(OH)2 C.装置③中生成沉淀的离子方程式为 Fe2+ + CO32- = FeCO3↓ D.碳酸钠溶液显碱性的原因是 CO32- + H2O HCO3- + OH- 10.MnO2 在电池、玻璃、有机合成等工业生产中应用广泛。利用粗 MnO2(含有杂质 MnO 和 MnCO3)制取纯 MnO2 的流程如下。 下列说法错误的是 A.酸浸过程中稀硫酸可用稀硝酸、稀盐酸代替 B.操作 X 的名称是过滤 C.氧化过程发生反应的离子方程式为 5Mn2+ + 2ClO3- +4H2O =5MnO2↓ + Cl2↑+8H+ D.电解 MnSO4 溶液也可制得 MnO2,阳极电极式为 Mn2+-2e- +2H2O = MnO2↓ +4H+ 二、选择题:本题共 5 小题,每小题 4 分,共 20 分。每小题有一个或两个选项符合题意,全 部选对 4 分,选对但不全的得 2 分,有选错的得 0 分。 11.南京大学研究发现 TiO2-x 晶体中存在的晶体缺陷有利于提高导电性和提供镁离子储 位,可用作新型镁电池负极材料,该电池的工作原理如图所示。下列说法正确的是 A.放电时,a 为电池负极 B.充电时,Mg2+向 b 电极移动 C.放电时,a 极的电极式为 nMg2++V2O5+2ne-= MgnV2O5 D.充电时,b 极的电极式为 MgnTiO2-x-2ne-=nMg2++TiO2-x 12.用 KMnO4 酸性溶液处理硫化亚铜(Cu2S)和二硫化亚铁(FeS2)的混合物时,发生的反 应Ⅰ:MnO4-+Cu2S+H+→Cu2++SO42-+Mn2++H2O(未配平)和反应Ⅱ:MnO4-+FeS2+H+ →Fe3++SO42-+Mn2++H2O(未配平)。下列说法正确的是 A.反应Ⅰ中 Cu2S 既是氧化剂又是还原剂 B.反应Ⅰ中每生成 1 mol SO42-,转移电子的物质的量为 10 mol C.反应Ⅱ中氧化剂与还原剂的物质的量之比为 1∶3 D.若反应Ⅰ和反应Ⅱ中消耗的 KMnO4 的物质的量相同,则反应Ⅰ和反应Ⅱ中消耗的还原 剂的物质的量之比为 3:2 13.《环境科学》刊发了我国科研部门采用零价铁活化过硫酸钠(Na2S2O8,其中 S 为 +6 价)去除废水中的正五价砷[As(V)]的研究成果,其反应机制模型如下图所示 (SO4- ·、·OH 表示自由基)。设阿伏加德罗常数的值为 NA。下列叙述错误的是 A.过硫酸钠中-2 价氧与-1 价氧的个数比为 3:1 B.若 56g Fe 参加反应,共有 1.5NA 个 S2O82-被还原 C.碱性条件下硫酸根自由基发生反应的方程式为 SO4- · + OH- =SO42- +·OH D.pH 越小,越有利于去除废水中的正五价砷 14.常温下,某浓度 H2A 溶液中滴加 NaOH 溶液,若定义 pc=﹣lgc,则测得 pc(H2A)、 pc(HA-)、pc(A2-)变化如图所示。 下列说法错误的是 A.pH=3 时溶液中 c(A2-) >c(H2A)> c(HA-) B.常温下,H2A 的 Ka1=10-0.80,Ka2=10-5.30 C.NaHA 溶液中 c(H+) > c(OH-) D.从 a 点到 c 点,c(H+)/c(H2A)先增大后减小 15.我国科学家设计 CO2 熔盐捕获与转化装置如图 1,可与太阳能电池(装置如图 2)联合实 现绿色转化。下列有关说法错误的是 A.c 接太阳能电池的 P 电极 B.CO2 与熔盐发生氧化还原反应生成 CO32-和 C2O52- C.d 极电极反应式为 CO32-+4e-==C+3O2- D.理论上转移 4 mol 电子可捕获标准状况下 CO2 22.4L 三、非选择题:本题共 5 小题,共 60 分。 16.(12 分)盐酸阿比多尔是一种盐酸盐,其主要作用是通过抑制流感病毒脂膜与宿主细 胞的融合而阻断病毒的复制,结构如图。回答下列问题: (1)盐酸阿比多尔中所含 N、O、S 三种元素第一 电 离能由大到小的顺序为_____。O 原子核外有 种不同 运 动状态的电子,基态 S 原子的价电子排布图不是 ,是因为该排布方式违背了_________。 (2)该结构中 N 原子的杂化方式是 。已知在氨分子中,H-N-H 键角为 107.3°, 但是在[Zn(NH3)6]2+离子中 H-N-H 键角变为 109.5°,分析原因为 。 (3)盐酸阿比多尔中不含有的化学键 类型为__________(填选项字母)。 A.离子键 B.配位键 C.金属键 D.σ 键 E.π键 F.极性键 G.非极性键 (4)以氮化镓(GaN)为代表的第三代 半导体材料目前已成为全球半导体研究的前沿和热点。GaN 晶胞如图 1 所示,图 2 为晶胞沿 y 轴的投影 1∶1 平面图。 ①氮化硼与氮化镓的结构类似,氮化硼熔点 3000℃,氮化镓熔点 1700℃,分析它们熔点 不同的原因_____________。 ②晶胞中与一个 Ga 原子距离最近且相等的 N 原子有 个。 ③设阿伏加德罗常数的值为 NA,则该晶胞的密度是____g·cm−3(列出计算表达式)。 17.(12 分)过硫酸钠(Na2S2O8) 也叫高硫酸钠、过二硫酸钠,是白色晶状粉末,易溶于 水,加热至 65℃就会发生分解,用作漂白剂、氧化剂、乳液聚合促进剂。某化学小组对 Na2S2O8 制备和性质进行探究。 I.实验室制备 Na2S2O8 【查阅资料】工业制备过硫酸钠的反应原理: 主反应:(NH4)2S2O8+2NaOH=====55 ℃ Na2S2O8+2NH3↑+2H2O 副反应:2NH3+3Na2S2O8+6NaOH=====90 ℃ 6Na2SO4+6H2O+N2 设计如图实验装置: (1)恒压滴液漏斗的优点是 。 (2)装置 a 中反应产生的气体需要持续通入装置 c 的目的是 ;装置 b、d 的作用分别 是 、 。 (3)反应完毕,将三颈圆底烧瓶中的溶液减压浓缩、结晶过滤、洗涤干燥,可得过硫酸钠, 减压浓缩的原因是 。 II.探究 Na2S2O8 的性质 (1)酸性过硫酸钠溶液,在 Ag+催化作用下可以把 Mn2+氧化为 MnO- 4 ,该方法可用于检验 Mn2+,所得溶液除去 Ag+后加入 BaCl2 溶液可以产生白色沉淀。 ①用酸性 Na2S2O8 溶液检验 Mn2+时的实验现象为___________________。 ②该反应的离子方程式为_____________。 (2)过硫酸钠溶液与铜反应只生成两种盐且反应先慢后快,某同学推测反应先慢后快的原 因可能是生成的 Cu2+对反应起催化作用,设计实验方案检验该推测是否正 确 。(供选择试剂:Cu、Na2S2O8 溶液、Na2SO4 溶液、CuSO4 溶液、Cu(NO3)2 溶液、CuCl2 溶液、蒸馏水) 18.(13 分)锆及其化合物作为新材料,具有相当重要的意义。氧氯化锆(ZrOCl2)是制备锆 系列材料的一种重要中间产品,用锆英砂(主要成分 ZrSiO4)制备水合氧氯化锆有多种方法, 目前使用较多的是“一酸一碱法”,其主要流程如下: 已知:①Na2ZrO3 在强碱性的介质中 不溶解或水解;②硅酸和原硅酸都具有 吸附性。 回答下列问题: (1)“碱烧”过程中生成“碱熔料”的化 学方程式为 。 (2)“水洗压滤”工艺可以将 30~70%的硅除去,下图表示的是各种工艺变化对水洗除硅率 的影响,则为了提高除硅率应采取的措施是 (任意回答两条即可)。 (3)硅的去除还有一部分是通过上述流程中的 工艺实现的,这一部分硅转化成的 物质是 (填化学式)。 (4)水洗压滤的主要目的是除硅,则转型压滤的主要目的是除去 ,转型压滤过程中 生成 ZrO(OH)2 的离子方程式为 。 (5)操作 M 包括 、过滤、洗涤、干燥;上述工艺若不加改进,锆的损失会 比较大,为了减少锆的损失,应该改进的措施是 。 (6)称取 3.220g 产品(水合氧氯化锆),溶于盐酸配制成 1000mL 溶液,取 25mL 于锥形 瓶中,加热至 90℃以上,并滴入 2 滴二甲酚橙指示剂,趁热用 0.0125mol ·L-1EDTA 标准溶液 滴定,当溶液由红色变为黄色且半分钟不褪色时,消耗 EDTA 溶液 20mL。计算水合氧氯化锆 的化学式为 (EDTA 与 ZrO2+在上述条件下以 1:1 比例反应)。 19.(11 分)2019 年国际非政府组织“全球计划”12 月 4 日发布报告:研究显示,全球二氧 化碳排放量增速趋缓。CO2 的综合利用是解决温室问题的有效途径。 (1)CO2 催化加氢制甲醇的有关反应及其在不同温度下的化学平衡常数如下表所示。 化学反应 平衡常数 500℃ 700℃ 800℃ Ⅰ.H2(g)+CO2(g) H2O(g)+CO(g) 1.0 1.70 2.52 Ⅱ.2H2(g)+CO(g) CH3OH(g) 2.5 0.34 0.15 Ⅲ.3H2(g)+CO2(g) CH3OH(g)+H2O(g) ΔH ①ΔH 0(填“>”、“<”或“=”)。 ②已知反应Ⅲ的速率方程式:v 正= k 正·c3(H2) ·c(CO2),v 逆=k 逆·c(CH3OH)·c(H2O), k 正、k 逆为速率常数。反应达到平衡后,仅升高温度,k 正增大的倍数 k 逆增大的倍数(填 “大于”、“小于”或“等于”)。 ③500℃时,向恒容的密闭容器中加入 1molCO2 和 1molH2,控制反应条件只发生反应Ⅰ。 达到平衡后,只改变下列条件,能使 CO 的平衡体积分数增大的是 (填选项字母)。 A .增大压强 B .降低温度 C .再通入等物质的量 CO2 和 H2 D .分离出部分水 (2)在 200℃时,向 5L 带气压计的恒容密闭容器中通入 2molCO2 和 2molCH4 发生反应 CH4(g)+CO2(g) 2H2(g)+2CO(g),测得初始压强为 P0kPa,反应过程中容器内总压强(P)随 时间(t)变化(反应达到平衡时的温度与起始温度相同)如图所示。 ①该反应过程中从 0min 到 2min 压强变化原因是 。 ②0~4min 内,反应的平均反应速率 v(CO2)= 。 ③用平衡分压代替平衡浓度表示的化学平衡常数 Kp= 。[气体分压(p 分)=气体总 压(p 总)×气体体积分数] (3)科学家提出利用 CO2 与 CH4 制备“合成气”(CO、H2)可能的反应历程如图所示。 注:C(ads)为吸附性活性炭,方框内包含微粒种类及数目、微粒的相对总能量[如第一个 方框中 1 个 CH4(g)+1 个 CO2(g)的相对总能量为 E1eV,单位:eV]。其中,TS 表示过渡 态。 ①CH4(g)+CO2(g) 2H2(g)+2CO(g) ΔH= kJ·mol-1(已知:1eV = 1.6×10-22 kJ) ②若 E4+E1查看更多