- 2021-04-16 发布 |
- 37.5 KB |
- 13页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2017-2018学年安徽省淮北市第一中学高二上学期第四次月考(12月)化学试题
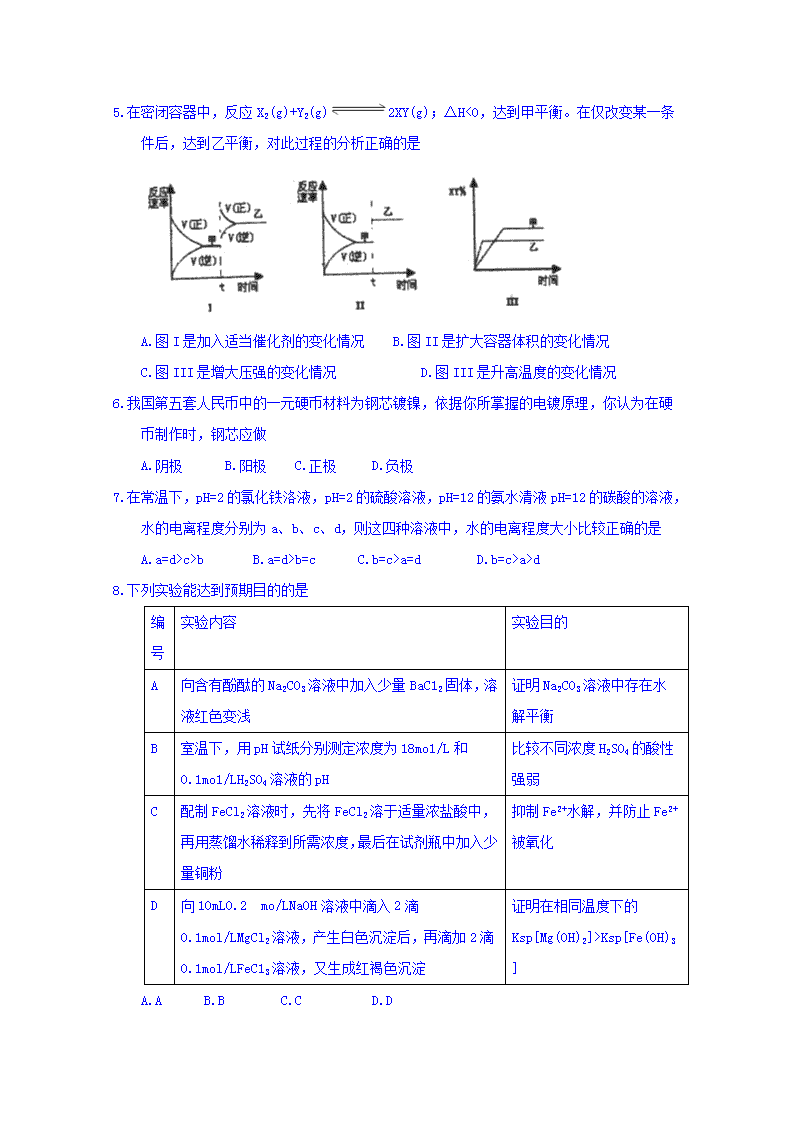
可能用到的相对原子质量: H-1C-12 N-14 0-16 Na-23 Mg-24 S-32 Cu-64 一、选择题(本题共有21小题,每小题只有一个答案符合题意,每小题2分,共42分。) 1.下列叙述正确的是 A.吸热反应一定是反应物总能量大于生成物的总能量 B.明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同 C.强电解质溶液导电能力一定很强,弱电解质溶液导电能力一定很弱 D.在海轮外亮上镶入锌块,可减缓船体的腐蚀速率 2.广义的水解观认为: 无论是盐的水解还是非盐的水解,其最终结果是反应中各物质和水分别离解成两部分,然后两两重新组合成新的物质。根据上述观点,说法不正确的是 A.BaO2的水解产物是Ba(OH)2和H2O2 B.PC13的水解产物是HC10和H3PO4 C.A14C3的水解产物是Al(OH)3和CH4 D.CH3COOC1的水解产物是两种酸 3.为解决日益加剧的温室效应等问题,科学家正在研究建立如下图所示的二氧化碳新循环体系: 上述关系图能反映的化学观点或化学思想有 ①化学变化中元素种类是不变的;②燃烧时化学能可以转化为热能和光能; ③光能或电能可以转化为化学能;④无机物和有机物可以相互转化; ⑤二氧化碳可成为一种重要的资源。 A.①②③④ B.①②③⑤ C.①②④⑤ D.①②③④⑤ 4.下列叙述正确的是 A.某醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b B.在滴有酚酞溶液的氨水里,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7 C.1.0×10-3mo1/L盐酸的pH=3.0, 1.0×10-8mo1/L盐酸的pH=8.0 D.常温下,若1mLpH=1的盐酸与100mLNaOH溶液混合后,溶液的pH=7,则NaOH溶液的pH=11 5.在密闭容器中,反应X2(g)+Y2(g)2XY(g);△H<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是 A.图I是加入适当催化剂的变化情况 B.图II是扩大容器体积的变化情况 C.图III是增大压强的变化情况 D.图III是升高温度的变化情况 6.我国第五套人民币中的一元硬币材料为钢芯镀镍,依据你所掌握的电镀原理,你认为在硬币制作时,钢芯应做 A.阴极 B.阳极 C.正极 D.负极 7.在常温下,pH=2的氯化铁洛液,pH=2的硫酸溶液,pH=12的氨水清液pH=12的碳酸的溶液,水的电离程度分别为a、b、c、d,则这四种溶液中,水的电离程度大小比较正确的是 A.a=d>c>b B.a=d>b=c C.b=c>a=d D.b=c>a>d 8.下列实验能达到预期目的的是 编号 实验内容 实验目的 A 向含有酚酞的Na2CO3溶液中加入少量BaC12固体,溶液红色变浅 证明Na2CO3溶液中存在水解平衡 B 室温下,用pH试纸分别测定浓度为18mo1/L和0.1mo1/LH2SO4溶液的pH 比较不同浓度H2SO4的酸性强弱 C 配制FeCl2溶液时,先将FeCl2溶于适量浓盐酸中,再用蒸馏水稀释到所需浓度,最后在试剂瓶中加入少量铜粉 抑制Fe2+水解,并防止Fe2+被氧化 D 向10mL0.2 mo/LNaOH溶液中滴入2滴0.1mol/LMgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol/LFeC13溶液,又生成红褐色沉淀 证明在相同温度下的Ksp[Mg(OH)2]>Ksp[Fe(OH)3] A.A B.B C.C D.D 9.常温下,下列各组离子在指定溶液中一定能大量共存的是 ①含有大量Fe3+的溶液: Na+、SCN-、Cl-、SO42- ②pH=11的溶液中: CO32-、Na+、NO3-、S2-、K+ ③水电离的H+浓度为10-12mol/L的溶液中: NH4+、Na+、SO42-、HCO3- ④加入Mg能放出H2的溶液中: Mg2+、NO3-、NH4+、K+、SO42- ⑤澄清溶液中: Fe3+、NO3-、Na+、C1-、SO42- ⑥c(H+)/c(OH-)=1×10-12的溶液中: K+、Na+、CO32-、NO3- ⑦使甲基橙变红的溶液中: Cu2+、SO42-、NH4+、NO3-、C1- A.①③⑤⑦ B.①④⑤⑥ C.②④⑤⑥ D.②⑤⑥⑦ 10.关于下列各图的叙述正确的是 A.甲中△H1=-(△H2+△H3) B.乙表示恒温恒容条件下发生的可逆反应2NO2(g)N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 C.丙表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A D.丁表示常温下,稀释HA、HB两种酸的稀溶液时,蒋液pH随加水量的变化,则NaA溶液的pH大于等物质的量浓度的NaB溶液的pH 11.下列表述中,关于“一定”说法正确的个数是 ①pH=6的溶液一定是酸性溶液 ②c(H+)>c(OH-)一定是酸性溶液 ③强电解质溶液的导电能力一定大于弱电解质溶液的导电能力 ④25℃时,水溶液中水电离出的c(H+)和水电离出的c(OH-)的乘积一定等于10-14 ⑤使用pH试纸测定溶液阳时若先润湿,则测得溶液的pH一定有影响 ⑥0.2mol/L氢硫酸溶液加水稀释,电离程度增大,c(H+)一定增大 ⑦温度保持不变,向水中加入钠盐对水的电离一定没有影响 A.0 B.1 C.2 D.3 12.有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,制造出新型燃料电池,装置如图所示,下列有关说法正确的是 A.通入N2的一极为负极 B.通入H2的电极反应为: H2+2e-=2H+ C.物质A是MH4C1 D.反应过程中左边区域溶液pH逐渐减小 13.下列图示与对应的叙述相符的是 A.图1表示1L pH=2的CH3C0OH溶液加水稀释至VL,pH随1gV的变化 B.图2表示不同温度下水溶液中H+和OH-浓度的变化的曲线,图中温度T2>T1 C.图3表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率小于b点 D.图4表示同一温度下,在不同容积的容器中进行反应2BaO2(s)=2Ba0(s)+O2(g),O2的平衡浓度与容器容积的关系 14.室温下,将0.05mo1Na2CO3固体溶于水配成100mL溶液,向溶液中加入下列物质,有关结论正确的是 加入的物质 结论 A 50mL1mo1/LH2SO4 反应结束后,c(Na+)=c(SO42-) B 0.05molCaO 溶液中 C 50mLH2O 由水电高离出的c(H+)•c(OH-)不变 D 0.1molNaHSO4 反应完全后,溶液PH减小,c(Na+)不变 15.在t℃时,Ag2Cr04(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示。又知AgCl的Ksp=1.8×10-10。下列说法不正确的是 A.t℃时,Ag2Cr04的Ksp为1×10-8 B.t℃时,Y点和Z点时,Ag2Cr04的Ksp相等 C.t℃时,Ag2Cr04 AgCl 饱和溶液中,前者c(Ag+)大 D.饱和Ag2Cr04溶液中加K2Cr04不能使溶液由Y点变为X点 16.用情性电极电解一定浓度的CuSO4溶液时,通电一段时间后,向所得的溶液中加入物质的量为0.1mol的Cu2(OH)2CO3,恰好恢复到电解前的浓度和pH (不考虑二氧化碳的溶解),则电解过程中转移的电子的物质的量为 A.0.4mo1 B.0.5mo1 C.0.6mo1 D.0.8mo1 17.常温,下列溶液中各浓度关系不正确的是 A.等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液pH>7,则一定有:c(Na+)>c(HX)>c(X-) >c(H+) >c(OH-) B.1L0.1mol/LCuSO4•(NH4)2S04•6H2O的溶液中: (SO42-)>c(NH4+)>c(Cu2+)>c(H+)>c(OH-) C.0.1mo1/L'NaHCO3溶液中: c(Na+)+c(H+)+c(H2CO3)≠c(HCO3-)+c(CO32-)+c(OH-) D.物质的量浓度分别为c1和c2的两种醋酸溶液,若其PH分别为a和a+1,则c1>10c2 18.为探究Fe3+和Cu2+对H2O2分解反应的催化效果,甲乙两组同学分别设计了如图1图2所示的实验。下列叙述中不正确的是 A.图1实验可通过观察产生气泡的快慢来比较反应速率的大小 B.若图1所示实验速率为①>②,则一定能说明Fe3+比Cu2+对H2O2分解催化效果好 C.用图2装置比较反应速率,可测定相同时间相同状况产生气体积的多少进行比较 D.图2 中将注射器活塞拉出一定距离,一段时间后松开活塞,能返回原处,则不漏气 19.下列有关电解质溶液的说法正确的是 A.向0.1mo1/LCH3COOH 落液中加入少量水,溶液中减小 B.将CH3COONa溶液从20℃升温至30℃,溶液中增大 C.向盐酸中加入氨水至中性,溶液中 D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中不变 20.随着各地“限牌”政策的推出,电动汽车成为汽车界的“新宠”。特斯拉全电动汽车使用的是钻酸锂(LiCoO2)电池,其工作原理如图所示。其中A极材料是金属锂和碳的复合材料(碳作为金属恒的载体),电解质为一种能传导Li+的高分子材料,隔膜只允特定的离子通过,电池反应式为LixC6+Li1-xCoO2C6+LiCoO2。下列说法不正确的是 A.该隔膜只允许Li+通过,放电时Li+从左边流向右边 B.放电时,正极锂的化合价未发生改变 C.充电时B作阳极,该电极放电时的电极反应式为Li1-xCoO2+xLi++xe-=LiCoO2 D.废旧钴酸幢(LiCoO2)电池进行“放电处理”让Li+进入石墨中而有利于回收 21.液氨和水类似,也能电离: NH3+NH3NH4++NH2-,25℃时,其离子积K=1.0×10-30。现将2 3g金属钠投入1.0L液氨中,钠完全反应,有NaNH2和H2产生,则所得溶液中粒子关系不正确的是(设温度保持不变,溶液体积为1L) A.c(NH4+)=1.0×10-29mol/L B.c(Na+) =c(NH4+) C.c(NH2-)> c(NH4+) D.c(NH4+)•c(NH2-)=1.0×10-30 二、非选择题(本题共有5小题,共58分。) 22.(14分) 合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如表: 温度(℃) 360 440 520 K值 0.036 0.010 0.0038 (1) ①由上表数据可知该反应为_________(填放热、吸热或无法确定)反应。 ②下列措施能用勒夏特列原理解释是_______(填序号)。 a.增大压强有利于合成氨 b.使用合适的催化剂有利于快速生成氨 c.生产中需要升高温度至500℃左右 d.需要使用过量的N2,提高H2转化率 (2) 0.2mo1氨气溶于水后再与含有0.2mo1硫酸的溶液反应放热QkJ,请你用热化学方程式表示其反应式______________。 (3) 常温时,将amol氨气溶于水后,再通入bmol 氯化氢,溶液体积为1L,且c (NH4+) =c (Cl-),则一水合氨的电离平衡常数Kb=____________(用含a、b的代数式表示)。 (4) 原料气H2可通过反应CH4(g)+H2O (g)CO (g)+3H2(g) 获取,已知该反应中,当初始混合气中的恒定时,温度、压强对平衡混合气CH4含量的影响如图所示: ①图中两条曲线表示压强的关系是: P1______P2 (填“>”、“=”或“<”)。 ②其它条件一定,升高温度,氢气的产率会_______(填“增大”,“减小”,“不变”)。 (5) 原料气H2还可通过反应CO (g) +H2O (g)CO2 (g)+H2 (g) 获取。 ①T℃时,向容积固定为5L的容器中充入1mol 水蒸气和1molCO,反应达平衡后,测得CO的浓度为0.08mo1/L,该温度下反应的平衡常数K值为___________。 ②保持温度仍为T℃,容积体积为5L,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是_______(填序号)。 a.容器内压强不随时间改变 b.混合气体的密度不随时间改变 c.单位时间内生成a mol CO2的同时消耗8 mol H2 d.混合气中n (CO): n (H2O):n(CO2):n(H2) =1: 16: 6: 6 23.(8分) 已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡: CH3COOH =CH3COO-+H+ △H>0。 (1) 下列方法中,可以使0.10 mol/L CH3COOH的电离程度增大的是_______(用序号填写)。 a.加入少量0.10 mol/L的稀盐酸 b.加热CH3COOH溶液 c.加水稀释至0.010 mol/L d.加入少量冰醋酸 e.加入少量氯化钠固体 f.加入少量0.10mol/L的NaOH溶液 (2) 将等质量的锌粒投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积关系为V(盐酸)_____V(醋酸)(填写“>”、“<”或“="). (3)常温下,向体积为VamL,pH为3的醋酸溶液中滴加pH=11的NaOH溶液VbmL至溶液恰好呈中性,则Va与Vb的关系为: Va______Vb(填写“>”、“<”或“=”)。 (4) 已知: 某温度时,水的离子积常数为Ksp=1.0×10-12,在此温度下,将pH=1的盐酸和pH=11的氢氧化钠溶液等体积混合,则混合溶液中的c(H+)=_______mol/L。 24.(8分) 结合下表回答下列问题(均为常温下的数据): 酸 电离常数(Ka) 酸 电离常数(Ka) 酸 电离常数(Ka) 酸 电离常数(Ka) CH3COOH 1.8×10-5 H2CO3 K1=4.4×10-7 H2C2O4 K2=5.4×10-2 H2S K1=1.3×10-7 HClO 3×10-8 K2=4.7×10-11 K2=5.4×10-5 K2=7.1×10-15 请回答下列问题: (1) 同浓度的CH3COO-、HCO3-、CO32-、HC2O4-、C1O-、S2-中结合H的能力最弱的是_________。 (2) 0.1mo1/L的H2C2O4溶液与0.1mo1/L的KOH的溶液等体积混合后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为________________。 (3)pH相同的NaC1O和CH3COOK溶液中,[c(Na+)-c(C1O-)]______[c(K+)-c(CH3COO-)](填“>”、“<”或“=”) 。 (4) 向0.1mo1/LCH3COOH 溶液中滴加NaOH 溶液至c(CH3COOH): c(CH3COO-)=5:9,此时溶液pH=_________。 25.(12分) 以食盐为原料进行生产并综合利用的某些过程如图。 (1) 除去粗盐中的微溶物质CaSO4通常用Na2CO3处理,请用平衡移动原理解释说明:_____________。 (2) 人们习惯上把电解饱和食盐水的工业叫做氯碱工业.图1表示电解饱和NaCl 溶液的装置,X、Y是石墨棒。实验开始后,检验Y 电极反应产物的方法是_________________。 (3) 若向分离出NaHCO3晶体后的母液中加入过量生石灰,则可获得一种可以循环使用的气体,其化学式是__________。 (4) 某同学设计一个燃料电池(如图2所示),目的是探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X 为阳离子交换膜。根据要求回答相关问题: ①通入氢气电极的反应式为__________________。 ②反应一段时间后,在乙装置中滴入酚酞溶液,________________ (填“铁”或“石墨”)极区的溶液先变红。 ③如果粗铜中含有锌、银等杂质,丙装置中反应一段时间后,硫酸铜溶液浓度将___________(填“增大”“减小”或“不变”)。 ④若在标准状况下有224mL氧气参加反应,则乙装置中铁电极上生成的气体在标况下体积为_________L。 26.(16分) 野外被蚊虫叮咬会出现红肿,这是由甲酸(HCOOH)造成的。请完成下列探究。 【I.HCOOH酸性探究】 (1)下列酸属于二元酸的有________(用序号填写)。 A.HCOOH B.H2CO3 C.H2C2O4 D.CH3CHOHCH2COOH (2) 下列实验事实能证明甲酸为弱酸的是___(用序号填写)。 A.HCOONH4溶液呈酸性 B.将甲酸滴入NaHCO3溶液中有气体生成 C.常温下,0.1mol/L的甲酸溶液的pH约为3 D.等浓度的盐酸与甲酸溶液。前者的导电能力更强 (3) 可用小苏打溶液处理蚊虫叮咬造成的红肿,请用离子方程式表示其原理___________。 【II.甲酸制备甲酸铜探究】 相关原理和化学方程式如下: 先用硫酸铜和碳酸氢钠作用制得碱式碳酸铜,然后碱式碳酸铜再与甲酸反应制得四水甲酸铜[Cu(HCOO)2·4H2O]晶体: 2CuSO4+4NaHCO3=Cu(OH)2·CuCO3↓+3CO2↑+2Na2SO4+H2O Cu(OH)2·CuCO3+4HCOOH+5H2O=2Cu(HCOO)2·4H2O+ CO2↑ 实验步骤如下: (4) 碱式碳酸铜的制备: ①步骤ⅰ是将一定量CuSO4·5H2O晶体和NaHCO3固体一起放到研钵中研细并混合均匀。 ②步骤ⅱ是在搅拌下将固体混合物分多次缓慢加入热水中,反应温度控制在70~80℃温度不能过高的原因是_________________。 ③步骤ⅱ的后续操作有过滤、洗涤等。检验沉淀是否已洗涤干净的方法为__________。 (5) 甲酸铜晶体的制备: 将Cu(OH)2·CuCO3固体放入烧杯中,加入一定量的热蒸馏水,再逐滴加入甲酸至碱式碳酸铜恰好全部溶解,趁热过滤除去少量不溶性杂质。在通风橱中蒸发滤液至原体积的三分之一时,冷却析出晶体,过滤,再用少量无水乙醇洗海晶体2~3 次,晾干,得到产品。 ①“趁热过滤”中,必须“趁热”的原因是_______________。 ②用乙醇洗涤晶体的目的是_______________。 ③若该实验所取原料CuSO4·5H2O 晶体和NaHCO3 固体的质量分别为12.5 g 和9.5 g,实验结束后,最终称量所得的产品为7.91g,则产率为____________。 答案 一、选择题(本题共有21小题,每小题只有一个答案符合题意;每小题2分,共42分。) 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 D B D D D A B A D A B C C B A C A B D D B 二、非选择题(本题共有5小题,共58分。) 22. (14分)(每空2分) (1) ①放热 ② ad (2) NH3·H2O(aq)+H2SO4(aq)=NH4HSO4(aq)+H2O(l)△H=﹣5Q kJ•mol﹣1 (3) (4) ①<(1分) ② 增大(1分) (5) ①1.0×10-6 ②cd 23.(8分)(每空2分) (1) bcf (2) < (3) < (4) 2.05×10-11 24.(8分)(每空2分) (1) HC2O4- (2) c(K+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-) (3) = (4) 10-6 25.(12分)(每空2分) (1)CaSO4存在下列的溶解平衡:CaSO4(s)⇌Ca2+(aq)+SO42﹣(aq),加入Na2CO3溶液后,CO32﹣离子与Ca2+结合,生成更难溶的CaCO3沉淀;Ca2+离子浓度减少,使上述平衡向着更难容的方向移动 (2)将湿润的KI淀粉试纸放在气体出口,若观察到试纸变蓝,证明有Cl2产生 (3)NH3 (4)①H2﹣2e﹣+2OH﹣═2H2O ②铁 (1分) ③减小 (1分) ④0.448 26.(16分) (每空2分) (1) BC (2) CD (3) HCOOH + HCO3-=HCOO-+ H2O + CO2↑ (4) 产物 Cu(OH)2•CuCO3 受热会分解 取最后一次洗涤液少许于试管中,滴加 BaCl2 溶液,若不产生白色沉淀,说明沉淀已洗涤干净,若产生白色沉淀,说明沉淀未洗涤干净 (5) ①防止甲酸铜晶体析出 ②洗去晶体表面的水和其它杂质,且减少后续晾干的时间 ③70% 查看更多