- 2021-04-16 发布 |
- 37.5 KB |
- 12页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届一轮复习人教版氧化还原反应滴定作业
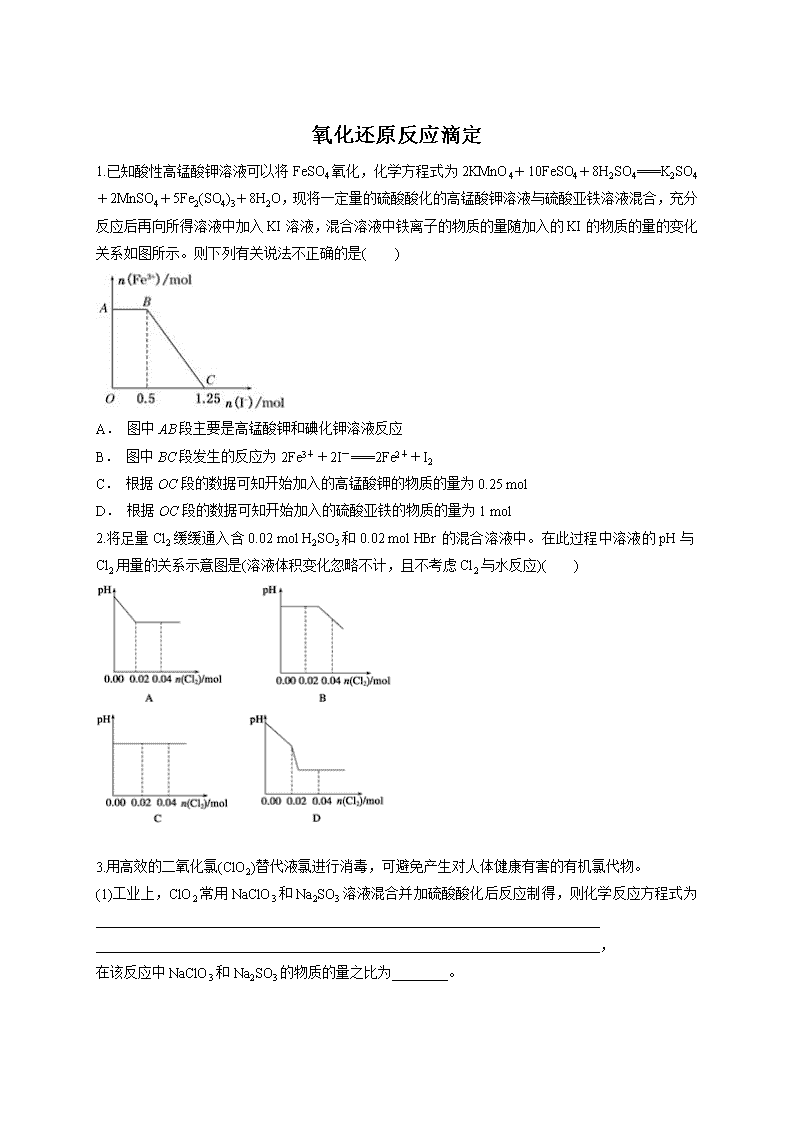
氧化还原反应滴定 1.已知酸性高锰酸钾溶液可以将FeSO4氧化,化学方程式为2KMnO4+10FeSO4+8H2SO4===K2SO4+2MnSO4+5Fe2(SO4)3+8H2O,现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的物质的量的变化关系如图所示。则下列有关说法不正确的是( ) A. 图中AB段主要是高锰酸钾和碘化钾溶液反应 B. 图中BC段发生的反应为2Fe3++2I-===2Fe2++I2 C. 根据OC段的数据可知开始加入的高锰酸钾的物质的量为0.25 mol D. 根据OC段的数据可知开始加入的硫酸亚铁的物质的量为1 mol 2.将足量Cl2缓缓通入含0.02 mol H2SO3和0.02 mol HBr的混合溶液中。在此过程中溶液的pH与Cl2用量的关系示意图是(溶液体积变化忽略不计,且不考虑Cl2与水反应)( ) 3.用高效的二氧化氯(ClO2)替代液氯进行消毒,可避免产生对人体健康有害的有机氯代物。 (1)工业上,ClO2常用NaClO3和Na2SO3溶液混合并加硫酸酸化后反应制得,则化学反应方程式为________________________________________________________________________ ________________________________________________________________________, 在该反应中NaClO3和Na2SO3的物质的量之比为________。 (2)有效氯含量是含氯消毒剂的一个重要指标,有效氯含量的定义:从HI中氧化出相同量的I2所需Cl2的质量与指定含氯消毒剂的质量之比,常用百分数表示。则ClO2的有效氯含量是________。 (3)化学小组的同学欲对用ClO2消毒过的自来水进行氯元素含量的测定(假定ClO2全部转化为Cl-),他们进行了如下实验:向30.00 mL水样中加几滴K2CrO4溶液作指示剂,用0.001 mol·L-1AgNO3溶液滴定,当有砖红色Ag2CrO4沉淀出现时,达滴定终点,此时用去AgNO3溶液12.12 mL。 ①水样中Cl-的物质的量浓度是________。 ②已知Ksp(AgCl)=1.780×10-10,Ksp(Ag2CrO4)=2.00×10-12。如在滴定终点时,测得溶液中CrO的浓度是5.000×10-3mol·L-1。试计算此时溶液中Cl-的浓度是________。 4.下列微粒在溶液中的还原性和氧化性强弱如下:还原性HSO>I-,氧 化性IO>I2>SO。向含有xmol NaHSO3的溶液中逐滴加入KIO3溶液。加入KIO3和析出I2的物质的量的关系曲线如图所示,则x=________mol。 5.目前流行的关于生命起源假设的理论认为,生命起源于约40亿年前的古洋底的热液环 境,这种环境系统中普遍存在铁硫簇结构,如Fe2S2、Fe4S4、Fe8S7等,这些铁硫簇结构参与了生命起源的相关反应。某化学兴趣小组在研究某铁硫簇结构的组成时,设计了下列实验。 6.某实验小组为探究ClO-、I2、SO在酸性条件下的氧化性强弱,设计实验如下: 实验①:在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝; 实验②:向实验①的溶液中加入4 mL 0.5 mol·L-1的亚硫酸钠溶液,蓝色恰好完全褪去。 (1)写出实验①中发生反应的离子方程式___________________________________ ________________________________________________________________________。 (2)实验②中化学反应转移电子的物质的量是________________________________。 (3)以上实验说明,在酸性条件下ClO-、I2、SO的氧化性由弱到强的顺序是 ________________________________________________________________________。 7.工业上测量SO2、N2、O2混合气体中SO2含量的装置如图。反应管中装有碘的淀粉溶液。SO2和I2发生的反应为(N2、O2不与I2反应): SO2+ I2+ 2H2O ===H2SO4+ 2HI (1)混合气体进入反应管后,量气管内增加的水的体积等于______________的体积(填写气体的分子式)。 (2)反应管内溶液蓝色消失后,没有及时停止通气。则测得的SO2含量________(选填:偏高、偏低、不受影响)。 (3)反应管内的碘的淀粉溶液也可以用________代替(填写物质名称)。 (4)若碘溶液体积为VamL,浓度为cmol·L-1,N2与O2的体积为VbmL(已折算成标准状况下的体积)。用Va、cmol·L-1、Vb表示SO2的体积百分含量为: _________________________。 (5)将上述装置改为简易实验装置,除导管外,还需选用的仪器为________(选填下列仪器的编号)。 a.烧杯 b.试管 c.广口瓶 d.容量瓶 e.量筒 f.单孔塞 g.双孔塞 8.用氯化铁浸出一重铬酸钾(K2Cr2O7)滴定法测定钛精粉试样中单质铁的质量分数[w(Fe)%],实验步骤如下: 步骤1:称取试样0.100 g于250 mL洗净的锥形瓶中。 步骤2:加入FeCl3溶液100 mL,迅速塞上胶塞,用电磁搅拌器搅拌30 min。 步骤3:过滤,用水洗涤锥形瓶和滤渣各3~4次,洗液全部并入滤液中。 步骤4:将滤液稀释至500 mL,再移取100 mL稀释液于锥形瓶中,加入20 mL硫酸和磷酸的混合酸,加0.5%二苯胺磺酸钠指示剂4滴。 步骤5:以K2Cr2O7标准溶液滴定至出现明显紫色为终点。发生的反应为: Cr2O+6Fe2++14H+===2Cr3++6Fe3++7H2O 步骤6:重复测定两次。 步骤7:数据处理。 (1)步骤2中加入FeCl3溶液后锥形瓶中发生反应的离子方程式为________________,迅速塞上胶塞的原因是________________。 (2)步骤3中判断滤纸上残渣已洗净的方法是________________________________。 (3)实验中需用到100 mL浓度约为0.01 mol·L-1K2Cr2O7标准溶液,配制时用到的玻璃仪器有________________。称量K2Cr2O7固体前应先将其烘干至恒重,若未烘干,对测定结果的影响是________(填“偏高”、“偏低”或“无影响”);滴定时,K2Cr2O7溶液应置于________(填仪器名称)中。 9.草酸亚铁(FeC2O4·2H2O)用作分析试剂及显影剂和新型电池材料磷酸亚铁锂的生产。已知:CO 能与氯化钯(PdCl2)溶液反应生成黑色的钯粉。回答下列问题: Ⅰ:兴趣小组对草酸亚铁的分解产物进行实验和探究。 (1)将气体产物依次通过A、澄清石灰水,B、氯化钯,观察到A中澄清石灰水变浑浊,B中有黑色物质生成,则上述现象说明气体产物中有 。 (2)探究分解得到的固体产物中铁元素的存在形式。 ①提出假设 假设1: ; 假设2:FeO; 假设3:FeO和Fe的混合物。 ②设计实验方案证明假设3。 限选试剂:1.0 mol·L-1盐酸、3% H2O2溶液、0.1 mol·L-1CuSO4溶液、20% KSCN溶液、蒸馏水。 Ⅱ:某草酸亚铁样品中含有少量草酸。现用滴定法测定该样品中FeC2O4的含量。滴定反应是:5Fe2++5C2+3Mn+24H+5Fe3++10CO2↑+3Mn2++12H2O实验方案设计为: ①将准确称量的0.20 g草酸亚铁样品置于250 mL锥形瓶内,加入适量2 mol/L的H2SO4溶液,使样品溶解,加热至70 ℃左右,立即用浓度为0.020 00 mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为V1mL。 ②向上述滴定混合液中加入适量的Zn粉和过量的2 mol/L的H2SO4溶液,煮沸5~8 min,用KSCN溶液在点滴板上检验点滴液,直至溶液不立刻变红。将滤液过滤至另一个锥形瓶中,继续用0.020 00 mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为V2mL。 ③重复以上实验1~2次。 若某小组的一次测定数据记录如下:V1= 18.90 mL,V2=6.20 mL。根据数据计算0.20 g 样品中:n(Fe2+)= ; n(C2)= ;FeC2O4的质量分数为 (精确到0.01%)。 10.氧化还原滴定实验同中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。现有0.01 mol/L酸性KMnO4溶液和未知浓度的无色Na2SO3溶液。反应的离子方程式为2MnO+5SO+6H+===2Mn2++5SO+3H2O,填空回答问题(已知Na2SO3溶液呈碱性)。 (1)该滴定实验中使用的仪器除铁架台、滴定管夹、烧杯外,还需用下列中的________(填序号)。 A.酸式滴定管(50 mL) B.碱式滴定管 C.量筒(10 mL) D.锥形瓶 E.胶头滴管 F.漏斗 (2)不用________(填“酸”或“碱”)式滴定管盛放高锰酸钾溶液。试分析原因________________________________________________________________________ ________________________________________________________________________。 (3)选何种指示剂,说明理由_________________________________________________ ________________________________________________________________________。 (4)滴定前平视KMnO4溶液的液面,刻度为amL,滴定后俯视液面刻度为bmL,则(b-a) mL比实际消耗KMnO4溶液体积________(填“多”或“少”)。根据(b-a) mL计算,得到的待测液浓度比实际浓度________(填“大”或“小”)。 11.为测试一铁片中铁元素的含量,某课外活动小组提出下面两种方案并进行了实验(以下数据为多次平行实验测定结果的平均值): 方案一:将ag铁片完全溶解于过量稀硫酸中,测得生成氢气的体积为580 mL(标准状况); 方案二:将g铁片完全溶解于过量稀硫酸中,将反应后得到的溶液用 0.020 00 mol·L-1的KMnO4溶液滴定,达到终点时消耗了25.00 mL KMnO4溶液。 请回答下列问题: (1)配平下面的化学方程式: KMnO4+FeSO4+H2SO4===Fe2(SO4)3+MnSO4+K2SO4+H2O (2)在滴定实验中不能选择________式滴定管,理由是______________; (3)根据方案一和方案二测定的结果计算,铁片中铁的质量分数依次为________和________; (4)若排除实验仪器和操作的影响因素,试对上述两种方案测定结果的准确性做出判断和分析。 ①方案一________(填“准确”、“不准确”或“不一定准确”),理由是____________; ②方案二________(填“准确”、“不准确”或“不一定准确”),理由是_____________。 12.某课外活动小组测定了某工厂工业废水中游离态氯的含量,下面是测定实验分析报告(请填写有关空白): (一)测定目的:测定工厂工业废水中的游离态氯的含量 (二)测定原理:Cl2+2KI===2KCl+I2;I2+2Na2S2O3===2NaI+Na2S4O6 (三)实验用品及试剂: (1)仪器和用品(自选,略) (2)试剂:指示剂________(填名称),KI溶液,浓度为0.010 mol/L 的标准Na2S2O3溶液,蒸馏水等。 (四)实验过程: (1)取水样10.00 mL 于锥形瓶中,加入10.00 mL KI溶液(足量),滴入指示剂2~3滴。 (2)取碱式滴定管(经检查不漏水),依次用自来水、蒸馏水洗净,然后注入0.010 mL/L Na2S2O3 溶液待用。 (3)将锥形瓶置于滴定管下方进行滴定,眼睛注视______直至滴定终点,滴定至终点的现象是__________________________。 (五)数据记录与处理:(请在下面表格中的有括号的横线上填上必要的物理量,不必填数据) 若经数据处理,滴定中消耗标准的Na2S2O3溶液的体积平均是20.00 mL,则废水中Cl2的物质的量浓度为________,从实验过程分析,此浓度比实际浓度________(填“偏大”、“偏小”或“相等”),造成误差的原因是 ________________________________________________________(若认为没有误差,该问可不答)。 (六)问题和讨论: 实验结束后,发现个别同学结果误差较大,其所测游离态氯的含量较废水中Cl2的含量低。经过思考,该同学提出了下列可能造成结果偏小的原因,其中你认为正确的是________(填编号)。 ①滴定前,滴定管嘴尖嘴处有气泡,滴定后气泡消失 ②滴定过程中由于振荡过于剧烈,使少量溶液溅出锥形瓶外 ③滴定前平视Na2S2O3液面,滴定后俯视Na2S2O3液面 13.已知溶液中,还原性为HSO>I-,氧化性为IO>I2>SO。在含3 mol NaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示。请回答下列问题: (1)a点处的氧化产物是________(填离子符号,下同),还原产物是________,a点对应的离子方程式为________________________________________________________________________ ________________________________________________________________________。 (2)当n(I2)达最大时,n(IO)对应的最小值为______mol,此时反应的离子方程式是________________________________________________________________________。 (3)当溶液中的I-为0.4 mol时,加入的KIO3为________mol。 (4)若向100 mL 1 mol·L-1的KIO3溶液中滴加NaHSO3溶液,反应开始时的离子方程式为________________________________________________________________________ ________________________________________________________________________。 答案解析 1.【答案】D 【解析】根据题中方程式可知:MnO的氧化性强于Fe3+,当加入KI溶液时,n(Fe3+)不变,说明MnO先氧化I-,A正确;MnO反应完全后,Fe3+氧化I-,使n(Fe3+)减小,B正确;BC段参加反应的I-为0.75 mol,故还原的n(Fe3+)为0.75 mol,再根据电子守恒,生成0.75 mol Fe3+需0.15 mol MnO,加入的高锰酸钾的物质的量为0.25 mol,C正确。 2.【答案】A 【解析】因H2SO3的还原性强于HBr的还原性,故Cl2先氧化H2SO3,H2SO3+Cl2+H2O===H2SO4+2HCl,生成的H2SO4和HCl均是强酸,故溶液的pH下降;当H2SO3完全反应后,再通入Cl2,发生反应Cl2+2HBr===Br2+2HCl,溶液的pH不再改变。 3.【答案】(1)2NaClO3+Na2SO3+H2SO4===2Na2SO4+2ClO2↑+H2O 2∶1 (2)263%(或2.63) (3)①4.040×10-4mol·L-1 ②8.900×10-6mol·L-1 【解析】(1)根据题意,可知发生反应的化学方程式为2NaClO3+Na2SO3+H2SO4===2Na2SO4+2ClO2↑+H2O,n(NaClO3)∶n(Na2SO3)=2∶1。 (2)根据题意可知,2 mol HI被氧化生成1 mol I2,反应中转移2 mol电子,消耗氧化剂Cl271 g。若用ClO2氧化HI得到I2,反应的化学方程式为2ClO2+10HI===5I2+2HCl+4H2O,若生成1 mol I2则消耗ClO2的物质的量为mol,其质量为27 g,因此ClO2的有效氯含量为×100%≈263%。 (3)①溶液中发生的离子反应为:Ag++Cl-===AgCl↓,则n(Ag+)=n(Cl-),0.001 mol·L-1×12.12×10-3L=c(Cl-)×30.00×10-3L,因此c(Cl-)=4.040×10-4mol·L-1。 ②在滴定终点时,c(CrO)=5.000×10-3mol·L-1,根据Ksp(Ag2CrO4)=2.000×10-12,则c(Ag+)==2.000×10-5(mol·L-1)。根据Ksp(AgCl)=1.780×10-10,则c(Cl-)==8.900×10-6(mol·L-1)。 4.【答案】3 【解析】开始加入KIO3溶液时,最先与IO反应的微粒是HSO,还原产物为I-,氧化产物为SO。当HSO反应完后,b点到c点发生反应的离子方程式为IO+5I-+6H+===3I2+3H2O。所以0点到b点参加反应的HSO的物质的量可利用电子守恒求解,n(HSO)×2e-=n(IO)×6e-,即n(HSO)×2=1 mol×6,所以x=3。 5.【答案】(1)当滴入最后一滴草酸溶液时,锥形瓶中溶液由浅红色变为无色,且半分钟内不变化 (2)验证SO2是否被酸性KMnO4溶液完全吸收 同意 当B中溶液颜色不变化,即可证明SO2 已被酸性KMnO4溶液完全吸收 (3)Fe3S4 (4)Mn2+对反应起到催化作用(或反应放热使温度升高),加快反应速率 【解析】(3)第1次滴定时H2C2O4溶液体积误差较大,舍去,第2、3次取平均值,V(H2C2O4)=25.00 mL。与H2C2O4反应的KMnO4的物质的量为0.01 mol·L-1×0.025 L×= 0.000 1 mol,与SO2反应的KMnO4的物质的量为0.05 L×0.100 mol·L-1-10×0.000 1 mol=0.004 mol,n(SO2)=0.004 mol×=0.01 mol,n(S)=0.01 mol;0.6 g 固体为Fe2O3,n(Fe)=×2 mol=0.007 5 mol,==,所以该铁硫簇结构的化学式为Fe3S4。(4)对比实验1、2知,Mn2+可使反应速率加快;对比实验1、3知,温度升高,反应速率加快。 6.【答案】(1)ClO-+2I-+2H+===I2+Cl-+H2O (2)0.004 mol (3)SO 【解析】(1)ClO-在酸性条件下把I-氧化成I2,其离子方程式为ClO-+2I-+2H+===I2+ Cl-+H2O。 (2)根据实验现象,I2被Na2SO3还原成I-,自身被氧化成Na2SO4,转移的电子为4× 10-3×0.5×2 mol=0.004 mol。 (3)由实验可判断氧化性强弱顺序为SO 7.【答案】(1)N2、O2 (2)偏低 (3)酸性高锰酸钾或溴水 (4)×100% (5)b、c、e、g或b、e、g或c、e、g。 【解析】(1)反应管的作用是吸收SO2,所以剩余的气体是N2、O2。量气管中增加的水的体积是N2、O2的体积。 (2)若反应管内溶液蓝色消失,说明其中的I2已消耗完,此时若再通入待测混合气体,其中的SO2不能被吸收,所测得的SO2的含量会偏低。 (3)反应管中的试剂应具备两个条件,一是能吸收SO2,二是要有明显的实验现象以利判断是否完全反应。酸性高锰酸钾或溴水都可作为吸收剂。 (4)根据题给反应可得:V(SO2)%=22.4cVa/22.4c(Va+Vb)×100% (5)量气管可用量筒代替,反应管可用试管或广口瓶代替,所以可以有如下三种组合:b、c、e、g或b、e、g或c、e、g。 8.【答案】(1)2Fe3++Fe===3Fe2+ 防止Fe2+被空气中的O2氧化 (2)取最后一次洗涤滤出液,滴加AgNO3溶液,若无白色沉淀,证明已洗净(检验Fe3+、H+或Fe2+亦可,但方法现象描述应合理) (3)100 mL容量瓶,烧杯,玻璃棒,胶头滴管 偏高 酸式滴定管 【解析】(1)测定原理是2Fe3++Fe===3Fe2+,利用Cr2O+6Fe2++14H+===2Cr3++6Fe3++7H2O,通过关系式计算出铁的含量,所以要防止Fe2+被空气中的O2氧化。 (2)判断固体洗涤干净的方法是“检验最后一次洗涤滤出液中是否存在杂质离子”。钛精粉溶解在FeCl3中生成FeCl2,所以滤液中会含有Cl-、Fe3+、Fe2+,也含有H+。 (3)K2Cr2O7固体未烘干,所得标准液浓度偏低,需加体积偏大,测量结果偏高;K2Cr2O7溶液有强氧化性,应置于酸式滴定管中。 9.【答案】Ⅰ.(1)CO2、CO (2)① Fe ② Ⅱ.0.000 620 0 mol 0.000 635 0 mol 44.64% 【解析】Ⅰ.(1)根据CO能与氯化钯(PdCl2)溶液反应生成黑色的钯粉,可判断有CO气体,根据A中澄清石灰水变浑浊,可判断有CO2气体。 (2)①根据后面的假设2和假设3为Fe、FeO中的一种或两种可知,假设1为Fe。 ②要证明假设3是FeO和Fe的混合物,证明Fe的存在可通过Fe与硫酸铜发生置换反应生成红色的铜;第一步中,硫酸铜过量,已经将Fe除去,因此在固体中再加盐酸和H2O2,如果有FeO,则会被氧化为Fe3+,遇到KSCN溶液呈血红色。 Ⅱ.根据电子守恒找出关系式:5Fe2+~Mn,5C2~2Mn,故n(Fe2+)=5n(Mn)=5×0.006 200 L×0.020 00 mol/L=0.000 620 0 mol,n(C2)=5×(0.018 90-0.006 20)L×0.020 00 mol/L÷2=0.000 635 0mol。因此n(FeC2O4)=n(Fe2+)=0.000 620 0 mol,故其质量分数为0.000 620 0mol×144 g/mol÷0.2g×100%=44.64%。 10.【答案】(1)A、B、D (2)碱 KMnO4溶液能把橡胶管氧化 (3)不用指示剂,因为KMnO4被还原剂还原成Mn2+,紫红色褪去,所以不需要指示剂 (4)少 小 【解析】因酸性KMnO4溶液具有强氧化性,能氧化橡胶,因此盛放酸性KMnO4溶液应用酸式滴定管,Na2SO3溶液呈碱性,应用碱式滴定管量取,除此之外,还需用锥形瓶。因恰好反应时KMnO4溶液紫色褪去,故不需指示剂,若滴定前平视,滴定后俯视,会使(b-a)偏小,从而测得Na2SO3的浓度偏低。 11.【答案】(1)2 10 8 5 2 1 8 (2)碱酸性 KMnO4是强氧化剂,会腐蚀胶管 (3) (4)①不一定准确 如果铁片中存在与稀硫酸反应并能生成氢气的其他金属,会导致结果偏高;如果铁片中存在与稀硫酸反应而溶解、但不产生氢气的铁的氧化物,会导致结果偏低;如果上述情况均不存在,则结果准确 ②不一定准确 如果铁片中存在与稀硫酸反应而溶解的其他金属,生成的金属离子在酸性溶液中能被高锰酸钾氧化,会导致结果偏高;如果铁片中存在与稀硫酸反应而溶解的铁的氧化物,生成的Fe3+在酸性溶液中不能被高锰酸钾氧化,会导致结果偏低;如果上述情况均不存在,则结果准确 【解析】(1)分析该氧化还原反应的化合价,找出化合价发生变化的各元素,利用化合价的升降相等,配平化学方程式: →SO4 SO4→(SO4)3 (2)由于酸性高锰酸钾溶液具有强氧化性,能腐蚀碱式滴定管的胶管,因此不能选择碱式滴定管。 (3)根据方案一中的测量结果计算: n(Fe)=n(H2)= 因此m(Fe)=mol×56 g·mol-1=1.45 g 故铁片中铁的质量分数为; 根据方案二中的测定结果计算: 根据(1)中反应方程式: 2KMnO4~10FeSO4~10Fe n(Fe)=5n(KMnO4) =5×0.02 mol·L-1×0.025 L =0.002 5 mol 铁片中铁的质量分数为 =。 (4)①方案一不一定准确,因为不能确定Fe片中是否含有和稀硫酸反应放出H2的杂质,若有则测定结果偏高。 ②方案二是利用Fe2+消耗KMnO4的物质的量的多少,求出Fe的质量分数,而铁片中是否含有和酸性KMnO4溶液反应的杂质也不能确定,另外铁片中若有+3价的Fe的杂质,用KMnO4 也测定不出来。因此方案二也不一定准确。 12.【答案】(2)淀粉溶液 (3)锥形瓶内溶液颜色变化 溶液由蓝色变为无色且半分钟内不变色 数据记录与处理 0.010 mol/L 偏大 滴定管没有用标准Na2S2O3溶液润洗 ②③ 【解析】(三)(2)由测定原理可知,有I2参与反应,可以用淀粉溶液来显示I2与Na2S2O3溶液的滴定终点。(四)(3)滴定过程中,眼睛应注视锥形瓶内溶液颜色变化,左手操作滴定管活塞,右手摇动锥形瓶;滴定终点判断:滴入一滴标准液后,溶液由蓝色变为无色且半分钟内不恢复。(五)通过Na2S2O3溶液消耗的体积,计算Cl2反应产生I2的量,所以需要提供:待测液的体积,标准溶液滴定前后的刻度,进而得知实际消耗标准液的体积。另外为减小误差,一般是测量2~3次,所以还需要知道几次消耗标准溶液的平均值。利用反应中关系式Cl2~I2~2Na2S2O3,可以算出Cl2的浓度。从前面实验步骤来看,标准液盛入滴定管前并没有用标准Na2S2O3溶液洗涤滴定管,残留的蒸馏水会稀释标准溶液,导致所耗标准液体积偏大,最终使待测液浓度偏大。(六)利用公式c(待测)=,c(待测)与V(标准)有关,①在滴定前滴定管尖嘴处有气泡,滴定后气泡消失,会使消耗标准溶液体积偏大,最终使待测液浓度偏大;②中滴定过程有待测液溅出锥形瓶,消耗标准液体积偏小,最终使待测液浓度偏小;③滴定过程中,滴定前正确读数,滴定后俯视读数会使标准液体积偏小,最终使待测液浓度偏小。 13.【答案】(1)SO I- IO+3HSO===I-+3SO+3H+ (2)1.2 IO+5I-+6H+===3I2+3H2O (3)1.12或0.4 (4)2IO+5HSO===I2+5SO+H2O+3H+ 【解析】(1)根据还原性为HSO>I-,氧化性为IO>I2>SO,可知NaHSO3和KIO3反应时,氧化产物为SO,还原产物不是I2而应是I-。(2)根据得失电子数守恒,3 mol NaHSO3失去6 mol电子,相应的KIO3变成I2,需要1.2 mol,向NaHSO3溶液中滴入KIO3溶液时,还原产物为I-,当NaHSO3完全反应后,KIO3再氧化I-为I2。(3)分两种情况进行计算,当KIO3滴入量较少时,n(I-)=n(KIO3),当滴入量较多,恰好全部转化为I-,需要1 mol KIO3,产生1 mol I-,再消耗0.6 mol I-,需要0.12 mol KIO3。(4)反过来滴加,不可以产生I-,溶液中过量的KIO3会将I-氧化为I2。查看更多