- 2021-04-16 发布 |
- 37.5 KB |
- 16页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【化学】云南省玉溪市峨山彝族自治县第一中学2019-2020学年高一下学期期中考试试题(解析版)
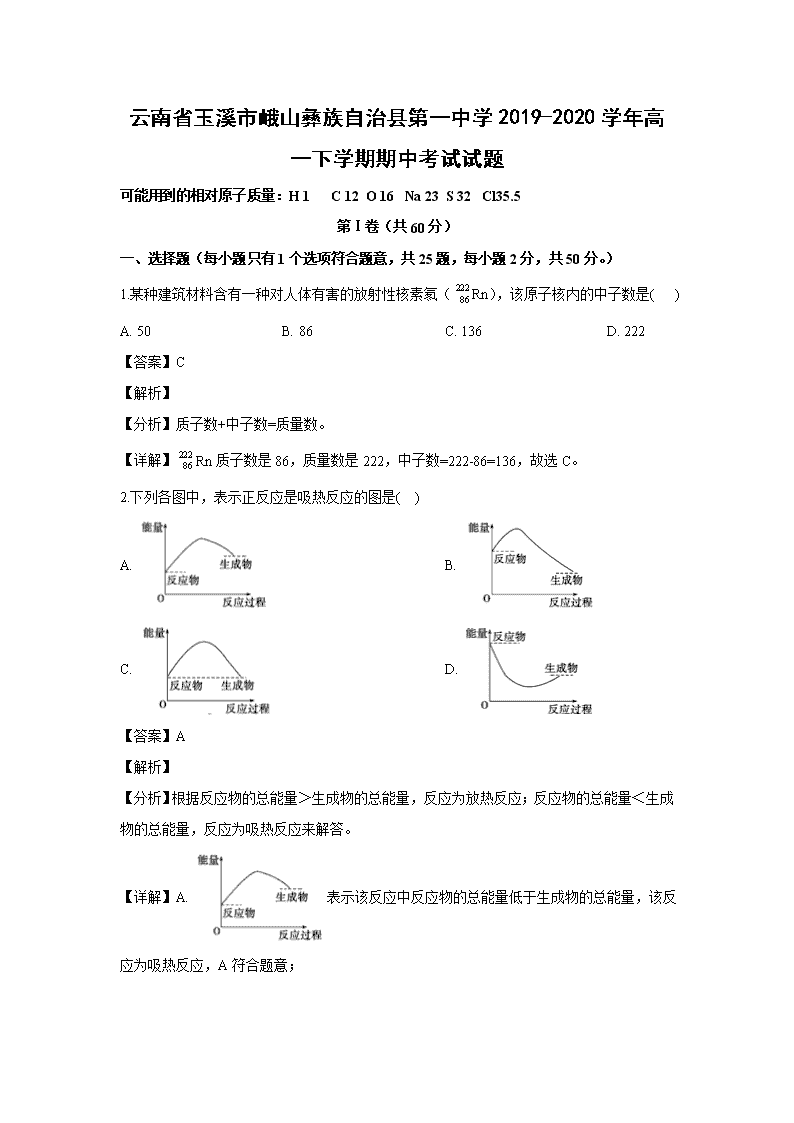
云南省玉溪市峨山彝族自治县第一中学2019-2020学年高一下学期期中考试试题 可能用到的相对原子质量:H 1 C 12 O 16 Na 23 S 32 Cl35.5 第Ⅰ卷(共60分) 一、选择题(每小题只有1个选项符合题意,共25题,每小题2分,共50分。) 1.某种建筑材料含有一种对人体有害的放射性核素氡(Rn),该原子核内的中子数是( ) A. 50 B. 86 C. 136 D. 222 【答案】C 【解析】 【分析】质子数+中子数=质量数。 【详解】Rn质子数是86,质量数是222,中子数=222-86=136,故选C。 2.下列各图中,表示正反应是吸热反应的图是( ) A. B. C. D. 【答案】A 【解析】 【分析】根据反应物的总能量>生成物的总能量,反应为放热反应;反应物的总能量<生成物的总能量,反应为吸热反应来解答。 【详解】A. 表示该反应中反应物的总能量低于生成物的总能量,该反应为吸热反应,A符合题意; B. 表示该反应中反应物的总能量高于生成物的总能量,该反应为放热反应,B不符合题意; C. 表示该反应中反应物的总能量等于生成物的总能量,该既不为吸热也不放热,故该反应不可能发生; D. 该反应中的过渡态的能量低于反应物的能量,这是不可能的。 综上所述,答案选A。 3.下列化合物只含有共价键的是( ) A. MgCl2 B. KCl C. NaCl D. HCl 【答案】D 【解析】 【详解】A.MgCl2是离子化合物,由镁离子和氯离子构成,只含有离子键,故A不符合题意; B.KCl是离子化合物,由钾离子和氯离子构成,只含有离子键,故B不符合题意; C.NaCl是离子化合物,由钠离子和氯离子构成,只含有离子键,故C不符合题意; D.HCl是共价化合物,由氢原子和氯原子以共用电子对相结合,只含有共价键,故D符合题意; 答案选D。 4.用质量、形状均相同的锌片与下列条件下的稀硫酸反应时,化学反应速率最快的是( ) A. 20℃1mol/L稀硫酸 B. 30℃1mol/L稀硫酸 C. 20℃2mol/L稀硫酸 D. 30℃2mol/L稀硫酸 【答案】D 【解析】 【详解】温度越高反应速率越快、浓度越大反应速率越快;选项中D选项的温度最高、硫酸的浓度最大,所以反应速率最快,答案选D。 5.有关碱金属性质的叙述错误的是( ) A. 随核电荷数的增加,碱金属的熔、沸点降低 B. 随核电荷数的增加,碱金属的密度增大 C. 锂在氧气中燃烧生成过氧化锂 D. 碱金属与水反应生成碱和氢气 【答案】C 【解析】 【分析】 【详解】A.碱金属单质都是金属晶体,随核电荷数的增加,碱金属从上到下原子半径依次增大,金属键依次减弱,单质熔、沸点依次降低,故A正确; B.除Na的密度大于K的密度外,随着核电荷数增加,碱金属单质的密度呈增大趋势,故B正确; C.锂在空气中燃烧生成氧化锂,得不到过氧化锂,故C错误; D.碱金属单质化学性质都非常活泼,都可与水剧烈反应生成碱和氢气,故D正确; 答案选C。 6.氢氧燃料电池能把( ) A. 光能转变为化学能 B. 化学能转变为电能 C. 热能转变为电能 D. 化学能转变成光能 【答案】B 【解析】 【详解】氢氧燃料电池是利用原电池原理设计的化学电源,通入氢气的一极作负极,发生氧化反应,失去电子,通入氧气的一极作正极,发生还原反应,得到电子,电解质溶液中有离子作定向移动,形成闭合回路,产生电流,原电池是将化学能转化为电能的装置,答案选B。 7.有关卤素性质的叙述错误的是( ) A. 随核电荷数的增加,卤素单质的熔、沸点升高 B. 随核电荷数的增加,卤素单质的密度增大 C. 随核电荷数的增加,卤素单质的颜色逐渐加深 D. 核电荷数大的卤素单质可以把核电荷数小的卤素单质从卤化物中置换出来 【答案】D 【解析】 【分析】 【详解】A.卤素单质为分子晶体,随着相对分子质量的增大,分子间作用力逐渐增强,单质的熔、沸点随核电荷数的增加逐渐升高,故A正确; B.F2、Cl2、Br2、I2常温下分别为气体、气体、液体和固体,单质的密度随核电荷数的增加逐渐增大,故B正确; C.卤族元素单质从F到I,其颜色分别为:淡黄绿色、黄绿色、深红棕色、紫黑色,所以卤族元素单质的颜色随着核电荷数增大而加深,故C正确; D.元素非金属性越强,其单质的氧化性越强,卤族元素中,从F到I,其非金属性随着核电荷数增大而减弱,所以其单质的氧化性逐渐减弱,核电荷数大的卤素单质可被其它核电荷数小的卤素单质从其卤化物中置换出来,故D错误; 答案选D。 8.下列物质的性质比较中,正确的是( ) A. 气态氢化物稳定性:HF>HCl>HBr B. 氧化性:Na+>Al3+>Fe3+ C. 碱性:Al(OH)3>Mg(OH)2>NaOH D. 酸性:H2SO4>H2SiO3>H3PO4 【答案】A 【解析】 【分析】 【详解】A.非金属性越强,其简单气态氢化物的稳定性越强,F、Cl、Br位于同主族,同主族元素随核电荷数增大,非金属性逐渐减弱,非金属性:F>Cl>Br,则气态氢化物稳定性:HF>HCl>HBr,故A正确; B.金属性越强,金属单质的还原性越强,其最高价阳离子的氧化性越弱,金属单质的还原性:Na>Al>Fe,则氧化性:Na+<Al3+<Fe3+,故B错误; C.金属性越强,最高价氧化物对应水化物的碱性越强,Al、Mg、Na位于同周期,同周期元素随核电荷数增大,金属性逐渐减弱,金属性:Al<Mg<Na,则碱性:Al(OH)3<Mg(OH)2<NaOH,故C错误; D.非金属性越强,最高价氧化物对应水化物的酸性越强,S、P、Si位于同周期,同周期元素随核电荷数增大,非金属性逐渐增强,非金属性:S>P>Si,则酸性:H2SO4>H3PO4>H2SiO3,故D错误; 答案选A。 9.与50mL0.1mol/LNa2CO3溶液中Na+的物质的量浓度相同的溶液是( ) A. 25mL0.2mol/L的NaCl溶液 B. 100mL0.1mol/L的NaCl溶液 C. 25mL0.2mol/L的Na2SO4溶液 D. 10mL0.5mol/L的Na2CO3溶液 【答案】A 【解析】 【详解】50mL 0.1mol/L的Na2CO3溶液中Na+的物质的量浓度为0.1mol/L×2=0.2mol/L; A.25mL0.2mol/L的NaCl溶液中Na+的物质的量浓度为0.2mol/L×1=0.2mol/L,故A符合题意; B.100mL0.1mol/L的NaCl溶液中Na+的物质的量浓度为0.1mol/L×1=0.1mol/L,故B不符合题意; C.25mL0.2mol/L的Na2SO4溶液中Na+的物质的量浓度为0.2mol/L×2=0.4mol/L,故C不符合题意; D.10mL0.5mol/L的Na2CO3溶液中Na+的物质的量浓度为0.5mol/L×2=1mol/L,故D不符合题意; 答案选A。 10.14C是一种放射性同位素,在高层大气中由宇宙射线产生的中子或核爆炸产生的中子轰击14N可使它转变为14C。下列就法正确的是( ) A. 14C和14N互为同位素 B. 14C和14N具有相同的质子数 C. 核素中的中子数为8 D. 14CO2的摩尔质量为46 【答案】C 【解析】 【详解】A.质子数相同,中子数不同的同一元素的不同原子互称为同位素,14C和14N的质子数不同,是不同元素的核素,不互为同位素,故A错误; B.质子数决定元素的种类,质子数不同元素种类不同,14C为碳元素的一种核素,质子数为6,14N为氮元素的一种核素,质子数为7,则二者质子数不同,故B错误; C.核素中质量数为14,质子数为6,则中子数=质量数-质子数=14-6=8,故C正确; D.摩尔质量的单位是g/mol,则14CO2的摩尔质量为46g/mol,故D错误; 答案选C。 11. 下列关于化学键的叙述中,正确的是( ) A. 离子化合物可能含共价键 B. 共价化合物可能含离子键 C. 离子化合物中只含离子键 D. 只有活泼金属与活泼非金属间才能形成离子键 【答案】A 【解析】 【详解】A.离子化合物中可能含有共价键,如NaOH中含有共价键,也可能不含共价键,如NaCl, A正确; B.共价化合物只含共价键,一定不含离子键,B错误; C.离子化合物中可能含有共价键,如NaOH、Na2O2中都含有共价键,但NaOH、Na2O2是离子化合物,C错误; D.NH4Cl完全是非金属元素,但该化合物是离子化合物,NH4+与Cl-之间通过离子键结合,说明不是只有活泼金属与活泼非金属间才能形成离子键,D错误; 故合理选项是A。 12.下列反应属于吸热反应的是( ) A. 锌粒与稀H2SO4反应 B. 盐酸与氢氧化钠溶液反应 C. 甲烷在空气中燃烧 D. Ba(OH)2·H2O晶体与NH4Cl晶体的反应 【答案】D 【解析】 【详解】A.锌粒与稀H2SO4反应是活泼金属与酸的反应,属于放热反应,故A不符合题意; B.盐酸与氢氧化钠溶液反应是酸碱中和反应,属于放热反应,故B不符合题意; C.所有的燃烧都是放热反应,甲烷在空气中燃烧是放热反应,故C不符合题意; D.Ba(OH)2·H2O晶体与NH4Cl晶体的反应是吸热反应,故D符合题意; 答案选D。 13.实验室用锌粒与2mol/L硫酸溶液制取氢气,下列措施不能增大化学反应速率的是( ) A. 用锌粉代替锌粒 B. 滴入几滴硫酸铜溶液 C. 改用5mol/L硫酸溶液 D. 改用冷的2mol/L硫酸溶液 【答案】D 【解析】 【详解】A.用锌粉代替锌粒,增大了反应物的接触面积,反应速率加快,故A不符合题意; B.滴入几滴硫酸铜溶液,锌比铜活泼,可置换出铜单质,构成铜锌原电池,反应速率加快,故B不符合题意; C.改用5mol/L硫酸溶液可以增大氢离子的浓度,增大浓度可增大反应速率,故C不符合题意; D.改用冷的2mol/L硫酸溶液,反应体系温度降低,降温可减慢反应速率,故D符合题意; 答案选D。 14.下列排列顺序正确的是( ) A. 热稳定性:H2O>HF>H2S B. 非金属性:Cl>S>Si C. 最高正化合价:F>N>C D. 酸性:H2CO3>H3PO4>H2SO4 【答案】B 【解析】 分析】 【详解】A.元素非金属性越强,对应的氢化物越稳定,非金属性F>O>S,热稳定性:HF>H2O>H2S,故A错误; B.Cl、S、Si位于同周期,同周期元素从左到由非金属性逐渐增强,则非金属性Cl>S>Si,故B正确; C.F的最高价为0,F没有正化合价,故C错误; D.元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,非金属性S>P>C,酸性:H2SO4>H3PO4>H2CO3,故D错误; 答案选B。 15.在2A(g) +B(g)3C(g) +4D(g) 反应中,表示该反应速率最快的是:( ) A. V(A)═0.5mol/(L·S) B. V(B)═0.3 mol/(L·S) C. V(C)═0.8 mol/(L·S) D. V(D)═1 mol/(L·S) 【答案】B 【解析】 【详解】同一个反应用不同的反应物及生成物表示的时候,化学反应速率之比等于其系数比,在比较的时候如果单位统一,直接将每种物质表示的速率直接除以其系数可直接得出大小,如A选项换算后为=0.25 mol/(L· s),B项换算后为0.3 mol/(L· s),C项换算后为=0.27 mol/(L· s),D项换算为==0.25 mol/(L· s),很显然B项最大。 答案选B。 16.下列表达方式错误的是 ( ) A. H∶Cl B. S2- C. D. O=C=O 【答案】A 【解析】 【详解】A.HCl为共价化合物,其电子式为,故A错误; B.硫原子得到两个电子变为硫离子,硫离子的核外电子排布示意图为:,电子数比质子数多两个,即负电荷比正电荷多2,则硫离子表示为S2-,故B正确; C.氧元素的质子数为8,表示核内中子数为10的氧原子,故C正确; D.二氧化碳分子中,每个氧原子分别与碳原子形成两个共用电子对,电子式为,每一个电子对代表一个共价键,每个共用电子对可用短线表示,则O=C=O表示CO2的分子结构式,故D正确; 答案为A。 17.下列各组化合物的性质比较中,不正确的是( ) A. 酸性:HClO4>HBrO4>HIO4 B. 碱性:NaOH>Mg(OH)2>Al(OH)3 C. 稳定性:PH3>H2S>HCl D. 非金属性:F>O>S 【答案】C 【解析】 【详解】A. 非金属性越强,气态氢化物的稳定性越强,最高价氧化物对应水化物的酸性越强,元素非金属性的强弱关系是:Cl>Br>I,酸性:HClO4>HBrO4>HIO4,故A正确; B.金属性强弱关系是:Na>Mg>Al,金属性越强,相应的碱碱性越强,碱性:NaOH>Mg(OH)2>Al(OH)3,故B正确; C.元素非金属性的强弱关系是:Cl>S>P,非金属性越强,气态氢化物的稳定性越强, 稳定性:PH3查看更多
相关文章
- 当前文档收益归属上传用户
- 下载本文档