四川省仁寿第一中学北校区2020届高三下学期第二次高考模拟理综-化学试题
7.化学 与生活紧密相关。下列有关的说法不正确的是
A.世界上最先使用口罩的是中国,古代侍者为防止气息传到皇帝的食物上使用丝巾做成口罩遮盖口鼻,丝巾的主要成分是蛋白质,丝属于天然纤维。
B.工业上可以通过选用合适的催化剂和温度降解泡沫塑料制得燃油和燃气
C.一次性防尘口罩虽不具备过滤细菌的作用,但可防气溶胶。烟、雾都是气溶胶,但分散剂不一样。
D.有大量氯气泄漏时,及时戴上用小苏打溶液润湿过的口罩,并迅速离开现场
8.设NA为阿伏加德罗常数的值,下列有关说法正确的是
A.用浓盐酸分别和MnO2、KClO3反应制备1 mol氯气,转移的电子数均为2NA
B.0. lmol环氧乙烷()中含有的共价键数为0. 3 NA
C.标准状况下,4.48 L 的乙烯与环丙烷中含有的电子对数为0.6NA
D.常温下,1L pH=9的CH3COONa溶液中,发生电离的水分子数为1×10-5 NA
9.叶蜡石是一种重要的化工原料,化学式为X2[Y4Z10](ZW)2,短周期元素W、Z、X、Y的原子序数依次增大,Y的最外层电子数为次外层的一半,X为地壳中含量最多的金属元素,X的离子与ZW-含有相同的电子数。下列说法不正确的是
A.原子半径:X>Y>Z>W B.最简单氢化物的沸点:Y>Z
C.Y的氧化物可作光导纤维的材料 D.常温常压下,Z和W形成的常见化合物均为液体
10. 某有机物可用作合成多种药物的原料,其结构如图所示,下列有关叙述不正确的是
A分子式为C8H8O2
B分子中所有碳原子处于同一平面
C在该有机物的同分异构体中属于芳香族化合物的有5种
D该有机物能发生加成、取代和酯化等反应
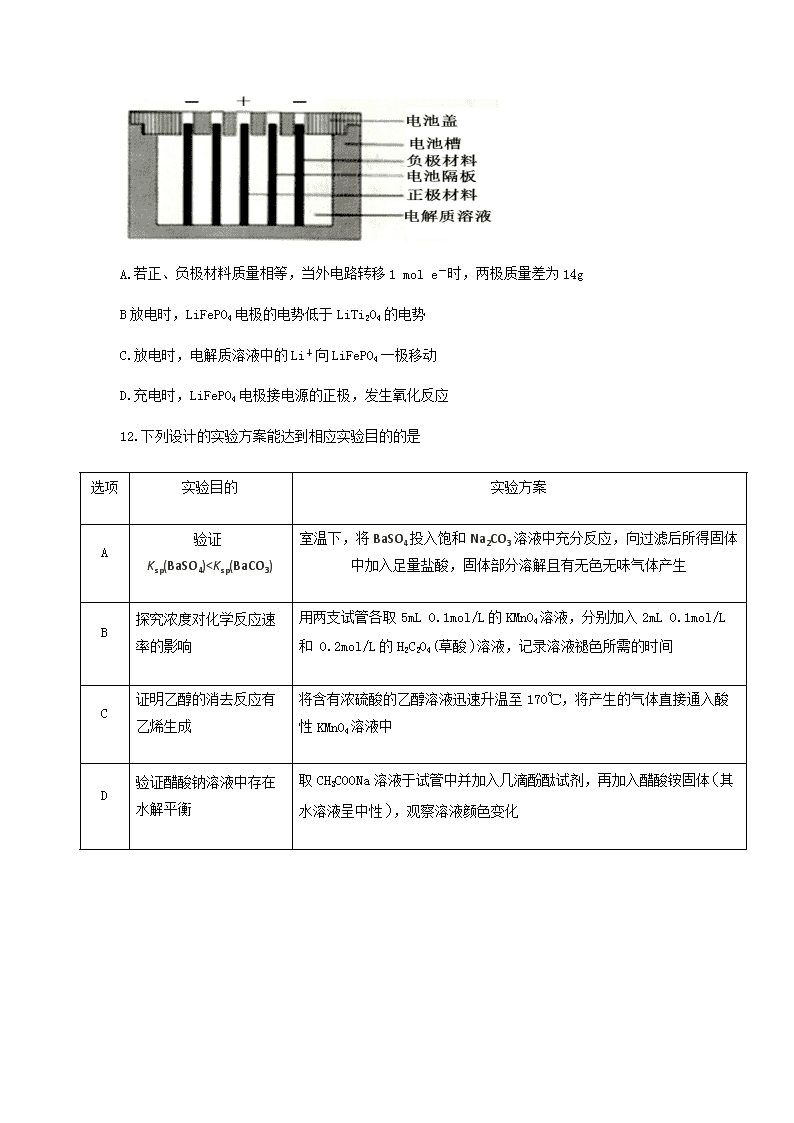
11..Persi等人以LiTi2O4作负极,LiFePO4作正极,采用LiClO4-EC-PC-PVdF凝胶作电解质溶液,组成新型锂离子二次电池,电池隔板只允许Li+通过,该锂离子二次电池的结构示意图如图,下列说法不正确的是
A.若正、负极材料质量相等,当外电路转移1 mol e-时,两极质量差为14g
B放电时,LiFePO4电极的电势低于LiTi2O4的电势
C.放电时,电解质溶液中的Li+向LiFePO4一极移动
D.充电时,LiFePO4电极接电源的正极,发生氧化反应
12.下列设计的实验方案能达到相应实验目的的是
选项
实验目的
实验方案
A
验证Ksp(BaSO4)
c(HMO4-)
C..图像中G点对应的溶液中c(Na+)=c(HMO4-)+2c(MO42-)
D.滴入NaOH溶液过程中水的电离程度一直增大
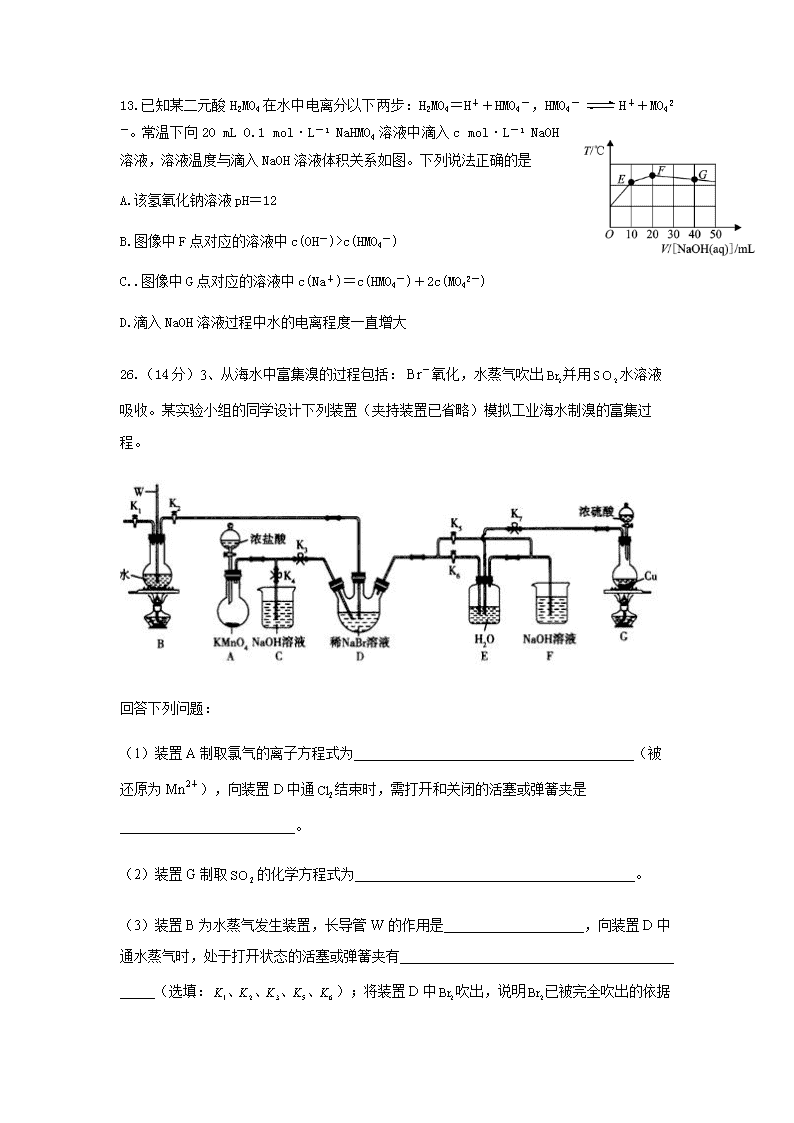
26.(14分)3、从海水中富集溴的过程包括:氧化,水蒸气吹出并用水溶液吸收。某实验小组的同学设计下列装置(夹持装置已省略)模拟工业海水制溴的富集过程。
回答下列问题:
(1)装置A制取氯气的离子方程式为________________________________________(被还原为),向装置D中通结束时,需打开和关闭的活塞或弹簧夹是_________________________。
(2)装置G制取的化学方程式为________________________________________。
(3)装置B为水蒸气发生装置,长导管W的作用是____________________,向装置D中通水蒸气时,处于打开状态的活塞或弹簧夹有_____ _____(选填:);将装置D中吹出,说明
已被完全吹出的依据是________ _________。
(4)溴蒸气被E中水溶液吸收的离子方程式为______________________________。
27.(14分)从铜氨废液含[Cu(NH3)3·CO]+、[Cu(NH3)2]2+、[Cu(NH3)4]2+、NH3、CH3COO−、CO等中回收铜的工艺流程如图:
(1)步骤(Ⅰ)“吹脱”的目的是 (写一条即可);由步骤(Ⅱ)可确定NH3与H+的结合能力比与Cu2+的 (填“强”或“弱”)。
(2)步骤(Ⅲ)“沉铜”时,Na2S的用量比理论用量多,目的是 。
(3)步骤(Ⅳ)反应中,氧化产物与还原产物的物质的量之比为 。
(4)步骤(Ⅵ)发生反应生成难溶Cu2(OH)3Cl的离子方程式为 ,pH与铜的回收率关系如图(a)所示,为尽可能提高铜的回收率,需控制的pH约为___。
(5)“吹脱”后的铜氨溶液中加入适量的添加剂可直接电解回收金属铜,装置如图(b)所示,阴极主要发生的电极方程式为 ;添加NaCl和H2SO4
均可提高电导率和电流效率,从而提高铜的回收率,从环境角度考虑,较好的是___(填“NaCl”或“H2SO4”)。
(6)已知上述流程中只有步骤(Ⅲ)“沉铜”和步骤Ⅴ“制硫酸铜”中铜元素有损耗。步骤(Ⅲ)“沉铜”时铜元素的损耗率为4%;步骤Ⅴ“制硫酸铜”时铜元素损耗率为2%。若1L废液最终制得CuSO4·5H2O 375g,则1L废液中含有铜元素的质量为___g。(保留整数)
28.(14分)CO2的资源化利用能有效的减少CO2的排放,方法之一是CO2催化加氢合成二甲醚(CH3OCH3)。
(1)下列图像符合稀盐酸与稀氢氧化钠溶液反应的能量变化过程的是 。
(2)CO2催化加氢合成二甲醚的主要反应如下:
反应I:CO2(g)+H2(g) CO(g)+H2O(g) △H=+41.2 kJ·mol-1
反应II:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) △H=-122.5 kJ·mol-1
其中,反应II分以下①②两步完成,请写出反应①的热化学方程式。
②_x0001_
②2CH3OH(g) CH3OCH3(g)+H2O(g) △H=-23.5 kJ·mol-1
(3)分别在2L恒温密闭容器甲(恒温恒容)、乙(恒温恒压)中,加入CO2和H2各1 mol的混合气体,假设只发生反应Ⅱ,则两容器中反应达平衡后放出或吸收的热量较多的是 (填“甲”或“乙”)。当反应5 min时,测得甲容器中压强变为原来的一半,则用CO2表示的反应的速率= 。
(4) 在体积为1L的恒容密闭容器中,充入1 mol CO2和2 mol H2,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图。其中:
①温度高于280℃,温度对CO2平衡转化率影响较大的是反应____(填“I”或“Ⅱ”)。
②温度为220℃,达到平衡时,反应II消耗的H2的物质的量为 mol,此状态反应II的化学平衡常数计算式为 。
35.[化学——选修3:物质结构与物质](15分)
氧族元素是指位于元素周期表第16列的元素,包括氧、硫、硒(Se)、碲(Te)、钋(Po)五种元素。
(1)CH3NH3+、Ti4+、Pb2+、C1-等离子是组成新型钙钛矿太阳能电池的主要离子。CH3NH3+
离子中H—N—H键的键角比NH3分子中H—N—H键的键角______(填“大”或“小”),
原因是______________________________________________________________。
(2)臭鼬排放的臭气主要成分为3-MBT(3-甲基-2-丁烯硫醇,结构如下图)。
3-MBT中碳原子的杂化为_______、___________。沸点:3-MBT____(CH3)2C=CHCH2OH(填“高于”或“低于”),主要原因是_______________________________。
(3)元素X与硒同周期,X元素原子核外未成对电子在同周期元素中数最多,X为_________(填元素符号),X的基态原子的价电子排布式为______________。
(4)金属钛晶胞(如图1所示)中有若干个正四面体空隙,图1中a、b、
c、d四个钛原子形成的正四面体其内部空隙中可以填充其他原子。
①请回答,金属钛晶胞的结构属于______
a. 简单立方 b. 体心立方 c. 面心立方 d. 金刚石型
②若晶胞中所有的正四面体空隙中都填充氢原子,那么形成的
氢化钛的化学式为________________。
(5)某钙钛矿太阳能电池材料的晶胞如图2所示,其晶胞参数为
dpm、密度为ρg·cm-3。则该晶体的摩尔质量____g·mol-1。
(用含d、ρ等符号的式子表示,用NA表示阿伏加德罗常数的值)
理科综合能力测试化学参考答案
7C 8D 9B 10C 11B 12D 13B
26、(14分,每空2分)
(1)2MnO4-+16H++10Cl-==2Mn2++5Cl2↑+8H2O,打开,关闭;
(2). Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O;
(3). 使瓶中的气压与大气压相等; ;D中溶液及液面上气体已变为无色;
(4). Br2+SO2+2H2O==4H++SO42-+2Br-
27、(15分,除标注外,每空2分)
(1)将Cu(Ⅰ)氧化为Cu(Ⅱ)、将CO氧化并以CO2吹出、吹出游离的NH3等(1分) 强(1分)
(2)使Cu2+尽可能沉淀完全,降低残留率 (3)3∶2
(4)2[Cu(NH3)4]2++Cl−+5H++3H2O=Cu2(OH)3Cl↓+8NH 6(或5.5−6.5)
(5)[Cu(NH3)4]2++2e−=Cu+4NH3 H2SO4(1分)
(6)102
28、(14分,每空2分)
(1)D (2)CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.5 kJ·mol-1
(3)乙 0.05mol/(L•min) (4) ① I ②1.2 (或)
35、(15分,除标注外,每空2分)
(1)大 (1分)成键电子(C-N键)对H-N键的排斥力小于孤电子对对H-N键的排斥力(2分)
(2)SP3、SP2(2分);低于(1分);(CH3)2C=CHCH2OH分子间含有氢键,增强分子间作用力,使沸点升高(2分)
(3)Cr(1分); 3d54s1(1分)
(4)①c (1分) ②TiH2(2分)
(6)dρNA×10-30(2分)