- 2021-04-16 发布 |
- 37.5 KB |
- 12页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考模拟试题
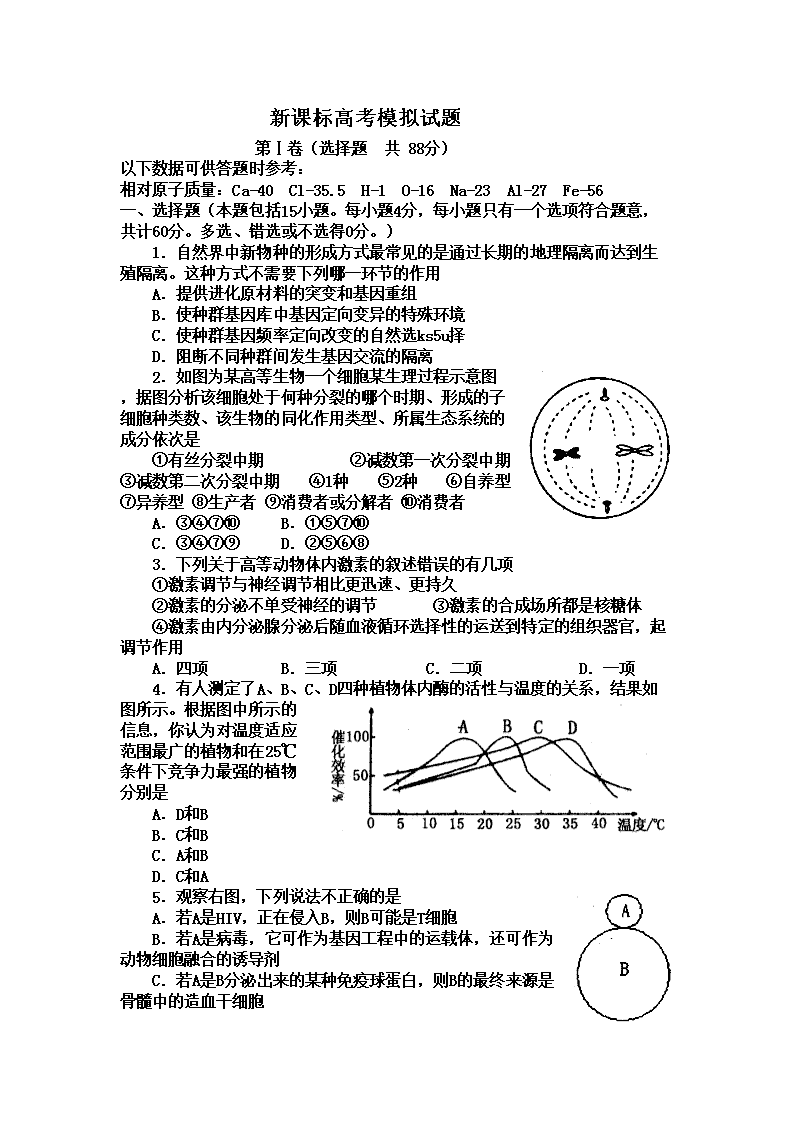
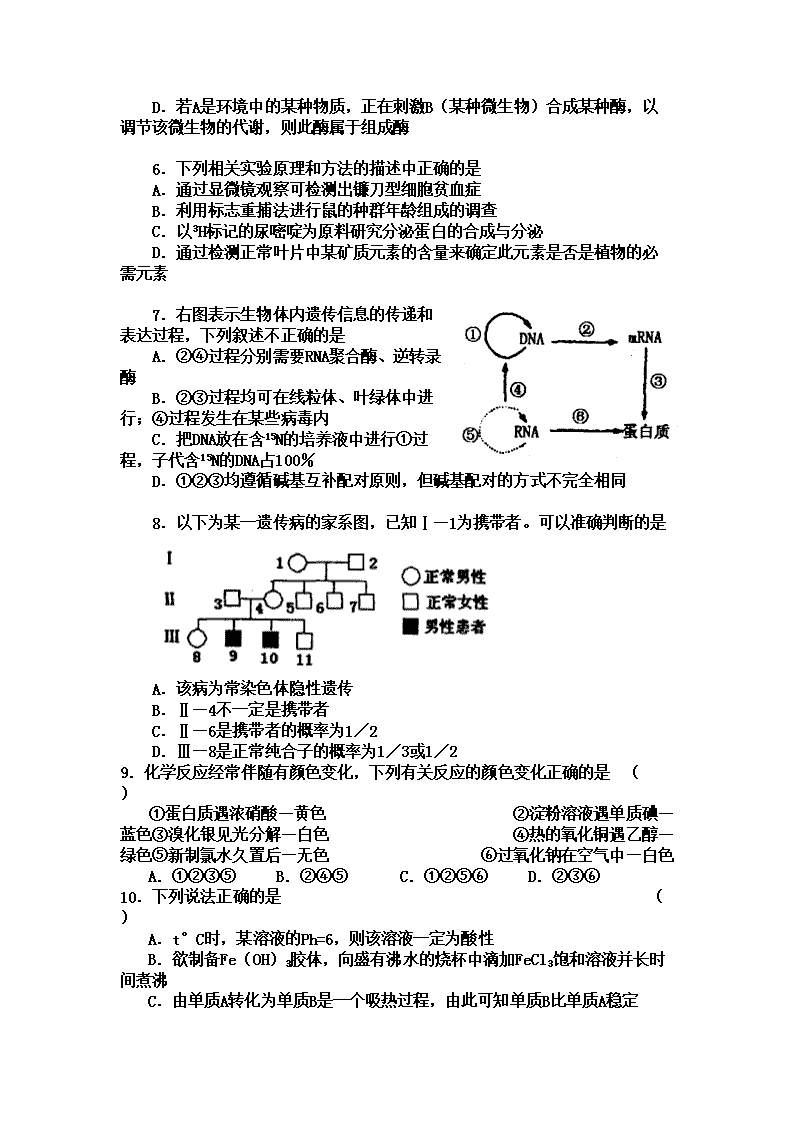
新课标高考模拟试题 第Ⅰ卷(选择题 共 88分) 以下数据可供答题时参考: 相对原子质量:Ca-40 Cl-35.5 H-1 O-16 Na-23 Al-27 Fe-56 一、选择题(本题包括15小题。每小题4分,每小题只有一个选项符合题意,共计60分。多选、错选或不选得0分。) 1.自然界中新物种的形成方式最常见的是通过长期的地理隔离而达到生殖隔离。这种方式不需要下列哪一环节的作用 A.提供进化原材料的突变和基因重组 B.使种群基因库中基因定向变异的特殊环境 C.使种群基因频率定向改变的自然选ks5u择 D.阻断不同种群间发生基因交流的隔离 2.如图为某高等生物一个细胞某生理过程示意图,据图分析该细胞处于何种分裂的哪个时期、形成的子细胞种类数、该生物的同化作用类型、所属生态系统的成分依次是 ①有丝分裂中期 ②减数第一次分裂中期 ③减数第二次分裂中期 ④1种 ⑤2种 ⑥自养型 ⑦异养型 ⑧生产者 ⑨消费者或分解者 ⑩消费者 A.③④⑦⑩ B.①⑤⑦⑩ C.③④⑦⑨ D.②⑤⑥⑧ 3.下列关于高等动物体内激素的叙述错误的有几项 ①激素调节与神经调节相比更迅速、更持久 ②激素的分泌不单受神经的调节 ③激素的合成场所都是核糖体 ④激素由内分泌腺分泌后随血液循环选择性的运送到特定的组织器官,起调节作用 A.四项 B.三项 C.二项 D.一项 4.有人测定了A、B、C、D四种植物体内酶的活性与温度的关系,结果如图所示。根据图中所示的信息,你认为对温度适应范围最广的植物和在25℃条件下竞争力最强的植物分别是 A.D和B B.C和B C.A和B D.C和A 5.观察右图,下列说法不正确的是 A.若A是HIV,正在侵入B,则B可能是T细胞 B.若A是病毒,它可作为基因工程中的运载体,还可作为动物细胞融合的诱导剂 C.若A是B分泌出来的某种免疫球蛋白,则B的最终来源是骨髓中的造血干细胞 D.若A是环境中的某种物质,正在刺激B(某种微生物)合成某种酶,以调节该微生物的代谢,则此酶属于组成酶 6.下列相关实验原理和方法的描述中正确的是 A.通过显微镜观察可检测出镰刀型细胞贫血症 B.利用标志重捕法进行鼠的种群年龄组成的调查 C.以3H标记的尿嘧啶为原料研究分泌蛋白的合成与分泌 D.通过检测正常叶片中某矿质元素的含量来确定此元素是否是植物的必需元素 7.右图表示生物体内遗传信息的传递和表达过程,下列叙述不正确的是 A.②④过程分别需要RNA聚合酶、逆转录酶 B.②③过程均可在线粒体、叶绿体中进行;④过程发生在某些病毒内 C.把DNA放在含15N的培养液中进行①过程,子代含15N的DNA占100%高考资源网 D.①②③均遵循碱基互补配对原则,但碱基配对的方式不完全相同 8.以下为某一遗传病的家系图,已知Ⅰ—1为携带者。可以准确判断的是 A.该病为常染色体隐性遗传 B.Ⅱ—4不一定是携带者 C.Ⅱ—6是携带者的概率为1/2 D.Ⅲ—8是正常纯合子的概率为1/3或1/2 9.化学反应经常伴随有颜色变化,下列有关反应的颜色变化正确的是 ( ) ①蛋白质遇浓硝酸—黄色 ②淀粉溶液遇单质碘—蓝色③溴化银见光分解—白色 ④热的氧化铜遇乙醇—绿色⑤新制氯水久置后—无色 ⑥过氧化钠在空气中—白色 A.①②③⑤ B.②④⑤ C.①②⑤⑥ D.②③⑥ 10.下列说法正确的是 ( ) A.t°C时,某溶液的Ph=6,则该溶液一定为酸性 B.欲制备Fe(OH)3胶体,向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间煮沸 C.由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定 D.甘油不是油,纯碱不是碱,酚醛树脂不是酯,干冰不是冰 11.设NA表示阿伏加德罗常数,下列说法错误的是 ( ) A.在标准状况下,VLSO3,含氧原子个数是3V/22.4NA B.1mol甲基(—CH3)中所含有电子数为9NA C.25°C时,1LpH=13的Ba(OH)2溶液中含有OH-的数目为0.1NA D.2.8g乙烯与丙烯的混合物中含碳原子的数目为0.2NA 12.A、B、C均为短周期的元素,A、B同周期,A、C的最低价离子分别为A2-和C-,B2+和C-具有相同的电子层结构,下列说法正确的是 ( ) A.C元素的最高正价为+7价 B.原子半径:A>B>C C.离子半径:A2—>C—>B2+ D.还原性:A2-<C— 13.下列关于有机物的说法正确的是 ( ) A.乙醇、乙烷和乙酸都可以与钠反应生成氢气 B.75%(体积分数)的乙醇溶液常用于医疗消毒 C.苯和乙烯都可以使溴的四氯化碳溶液裉色 D.石油分馏可获得乙酸、苯及其衍生物 14.下列离子方程式正确的是 ( ) A.过量铁粉溶于稀HNO3中:Fe+NO3—+4H+=Fe3++NO↑+2H2O B.过氧化钠固体与水反应:2O+2H2O=4OH—+O2↑ C.次氯酸钙溶液中通入过量二氧化碳: Ca2++2ClO—+CO2+H2O=====CaCO3↓+2HClO D.过量NaHSO4溶液加入到Ba(OH)2溶液中: 2H++SO+Ba2++2OH—=2H2O+BaSO4↓ 15.25 ℃时,在20 mL的盐酸中,逐滴加入0.2 mol·L-1的氨水,溶液的pH与氨水体积关系如图所示,则下列说法正确的是 A.滴加前盐酸的物质的量浓度为0.1 mol·L-1 B.B点的横坐标a=10 C.A、B间的任一点,溶液都有c(Cl-)>c(NH4+)> c (H+)> c(OH-) D.如果将氨水换为NaOH溶液,则滴加20mL时溶液的pH一定小 二、选择题(本题包括7小题,每小题给出的四个选项中,有的只有一个选项正确,有的有多个选项正确,全部选对的得4分,选对但选不全的得2分,有选错的得0分。共计28分) 16.如图所示,一轻质横杆两侧各固定一金属环,横杆可绕中心点自由转动,拿一条形磁铁插向其中一个小环,后又取出插向另一个小环.发生的现象是 ( ) A.磁铁插向左环,横杆发生转动 B.磁铁插向右环,横杆发生转动 C.无沦磁铁插向左环还是右环,横杆都不 发生转动 D.无论磁铁插向左环还是右环,横杆都发 生转动 17.我国于2010年3月5日成功发射了“遥感卫星九号”,在绕地球运行的过程中,该卫星 受到地球引力的大小 A.只与地球的质量有关 B.只与卫星的质量有关 C.与地球和卫星的质量均有关 D.与地球和卫星的质量均无关 18.在电梯加速上升的过程中,站在电梯里的人 A.所受支持力做正功,机械能增加 B.所受支持力做正功,机械能减少 C.所受支持力做负功,机械能增加 D.所受支持力做负功,机械能减少 19.一带电粒子在电场中仅在电场力作用下,从A点运动到B点,速度随时间变化的图象如图所示,分别是带电粒子到达A、B两点时对应的时刻,则下列说法中正确的有 ( ) A.A处的场强一定大于B处的场强 B.A处的电势一定高于B处的电势 C.电荷在A处的电势能一定小于在B处的 电势能 D.电荷在A到B过程中.电场力一定对电 荷做正功 20.如图所示,四个电表均为理想电表,当滑动变 阻器滑动触头P向左端移动时,下面说法中 正确的是 ( ) A.伏特表V1的渎数减小,安培表A1的读数增大 B.伏特表V1的读数增大,安培表A1的读数减小 C.伏特表V2的读数减小,安培表A2的读数增大 D.伏特表V2的读数增大,安培表A2的读数减小 21.为了减少输电线路中电力损失,发电厂发出的电通常是经过升压 变电站升压后通过远距离输送,再经过降压变电站将高压变为低 压.某降压变电站将电压的交流电 降为220 V供居民小区用电,则变电站变压器 ( ) A.原、副线圈匝数比为50:l B.副线圈中电流的频率是50 Hz C.原线圈的导线比副线圈的要粗 D.输入原线圈的电流等于居民小区各用电器 电流的总和 22.一段直导线悬挂在蹄形磁铁的两极间,通以如图所示的电流后,该直导线所受安培力的方向是 A.向上 B.向下 C.向左 D.向右 第Ⅱ卷 (非选择题,必做120分+选做32分,共152分) 注意事项: 1. 第Ⅱ卷共16个小题。其中23—30题为必做题,31—38题为选做题。考生必须从选做题中选择2个物理、1个化学和1个生物题作答。 2.考生须用黑色签字笔将答案写在答题纸上规定的位置,在试题卷上答题无效。 【必做部分】 23.(1)某学生用打点计时器研究小车的匀变速直线运动.他将打点计时器接到频率为50 Hz的交流电源上,实验时得到一条纸带.他在纸带上便于测量的地方选取第一个计时点,在这点下标明A,第六个点下标明B,第十一个点下标明C,第十六个点下标明D,第二十一个点下标明E.测量时发现B点已模糊不清,于是他测得AC长为14.76 cm、CD长为11.25 cm,DE长为13.83 cm,则打(:点时小车的瞬时速度大小为m/s.(保留三位有效数字) (2).热敏电阻是传感电路中常用的电子元件.现用伏安法研究热敏电阻在不同温度下的伏安特性曲线,要求特性曲线尽可能完整.已知常温下待测热敏电阻的阻值约4~5 热敏电阻和温度计插入带塞的保温杯中,杯内有一定量的冷水,其它备用的仪表和器具有: A.电流表A1,量程0.6 A,内阻约1 B.电流表A2,量程3 A,内阻约2 C.电压表V1,量程15 V,内阻约15 k D.电压表V2,量程3 V,内阻约5 k E.滑动变阻器R1(0~100) F.滑视变阻器R2(0~20) G.电源E(3 V、内阻可忽略) H.盛有热水的热水杯(图中未画出) I.开关、导线若干 (1)实验中应选用的电流表为(填“A1”或“A2”),应选用的电压表为(填 “V1”或“V2”),应选用的滑动变阻器为(填“R1”或“R2”) (2)在图(a)的方框中画出实验电路原理图,要求测量误差尽可能小. (3)根据电路原理图,在图(b)的实物图上连线. 24(8分) 如图所示,水平轨道与直径为d=0.8m的半圆轨道相接,半圆轨道的两端点A、B连线是一条竖直线,整个装置处于方向水平向右,大小为103V/m的匀强电场中,一小球质量m=0.5kg,带有q=5×10-3C电量的正电荷,在电场力作用下由静止开始运动,不计一切摩擦,g=10m/s2, (1)若它运动的起点离A为L,它恰能到达轨道最高点B,求小球在B点的速度和L的值. (2)若它运动起点离A为L=2.6m,且它运动到B点时电场消失,它继续运动直到落地,求落地点与起点的距离. 25.如图所示,在xoy坐标平面的第一象限内有沿-y方向的匀强电场,在第四象限内有垂直于平面向外的匀强磁场。现有一质量为m,带电量为+q的粒子(重力不计)以初速度v0沿-x方向从坐标为(3l、l)的P点开始运动,接着进入磁场,最后由坐标原点射出,射出时速度方向与y轴方间夹角为45º,求: (1)粒子从O点射出时的速度v和电场强度E; (2)粒子从P点运动到O点过程所用的时间。 26.(13分)下面是以小麦为材料所进行的实验,请回答有关问题: (1)将发芽种子的研磨液置于试管中加入斐林试剂并沸水浴,试管中出现砖红色沉淀,说明发芽的小麦种子中含有__________; (2)为了研究小麦的染色体数目、大小和形态特征,应用显微镜观察根尖___________区处于中期的细胞,若以适宜浓度的秋水仙素处理小麦的幼根,则处理后细胞中染色体数目将加倍,原理是秋水仙素能够_________________________________________。 (3)若利用小麦根尖成熟区细胞做细胞质壁分离与复原实验,为了取得更好的观察效果,调节显微镜的措施为____________________________; (4)在小麦种子入库前要反复晾晒,以减少自由水的含量,仓库要控制低温、干燥、低氧的条件,其目的是降低_______________________________________; (5)在小麦种子形成过程中,若胚乳的基因型为AaaBbb,则胚的基因型为__________。 27。I(12分)下图表示病原体侵入人体后机体发生的体液免疫过程。 请回答: (1)②表示___________________________过程。 (2)与e细胞功能相适应的膜性细胞器有___________________________。 (3)预防接种后,当病原体侵人时,体液免疫的主要途径是____________(用图中数字表示),其特点是__________________________,因此可迅速消灭病原体,有效预防某些疾病。 (4)图中b细胞成熟于____________________,当病原体侵入细胞后,这类细胞增殖分化产生的___________________细胞会与靶细胞接触高考资源网,使之释放抗原。 II.(10分)下图是某生态农业的结构模式图,请据图分析回答: (1)该生态系统的主要成分是图中的____________,它是生态系统的基石。 (2)从生态系统的组成成分看,图中未标出的是_______________________。 (3)从生态学角度分析,人们建立图示农业生态系统的目的是_________。(从下列选项中选择,填字母代号) A.实现物质和能量的多级利用 B.减少环境污染 C.提高农产品的产量 D.延长食物链,使系统总能量利用效率降低 (4)若人直接从农作物获取的能量占4/5,则人增加1 kg体重,至少需要农作物__________kg。 (5)生态系统的主要功能是物质循环和能量流动,它们之间的关系是________________ ________________________________________________________________________。 28.(12分)运用相关原理,回答下列各小题: Ⅰ.已知NaHSO4在水中的电离方程式为 NaHSO4=Na+ + H+ + SO42- 。 (1)在NaHSO4溶液中c(H+) c(OH-)+ c(SO42-)(填 “>”、“=”或“<”下同);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则反应后溶液的pH7。 (2)将20mLpH=2的NaHSO4溶液逐滴加入到20mL 0.1 mol·L-1Na2CO3溶液中,溶液中发生反应的离子方程式为:;向此反应后的溶液中滴加0.001 mol·L-1BaCl2溶液,首先析出的沉淀是。[KSP(BaSO4)=1.1×10-10mol2·L-2 ;KSP(BaCO3)=5.1×10-9mol2·L-2] Ⅱ.(1)工业上电解硫酸锌溶液可实现电解法炼锌(控制条件,使H+难放电、阳极电极不溶解)。写出相关的电解化学方程式:。 (2)将干净的铁片浸在熔化的液体锌里可制得热镀锌铁板,这种铁板具有很强的耐腐蚀能力。镀锌铁板的镀锌层一旦被破坏后,锌将作为原电池的极发生反应而损耗,铁受到保护。 29.(14分)CO和H2可作为能源和化工原料,应用十分广泛。 (1)已知:C(s)+O2 (g) ===CO2(g) △H1=﹣393.5kJ·mol-1 2H2(g)+O2(g)=== 2H2O(g) △H2=﹣483.6kJ·mol-1 C(s)+H2O(g)=== CO(g)+H2(g) △H3=+131.3kJ·mol-1 则反应CO(g)+H2(g)+O2(g)=== H2O(g)+CO2(g)的 △H=kJ·mol-1。 标准状况下的煤炭气(CO、H2)33.6L与氧气反应生成CO2和H2O,反应过程中转移mol电子。 (2)熔融碳酸盐燃料电池(MCFS),是用煤气(CO+H2)作负极燃气,空气与CO2的混合气为正极助燃气,用一定比例的Li2CO3和Na2CO3低熔点混合物做电解质,以金属镍(燃料极)为催化剂制成的。负极的电极反应式为:CO+H2-4e-+2CO32-→3CO2+H2O;则该电池的正极反应式是:。 (3)密闭容器中充有10 mol CO与20mol H2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g)CH3OH(g);CO的转化率(α)与温度、压强的关系如下图所示。 ①若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为10L,则该温度下的平衡常数K=;此时在B点时容器的体积VB10L(填“大于”、“小于”或“等于”)。 ②若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tAtC(填“大于”、“小于”或“等于”)。 ③在不改变反应物用量情况下,为提高CO转化率可采取的措施是。 30.(16分)黄铁矿的主要成分是FeS2。测定黄铁矿中FeS2含量的两种方法如下图所示: 黄铁矿 王水 过滤 方法一 方法二 过滤、洗涤 过滤、洗涤 灼烧 干燥、称重 冷却、称量 加入氨水 加入BaCl2溶液 已知:①王水是由1体积的浓硝酸(ρ=1.42g·cm-3)和3体积的浓盐酸(ρ=1.19g·cm-3)混合而成的。 ②黄铁矿和王水反应的方程式为FeS2+5HNO3+3HCl=FeCl3+2H2SO4+5NO↑+2H2O 请回答下列问题: (1)简述实验室配制王水的操作过程_____________________________________________________________________________________________________。 (2)方法一中过滤、洗涤、灼烧都用到的仪器是_______________。 (3)方法二中要判断BaCl2溶液是否过量,可向滤液中加入X溶液,X可以是_________(填代号) A.BaCl2 B.NaOH C.Na2SO4 D.HCl (4)实验室利用下列装置和试剂制取少量氯化氢气体 试剂:①浓硫酸 ②浓盐酸 ③食盐固体 若选用试剂①③,则应选择的装置是___________(填代号,下同);推测发生反应的化学方程式为__________________________________________________; 若选用试剂①②,则宜选择的装置是____________。 (5) 方法一中,灼烧时发生反应的化学反应方程式为________________________ ;已知称取黄铁矿样品的质量为1.50g,称得灼烧后固体的质量为0.8g,不考虑操作误差,则该矿石中FeS2的质量分数是________________。 【选做部分】 共8道题,考生必须从中选择2道物理题、1道化学题、1道生物题在答题纸规定的区域作答。 31.(8分)【化学 -化学与技术】 电解原理在工业有广泛的应用。利用相关知识回答下面的问题。 (1)铝的阳极氧化:在进行电解以前,要对铝电极进行表面处理,是将铝片浸入热的16%NaOH溶液中半分钟左右,目的是,反应的离子方程式为 。铝的阳极氧化时,铝与电源的极(填写正、负极)相连。 (2)电解原理的运用:在右图装置中,溶液的体积为100mL,开始时电解质溶液的浓度为0.1mol/L,工作一段时间后导线上通过0.001mol电子。若不考虑盐的水解和溶液体积的变化,则电解后溶液的pH值为____________。 (3)电镀是运用电解原理,在金属表面形成一薄层有抗腐蚀、抗磨损能力的金属镀膜的过程。例如:在铜片上电镀银时,电解原理是:采用AgNO3溶液为电解质,用作阳极。而在实际的电镀工艺中,要求金属在镀件上的析出速率得到控制,使析出的镀层厚度均匀、光滑致密、与底层金属的附着力强。所以在铁件上电镀铜时,实际使用的电镀液是。 A.FeCl2 B.CuCl2 C.K6[Cu(P2O7)2] D.CuSO4 32.(8分)【化学 -物质结构与性质】 利用有关知识回答下列问题: (1)B、F两元素形成的化合物的空间构型为,其中心原子的杂化类型为 。 (2)CH4与(写微粒符号)互为等电子体。 (3)写出元素Cu基态原子的电子排布式。 (4)Fe与CO可形成的Fe(CO)5型化合物,该化合物常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断该化合物晶体属于 晶体(填晶体类型)。 (5)Zn的离子的氢氧化物不溶于水,但可溶于氨水中,该离子与NH3间结合的作用力为。 (6)金属Fe的晶体在不同温度下有两种堆积方式,晶胞分别如右图所示。体心立方 面心立方 则面心立方晶胞和体心立方晶胞中实际含有的原子个数之比为。 33.(8分)【化学- 有机化学基础】 下图中,A无酸性,不能水解,在一定条件下发生消去反应可得到两种互为同分异构体的产物,其中的一种B含有一个甲基,可用于制取合成树脂、染料等多种化工产品。E能使溴水退色,不能发生银镜反应。 C 试回答下列问题; (1)写出B、E的结 构简式 B、 E (2)写出D中官能 团的名称, E生成D的反应类型是 (3)写出A生成C的化学方程式 (4)C的同分异构体C1与C具有相同的官能团,两分子C1脱去两分子水形成含有六元环的化合物,写出C1可能的结构简式、。 34.(8分)【生物——生物技术实践】 科学家发现家蝇体内存在一种抗菌活性蛋白,这种蛋白质具有极强的抗菌能力,受到研究者重视。分析回答: (1)分离该抗菌蛋白可用电泳法,其原理是根据蛋白质分子的 、大小及形状不同,在电场中的 不同而实现分离。 (2)可用金黄色葡萄球菌来检验该蛋白的抗菌特性。抗菌实验中所用培养基中的牛肉膏和蛋白胨主要为细菌生长提供 和 。 (3)分别在加入和未加入该抗菌蛋白的培养基中接种等量菌液。培养一定时间后,比较两种培养基中菌落的 ,确定该蛋白质的抗菌效果。 (4)细菌培养常用的接种方法有 和。实验结束后,对使用过的培养基应进行 处理。 36.(8分)【物理——物理3—3】 (1)一种油的密度为,摩尔质量为M。取体积为V的油慢慢滴出,可滴n滴。将其中一滴滴在广阔水面上形成面积为S的单分子油膜,求阿伏加伽德罗常数。 37.(8分)【物理——物理3—4】 Q y/cm x/m 3 0 9 P 5 -5 第37(1)题图 (1)一列简谐横波在t=0时刻的波形如图所示,质点P此时刻沿-y运动,经过0.1s第一次到达平衡位置,波速为5m/s,那么 ①判断该波的传播方向; ②试通过计算判断质点P在哪些时刻恰好沿+y方向经过平衡位置?查看更多