2020高考化学二轮复习能力提升训练16物质结构与性质选修3含解析
能力提升训练(16)
1.已知A、B、C、D四种短周期元素,它们的核电荷数依次增大。A原子、C原子的L能层中都有两个未成对的电子,C、D同主族。E、F都是第4周期元素,E原子核外有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满。根据以上信息填空:
(1)基态D原子中,电子占据的最高能层符号是M,该能层具有的原子轨道数为9。
(2)E2+的价层电子排布图是,F原子的核外电子排布式是1s22s22p63s23p63d104s1。
(3)A元素的最高价氧化物对应的水化物中心原子采取的轨道杂化方式为sp2,B元素的气态氢化物的分子模型为三角锥形。
(4)化合物AC2、B2C和阴离子DAB-互为等电子体,它们结构相似,DAB-的电子式为[C]-。
解析:A、B、C、D四种短周期元素,它们的核电荷数依次增大,A原子、C原子的L能层中都有两个未成对的电子,则A为碳,C为氧,B介于碳和氧之间,则B是氮,C、D同主族,D为硫,E、F都是第4周期元素,E原子核外有4个未成对电子,E为Fe,F原子除最外能层只有1个电子外,其余各能层均为全充满,F原子核外电子数=2+8+18+1=29,则F为铜元素。
(1)基态硫原子中电子占据的最高能层为第3能层,符号为M,该能层有1个s轨道、3个p轨道、5个d轨道,共有9个原子轨道。
(2)Fe2+的价层电子排布式为3d6,其价层电子排布图是,F为铜元素,原子核外有29个电子,原子的核外电子排布式是1s22s22p63s23p63d104s1。
(3)碳元素的最高价氧化物对应的水化物为H2CO3,分子结构式为,中心碳原子成3个σ键、没有孤电子对,碳原子采取sp2杂化方式;B的气态氢化物为NH3,为三角锥形结构。
(4)化合物CO2、N2O和阴离子SCN-互为等电子体,它们结构相似,SCN-的电子式为[C]-。
2.(1)固体可分为晶体、非晶体和准晶体三大类,可通过X射线衍射方法区分晶体、非晶体和准晶体,以色列科学家丹尼尔·谢赫特曼因发现锰的化合物准晶体而获得了2011年诺贝尔化学奖。基态Mn原子的电子排布式为[Ar]3d54s2。
7
(2)PCl3的立体构型为三角锥形,中心原子的杂化轨道类型为sp3。
(3)硼的卤化物在工业中有重要作用,硼的四种卤化物的沸点如下表所示。
BF3
BCl3
BBr3
BI3
沸点/K
172
285
364
483
①四种卤化物沸点依次升高的原因是分子结构相似,相对分子质量增大,分子间作用力逐渐增强。
②B、C、N、O四种元素第一电离能由小到大的顺序为B
Na>K(用元素符号表示),其原因为锂、钠、钾为金属晶体,它们的价电子数相等,金属离子所带的电荷数相同,离子半径依次增大,金属键依次减弱,故熔点依次降低。
(2)F与I同主族,BeF2是由三个原子构成的共价化合物分子,分子中中心原子Be的杂化类型为sp,BeF2分子的空间构型是直线形。
(3)Cl与I同主族,Cl具有很强的活泼性,可以形成很多含氯化合物,其中含氧酸HClO、HClO2、HClO3、HClO4的酸性由强到弱的顺序为HClO4>HClO3>HClO2>HClO。
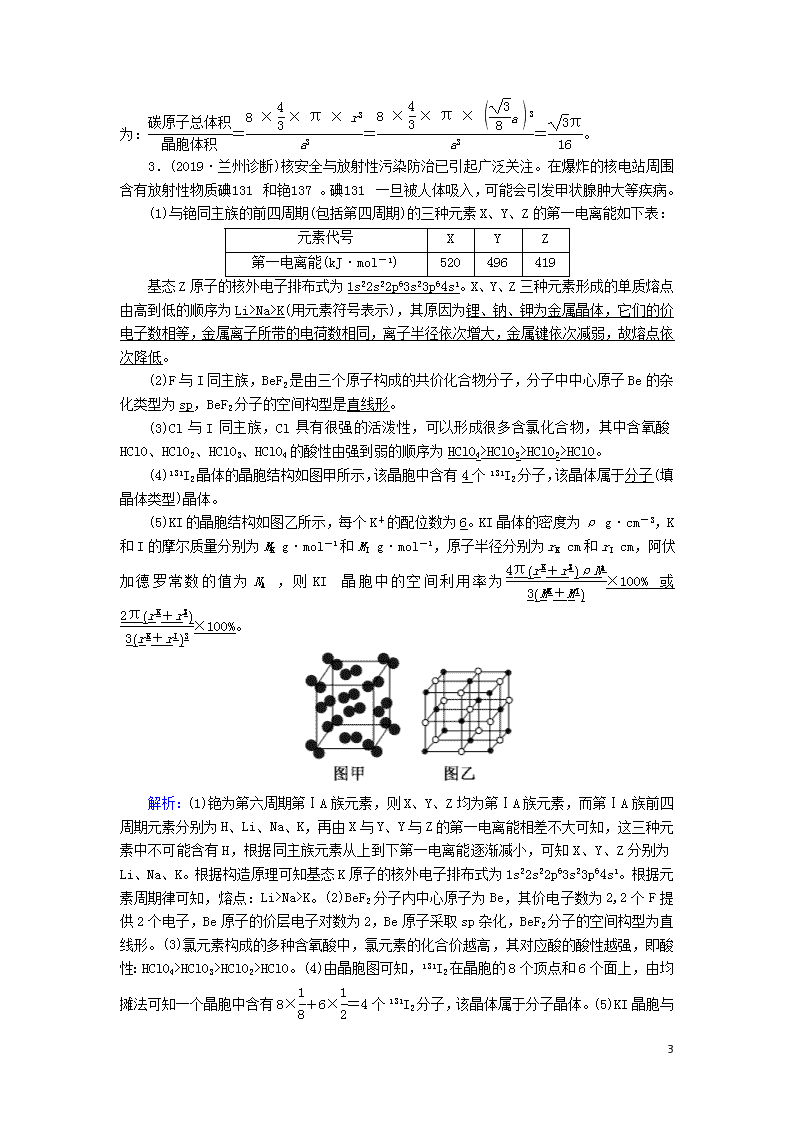
(4)131I2晶体的晶胞结构如图甲所示,该晶胞中含有4个131I2分子,该晶体属于分子(填晶体类型)晶体。
(5)KI的晶胞结构如图乙所示,每个K+的配位数为6。KI晶体的密度为ρ g·cm-3,K和I的摩尔质量分别为MK g·mol-1和MI g·mol-1,原子半径分别为rK cm和rI cm,阿伏加德罗常数的值为NA,则KI晶胞中的空间利用率为×100%或×100%。
解析:(1)铯为第六周期第ⅠA族元素,则X、Y、Z均为第ⅠA族元素,而第ⅠA族前四周期元素分别为H、Li、Na、K,再由X与Y、Y与Z的第一电离能相差不大可知,这三种元素中不可能含有H,根据同主族元素从上到下第一电离能逐渐减小,可知X、Y、Z分别为Li、Na、K。根据构造原理可知基态K原子的核外电子排布式为1s22s22p63s23p64s1。根据元素周期律可知,熔点:Li>Na>K。(2)BeF2分子内中心原子为Be,其价电子数为2,2个F提供2个电子,Be原子的价层电子对数为2,Be原子采取sp杂化,BeF2分子的空间构型为直线形。(3)氯元素构成的多种含氧酸中,氯元素的化合价越高,其对应酸的酸性越强,即酸性:HClO4>HClO3>HClO2>HClO。(4)由晶胞图可知,131I2在晶胞的8个顶点和6个面上,由均摊法可知一个晶胞中含有8×+6×=4个131I2分子,该晶体属于分子晶体。(5)KI晶胞与NaCl晶胞结构相似,每个K+紧邻6个I-,即每个K+
7
的配位数为6。由均摊法可知该晶胞中含K+数目和I-数目均为4。晶胞中原子所占的体积V1=(πr×4+πr×4) cm3,晶胞的体积V2= cm3=[2(rK+rI)]3 cm3,则KI晶胞中的空间利用率为×100%=×100%=×100%。
4.(2019·黑龙江六校二模)前四周期元素A、B、C、D、E、F的原子序数依次增大。A原子的阴离子的电子排布式与基态锂离子的相同,A和E位于同主族,基态B原子核外有3个能级且各能级上容纳的电子数相等,基态D原子有2个未成对电子,最外能层符号为L。+1价F离子的3d能级达到全充满结构。
回答下列问题:
(1)基态C原子价电子轨道表示式为。
(2)B、C、D三种元素第一电离能由大到小排序为N>O>C(填元素符号,下同),它们的电负性由小到大排序为CC>H(用相应的元素符号表示);氮原子的杂化轨道类型为sp2,sp3。
(3)Fe(CO)x常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断Fe(CO)x,晶体属于分子晶体(填晶体类型),若配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=5。
(4)NiO、FeO的晶体结构类型与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO>(填“>”“<”或“=”)FeO,原因是离子所带电荷数相同时,离子半径越小,晶格能越大。
(5)NiAs的晶胞结构如图所示:
①Ni的配位数为4。
②若阿伏加德罗常数的值为NA,晶体密度为ρ g·cm-3,则该晶胞中最近的Ni之间的距离为× cm。(写出计算表达式)
解析:(1)铁、钴、镍的基态原子核外电子排布式分别为
1s22s22p63s23p63d64s2、1s22s22p63s23p63d74s2、
1s22s22p63s23p63d84s2,未成对电子数分别为4、3、2,最多的是铁。
7
(2)1号、3号N原子形成3对共用电子对为普通共价键,2号、4号N原子形成4对共用电子对,与Co2+通过配位键结合;酞菁钴中三种非金属元素原子为C、N、H,同周期自左而右电负性增大,非金属性越强电负性越大,故电负性N>C>H;分子中N原子有3种,一种形成2个σ键,含有1个孤电子对,杂化轨道数目为3,N原子的杂化轨道类型为sp2,一种形成3个σ键,无孤电子对,杂化轨道数目为3,N原子的杂化轨道类型为sp2,一种形成3个σ键,含有1个孤电子对,杂化轨道数目为4,N原子的杂化轨道类型为sp3。
(3)分子晶体的熔、沸点较低,根据题给信息知,该物质的熔、沸点较低,所以为分子晶体,配合物Fe(CO)x的中心原子是铁原子,其价电子数是8,每个配体提供的电子数是2,8+2x=18,x=5。
(4)NiO、FeO的晶体结构类型均与氯化钠的相同,说明二者都是离子晶体,离子晶体的熔点与离子键的强弱有关,离子所带电荷数越多,离子半径越小,离子键越强,晶格能越大,熔点越高,由于Ni2+的离子半径小于Fe2+的离子半径,熔点NiO>FeO。
(5)①根据图示,砷原子周围有4个镍原子,构成正四面体,配位数为4,晶体中Ni和As的数目比为1∶1,因此镍原子周围也有4个砷原子,配位数为4;②根据图示,晶胞中含有的砷原子为4个,镍原子数目为8×+6×=4,晶胞的质量== g,晶体密度为ρ g·cm-3,则晶胞的边长= cm,晶胞中最近的Ni之间的距离为面对角线的一半,为× cm。
7