- 2021-04-16 发布 |
- 37.5 KB |
- 40页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届高考化学二轮复习备考的思考课件(共40张PPT)
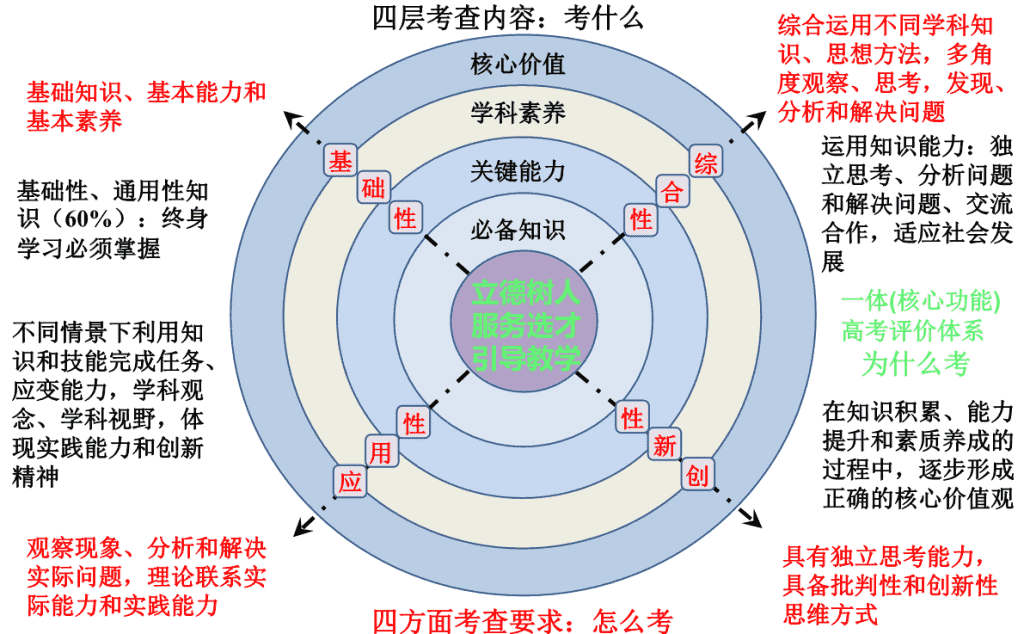
2019 届高三化学备考的思考 14 年:拿图纸、出方案 15 年:打基础、抓施工 16 年:调布局、克难点 17 年、 18 年 试水一体四层四翼 知识立意→能力立意→ 问题立意→素养立意 必备知识 关键能力 学科素养 核心价值 立德树人 服务选才 引导教学 基 础 性 性 用 应 性 新 创 综 合 性 一体 ( 核心功能 ) 高考评价体系 基础性、通用性知识( 60% ):终身学习必须掌握 运用知识能力:独立思考、分析问题和解决问题、交流合作,适应社会发展 不同情景下利用知识和技能完成任务、应变能力,学科观念、学科视野,体现实践能力和创新精神 在知识积累、能力提升和素质养成的过程中,逐步形成正确的核心价值观 基础知识、基本能力和基本素养 观察现象、分析和解决实际问题,理论联系实际能力和实践能力 具有独立思考能力,具备批判性和创新性思维方式 综合运用不同学科知识、思想方法,多角度观察、思考,发现、分析和解决问题 四层考查内容:考什么 为什么考 四方面考查要求:怎么考 17 、 18 年高考试题特点 平稳性:题型设置和考点切入保持平稳,重视核心和主干知识的考查 基础性:试题载体不回避来源于课本,重视元素化合物的载体作用,重视常见有机物考查 创新性:对同一知识体系的考查形式、切入角度进行调整,不回避用旧情景展示新观点 应用性:联系生产生活实际,重视信息整合和应用,重视化学实验 综合性:强调知识迁移,重视探究过程和方法、学科内和学科间的综合 热点性:不回避热点知识的重复和重现 高考题 —《 课标 》 、 《 课本 》 、 《 考纲 》 三位一体 备考 — 全面互动、注重基础、综合提升 原则 — 满足两个需要,科学实用高效 《 考纲 》 的具体要求 历年高考试题的研究及分析 高考需要 还要关注: 学生答题暴露出的问题 复习的整体规划 学生需要 两个需要: } 预设和生成的统一 ( 1 )化学基本 功的 加强( 基本公式掌握 、 基本化学用语使用、基本原理应用 等)( 2 ) 审题能力的提升 (抓 住 关键词、句 ,提取问题的实质 ) ( 3 )计算能力 的提高 ( 4 ) 说理、解析型问题的解答 ( 5 )实验设计思想 的 培养 ( 6 ) 信息处理及已有知识的准确迁移 这些多为 《 考纲 》 强调的知识和能力,也是学科素养的体现。 学生需要: 明确学生常见问题 ( 2013 全国新课标卷 Ⅰ ) 27 .锂离子电池的应用很广,其正极材料可再生利用。某离子电池正极材料有钴酸锂( LiCoO 2 ),导电剂乙炔黑和铝箔等。 充电 时,该锂离子电池负极发生的反应为 6C + x Li + + x e - =Li x C 6 。现欲利用以下工艺流程回收正极材料中的某些金属资源(部分条件为给出)。 ( 5 ) 充 放 电过程中,发生 LiCoO 2 与 Li 1 - x CoO 2 之间的转化,写出放电时电池反应方程式 _____________________ 。 原电池: Li x C 6 - x e - =6C + x Li + Li 1 - x CoO 2 + x e - + x Li + =LiCoO 2 总: Li x C 6 + Li 1 - x CoO 2 =6C + LiCoO 2 (-) ( + ) 如关键字词 锂离子电池本质? 二甲醚直接燃料电池具有启动快、效率高等优点,其 能量密度 高于甲醇直接燃料电池 (5.93 kW · h · kg-1 ) 。若电解质为酸性,二甲醚直接燃料电池的负极反应为 __________________________ ,一个二甲醚分子经过电化学氧化,可以产生 ___________ 个电子的电量;该电池的理论输出电压为 1.20 V ,能量密度 E =_____________________________ 。 ( 列式计算。 能量密度 = 电池输出电能 / 燃料质量, 1kW · h=3.6×10 6 J ) 。 充分利用单位导出公式 化学核心素养: 1 、宏观辨识和微观探析:结构决定性质、性质决定应用,并能从微观层面解释 2 、变化观念与平衡思想:从分类的角度研究物质变化的多重视角,揭示规律和特征,用动态的观点观察、分析和预测化学反应 3 、证据推理与模型认知:提出问题→做出假设→搜集论据、寻求方法→分析推理→得出结论→优化评价(穿插建模方法、构建思维框架) 4 、实验探究与创新意识:提出问题并能有效解决问题,合作、创新 5 、科学精神与社会责任:化学与生产、生活实际、科技前沿的紧密联系(情感态度价值观) 高考需要 —— 内化素养,外显能力 知识立意→能力立意→ 问题立意→素养立意 三轮复习 功能: 整合教材 和 知识, 体现 逻辑性和综合 性 ,形成知识体系和网络 ,提升知识应用能力。 把握知识的 高度、 难度、广度 、厚度、关联度的 度。穿插两本选修内容,提升答题能力。 关注: 一轮复习和二轮复习的顺畅衔接。 备考无捷径,可以超越 不宜 跨越。 一轮复习 时间: 8 月 — 次年 1 月底 定位: 以章节为主线,形成知识网络和知识体系,知识能力一步到位,滚动复习,不留死角,加强基础训练和条块训练。 效果: Fe 知识网络 提问: Fe 元素形成的单质 、 化合物 哪 些有颜色?具体说明并完成各物质间的转化。 ( 18 年 7 ) . 硫酸亚铁锂( LiFePO 4 )电池是新能源汽车的动力电池之一。采用湿法冶金工艺回收废旧硫酸亚铁锂电池正极片中的金属,其流程如下: 下列叙述错误的是 A. 合理处理废旧电池有利于保护环境和资源再利用 B. 从 “ 正极片 ” 中可回收的金属元素有 Al 、 Fe 、 Li C.“ 沉淀 ” 反应的金属离子为 Fe 3+ D . 上述流程中可用硫酸钠代替碳酸钠 近几年在考: 1 、化学与 STSE :体现化学对生活、生产、科技等的重要贡献,彰显社会责任 ( 18 年 12 ) . 主族元素 W 、 X 、 Y 、 Z 的原子序数依次增加,且均不大于 20 。 W 、 X 、 Z 最外层电子数之和为 10 ; W 与 Y 同族; W 与 Z 形成的化合物可与浓硫酸反应,其生成物可腐蚀玻璃。下列说法正确的是 A. 常温常压下 X 的单质为气态 B . Z 的氢化物为离子化合物 C. Y 和 Z 形成的化合物的水溶液呈碱性 D. W 与 Y 具有相同的最高化合价 2 、元素周期律和元素周期表:较好的渗透宏观辨识和微观探析 基本概念和基本理论 ( 1 )基本化学用语 包括对元素符号及在周期表中的位置、电子式、微粒结构示意图、比例模型、分子式、结构式和结构简式、化学方程式和离子方程式等 化学用语 的考查,在选择题和非选择题中都可能出现。 基本化学用语要求的调整: 掌握 原子结构示意图、电子式、分子式、结构式和结构简式等表示方法。 3 、有机化学:有机物对人类进步和社会发展的重要作用 ( 18 年 8 ) 下列说法错误的是 A . 蔗糖、果糖和麦芽糖均为双糖 B. 多数 酶是一类具有高选择催化性能的蛋白质 C. 植物油含不饱和脂肪酸酯,能使 Br₂/CCl 4 褪色 D. 淀粉和纤维素水解的最终产物均为葡萄糖 ( 18 年 11 ) 环之间共用一个碳原子的化合物称为螺环化合物,螺 [2 , 2] 戊烷( )是最简单的一种。下列关于该化合物的说法错误的是 A. 与环戊烯互为同分异构体 B. 二氯代物超过两种 C . 所有碳原子均处同一平面 D. 生成 1 mol C 5 H 12 至少需要 2 mol H 2 (三)常见有机物 未来可能倾向新材料的多元化考查 。 ( 16 年 9 ) .下列关于有机化合物的说法正确的是 A . 2- 甲基丁烷也称异丁烷 B .由乙烯生成乙醇属于加成反应 C . C 4 H 9 Cl 有 3 种同分异构体 D .油脂和蛋白质都属于高分子化合物 ( 2 )了解有机化合物的同分异构现象, 增加: 能正确书写简单有机化合物的同分异构体。 ( 3 ) 掌握 常见 (原来为“上述”) 有机反应类型。 ( 4 )了解甲烷、乙烯、苯等有机物的主要性质和 (增加“应用”) ( 5 )了解氯乙烯、苯的衍生物等在化工生产中的 重要作用。 基本营养物质和高分子化合物是否予以更多的关注? 4 、电化学:立足应用和创新,凸显关键能力 ( 18 年 13 ) 最近我国科学家设计了一种 CO 2 +H 2 S 协同转化装置,实现对天然气中 CO 2 和 H 2 S 的高效去除。示意图如图所示,其中电极分别为 ZnO@ 石墨烯(石墨烯包裹的 ZnO )和石墨烯,石墨烯电极区发生反应为: ① EDTA-Fe 2+ - e - = EDTA-Fe 3+ ② 2EDTA-Fe 3+ +H 2 S = 2H + +S+2EDTA-Fe 2+ 该装置工作时,下列叙述错误的是 A. 阴极的电极反应: CO 2 +2H + +2e - = CO+H 2 O B. 协同转化总反应: CO 2 +H 2 S = CO+H 2 O+S C . 石墨烯上的电势比 ZnO@ 石墨烯上的低 D. 若采用 Fe 3+ /Fe 2+ 取代 EDTA-Fe 3+ /EDTA-Fe 2+ , 溶液需为酸性 5 、基本实验:突出学科观念、学科视野、学科素养,培养科学精神和创新意识 ( 18 年 9 ) 在生成和纯化乙酸乙酯的实验过程中,下列操作未涉及的是 D 说明: 关于 N A 的 计算和判断 是常考题型之一,是对基本知识的综合考查。 6 、 N A :很好的补点题 ( 18 年 10 ) N A 是阿伏加德罗常数的值,下列说法正确的是 A. 16.25 g FeCl 3 水解形成的 Fe(OH) 3 胶体粒子数为 0.1 N A B . 22.4 L (标准状况) 氩 气含有的质子数为 18 N A C. 92.0 g 甘油(丙三醇)中含有羟基数为 1.0 N A D. 1.0 mol CH 4 与 Cl 2 在光照下反应生成的 CH 3 Cl 分子数为 1.0 N A 说明: 重视课本知识及迁移、拓展; 重视元素化合物的载体作用; 重视联系实际; 17 年、 18 年全面试水“一体、四层、四翼”: 试题载体来源: 试题评价: 平稳性、传承性、热点性、创新性 改变: ② 在解决化学问题的过程中,运用化学原理和科学方法,能设计合理方案,初步实践科学探究。 增加: 1. 化学学科特点和基本研究方法 ( 4 )了解定量研究方法是化学发展为一门科学的重要标志。 关注计算、数据处理、定量实验 ( 3 )化学实验与探究能力 ① 了解并初步实践化学实验研究的一般过程, 掌握 化学实验的 基本方法和技能。 (一轮复习) ② 在解决简单化学问题的过程中,运用 科学的方法 ,初步了解 化学变化规律 ,并对 化学现象 提出科学合理的 解释 。 (二轮复习) 变化: 1 、加大计算考查力度 了解物质的量( n )及其单位摩尔( mol ) 、摩尔质量( M )、气体摩尔体积( V m )、 物质的量浓度( c )、阿伏加德罗常数( N A ) 的含义。 了解溶液浓度的表示方法。 理解溶液中溶质的质量分数 和物质的量浓度的概念 , 并能进行有关计算。 2 、重视必备知识考查: 掌握 原子结构示意图、电子式、分子式、结构式和结构简式等表示方法。 增加: 掌握常见氧化还原反应的配平和相关计算 增加: 了解胶体是一种常见的分散系, 了解胶体和溶液的区别 了解常见金属及其重要化合物的 制备方法,掌握 其主要性质及其应用。 关注生产实际中的元素化合物,重视实验和实践关系。 增加: 了解共价键的形成、极性;了解氢键的含义。 三点变四点: 4 . 晶体结构与性质 ( 1 )了解晶体的类型,了解不同类型晶体中结构微粒、微粒间作用力的区别。 ( 2 )了解晶格能的概念,了解晶格能对离子晶体性质的影响。 ( 3 )了解分子晶体结构与性质的关系。 ( 4 )了解原子晶体的特征,能描述金刚石、二氧化硅等原子晶体的结构与性质的关系。 ( 5 )理解金属键的含义,能用金属键理论解释金属的一些物理性质。了解金属晶体常见的堆积方式。 ( 6 )了解晶胞的概念,能根据晶胞确定晶体的组成并进行相关的计算。 三道必做主观题 总体来看: 必做的大题重综合性,重能力,重过程方法,重应用,渗透科技前沿和情感态度价值观,且题型基本固定,一个综合探究实验题;一个无机综合题,主要形式是以生产实际为背景,以元素化合物为载体综合考查无机化学知识,并渗入溶液中离子平衡的知识,拼盘式设问形式居多;一个化学原理综合题,涉及考点主要为速率和平衡,反应机理,离子平衡,盖斯定律,电化学等,常有新信息呈现。 ( 1 )侧重 创新 ,重视 信息 与已有知识的 整合 题材新,背景新,信息新,试题呈现形式新(启普发生器),评价体系新,更 多的考查学生挖掘、整合、应用 信息解决新问题 的水平,体现现场学习的水平和创新精神;同时兼顾已有知识的呈现、迁移和应用,使题目更有内涵,更能体现学科本源。 综合实验题 ( 2 )重视 考查能力 、重视 过程和方法 、重视 学科素养 重基础的同时重能力, 分析问题和解决问题的能力,预测实验现象和结论,设计和评价实验方案,重视基本操作及操作过程中的论述、解释和说理,重视实践能力,重视数据处理和误差分析,重视学科素养,重视科学精神和社会责任等核心价值。 无机综合题的形式和特点 随着新课标高考命题改革的深入,无机综合题内容更加丰富。以多元化主题研究和工艺流程为主,进行多角度考查,加大了逻辑性和综合性,拼盘形式设问居多。因此此类题的解法需重点突破。 ( 1 )化学反应与热量:反应热的含义(三种反应热的表示方式及⊿ H 的符号判断、含义),大小比较及计算,燃烧热和中和热,盖斯定律的应用,热化学方程式的书写和计算、判断等。关注反应机理和历程。 ( 2 )化学反应速率:反应速率的比较和计算,影响因素(内因、外因 — 浓度、压强、温度、催化剂、比表面积)。 化学反应原理综合题常见考点 ( 3 )化学平衡:化学平衡常数表达式,与平衡常数有关的计算,判断影响平衡常数的因素,化学平衡状态的判断,用化学平衡的影响因素进行 分析和解释 ,等效平衡(转化率、浓度的比较),反应热与等效平衡的融合,正逆反应速率与平衡的关系等。 ( 4 )电化学基础:原电池和电解池的电极名称,电极反应式和总式的书写,溶液中离子的移动方向,以各电极电子转移总数相等为核心的计算,离子浓度和溶液 pH 的计算等。 关注学科间的综合和膜技术。 ( 5 )水溶液中的离子平衡: K w 、电离平衡常数、溶度积常数、 pH 的应用和有关计算,盐溶液酸碱性和典型试纸的使用,溶液中各类离子方程式的书写并用来进行相关事实的解释,粒子浓度大小的比较,水和弱电解质的电离平衡、沉淀溶解平衡的判断、应用及有关计算等。 ( 6 )化学反应速率、化学平衡 新课标高考对此内容的考查情有独钟,主要以判断、推理、计算等形式出现。从知识内容来看主要有以下几个方面: ①化学反应速率的影响因素、计算、测定方法及数据处理; ②化学平衡状态的判断; ③有关化学反应速率、化学平衡图像的分析和判断; ④有关化学平衡及常数的计算及影响因素; ⑤结合着等效平衡,进行有关物理量的比较; ⑥化学平衡与反应热的交叉; ⑦化学反应进行的方向判定; ⑧运用化学反应速率和化学平衡知识解释实际问题等。 ⑨新视角下关于化学反应速率和化学平衡的考查,增大信息量。 定位: 以专题模块为主线,构架知识网络和知识体系,知识点全覆盖,加强综合训练。 二轮复习 时间: 大约两个半月 功能: 专题是有明确目的、明确任务、明确内容的专项综合训练,着重体现“专”字。旨在强化重点、突破难点、总结规律、归纳方法、体现思维过程,则要求训练中,将难度、高度、广度、深度提升到极致。 二轮复习承载的责任和功能更大。二轮复习的效果可能直接决定着一个考生高考的成败。 三轮复习: 以重点知识和主干知识为主线,强化知识网络和知识体系,回归课本,地毯式搜索,查缺补漏,加强模拟性综合训练。 强调解决综合题的方法:分解、拆分、迁移、整合综合题 回归课本不忽略边缘知识: 如:新型材料、金属材料、高分子化合物;油脂、糖类、蛋白质等基本营养物质;金属冶炼;海水资源的综合应用;煤和石油;熵变;环保;危险品标志;检验 Fe 2 + 。 有关有机物同分异构体的书写 前边简单提到过,再详细说一下,同分异构体书写主要有 几 个角度: 组合型: 主要指酯类,只要按要求分别写出组成酯的两部分(醇或酚、酸)的同分异构体,再进行组合即可,不要忽略了酯基有方向性以及 H 原子连接位置的特殊要求;如 13 年新课标卷Ⅰ的 12 题。 脂肪型: 也即链状,烷烃是母体,可先写等碳原子(官能团中不含 C )或少一个碳原子(官能团中含有 C )的烷烃的同分异构体,再结合对称原则找不等价 H ,依次用官能团分别取代。如链状有机物 C 4 H 6 Cl 2 的同分异构体的书写:先写 4 个碳原子的烷烃同分异构(有 2 种),再分别上 双键(共 3 种),再分别用一个氯原子取代各个烯烃中的 H 原子,最后再上一个氯原子,结束。 芳香 型 : 含有苯环的同分异构体主要考查苯环的对称性,可先苯环上连两个取代基,均为邻、间、对三种,再根据对称原则,一个一个上其他取代基。如用— X 、— Y 、— Z 取代苯环上 H ,可先上任意两个,再上第三个;若多取代基,其中有相同的,可先上相同的,后边更容易找对称。 多苯环连接,可先找不等价碳,再依据对称原则书写。查看更多