- 2021-04-16 发布 |
- 37.5 KB |
- 49页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届二轮复习新型电源、电解的应用与金属腐蚀课件(49张)(全国通用)
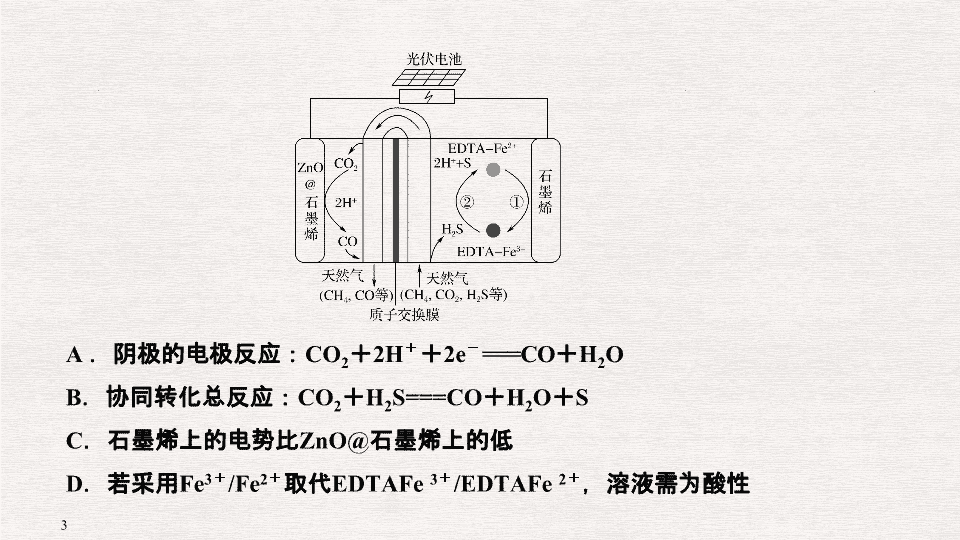
第 5 题 新型电源、电解的应用与金属腐蚀 复习建议: 3 课时 ( 题型突破 2 课时 习题 1 课时 ) 1 . (2018· 课标全国 Ⅰ , 13) 最近我国科学家设计了一种 CO 2 + H 2 S 协同转化装置,实现对天然气中 CO 2 和 H 2 S 的高效去除。示意图如图所示,其中电极分别为 ZnO@ 石墨烯 ( 石墨烯包裹的 ZnO) 和石墨烯,石墨烯电极区发生反应为: ① EDTAFe 2 + - e - ===EDTAFe 3 + ② 2EDTAFe 3 + + H 2 S===2H + + S + 2EDTAFe 2 + 该装置工作时,下列叙述错误的是 ( ) A .阴极的电极反应: CO 2 + 2H + + 2e - ===CO + H 2 O B .协同转化总反应: CO 2 + H 2 S===CO + H 2 O + S C .石墨烯上的电势比 ZnO@ 石墨烯上的低 D .若采用 Fe 3 + /Fe 2 + 取代 EDTAFe 3 + /EDTAFe 2 + ,溶液需为酸性 解析 阴极发生还原反应,氢离子由交换膜右侧向左侧迁移,阴极的电极反应式为 CO 2 + 2e - + 2H + ===CO + H 2 O , A 项正确;结合阳极区发生的反应,可知协同转化总反应为 CO 2 + H 2 S===S + CO + H 2 O , B 项正确;石墨烯作阳极,其电势高于 ZnO@ 石墨烯的, C 项错误; Fe 3 + 、 Fe 2 + 在碱性或中性介质中会生成沉淀,它们只稳定存在于酸性较强的介质中, D 项正确。 答案 C 答案 D 3 . (2018· 课标全国 Ⅲ , 11) 一种可充电锂 空气电池如图所示。当电池放电时, O 2 与 Li + 在多孔碳材料电极处生成 Li 2 O 2 - x ( x = 0 或 1) 。下列说法正确的是 ( ) 答案 D 4 . (2017· 课标全国 Ⅰ , 11) 支撑海港码头基础的防腐技术,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是 ( ) A .通入保护电流使钢管桩表面腐蚀电流接近于零 B .通电后外电路电子被强制从高硅铸铁流向钢管桩 C .高硅铸铁的作用是作为损耗阳极材料和传递电流 D .通入的保护电流应该根据环境条件变化进行调整 解析 钢管桩接电源的负极,高硅铸铁接电源的正极,通电后,外电路中的电子从高硅铸铁 ( 阳极 ) 流向正极,从负极流向钢管桩 ( 阴极 ) , A 、 B 正确; C 项,题给信息高硅铸铁为 “ 惰性辅助阳极 ” 不损耗,错误。 答案 C 5 . (2017· 课标全国 Ⅱ , 11) 用电解氧化法可以在铝制品表面形成致密、耐腐蚀的氧化膜,电解质溶液一般为 H 2 SO 4 - H 2 C 2 O 4 混合溶液。下列叙述错误的是 ( ) A .待加工铝质工件为阳极 B .可选用不锈钢网作为阴极 C .阴极的电极反应式为: Al 3 + + 3e - ===Al D .硫酸根离子在电解过程中向阳极移动 解析 A 项,根据原理可知, Al 要形成氧化膜,化合价升高失电子,因此铝为阳极,正确; B 项,阴极仅作导体,可选用不锈钢网,且不锈钢网接触面积大,能增加电解效率,正确; C 项,阴极应为氢离子得电子生成氢气,错误; D 项,电解时,阴离子移向阳极,正确。 答案 C 6 . (2017· 课标全国 Ⅲ , 11) 全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极 a 常用掺有石墨烯的 S 8 材料,电池反应为: 16Li + x S 8 ===8Li 2 S x (2≤ x ≤8) 。下列说法错误的是 ( ) A .电池工作时,正极可发生反应: 2Li 2 S 6 + 2Li + + 2e - ===3Li 2 S 4 B .电池工作时,外电路中流过 0.02 mol 电子,负极材料减重 0.14 g C .石墨烯的作用主要是提高电极 a 的导电性 D .电池充电时间越长,电池中 Li 2 S 2 的量越多 答案 D 答案 B 8 . (2016· 课标全国 Ⅱ , 11) MgAgCl 电池是一种以海水为电解质溶液的水激活电池。下列叙述错误的是 ( ) A .负极反应式为 Mg - 2e - ===Mg 2 + B .正极反应式为 Ag + + e - ===Ag C .电池放电时 Cl - 由正极向负极迁移 D .负极会发生副反应 Mg + 2H 2 O===Mg(OH) 2 + H 2 ↑ 解析 根据题意, Mg 海水 AgCl 电池总反应式为 Mg + 2AgCl===MgCl 2 + 2Ag 。 A 项,负极反应式为 Mg - 2e - ===Mg 2 + ,正确; B 项,正极反应式为 2AgCl + 2e - ===2Cl - + 2Ag ,错误; C 项,对原电池来说,阴离子由正极移向负极,正确; D 项,由于镁是活泼金属,则负极会发生副反应 Mg + 2H 2 O===Mg(OH) 2 + H 2 ↑ ,正确。 答案 B 9 . (2015· 全国卷 Ⅰ , 11) 微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是 ( ) A .正极反应中有 CO 2 生成 B .微生物促进了反应中电子的转移 C .质子通过交换膜从负极区移向正极区 D .电池总反应为 C 6 H 12 O 6 + 6O 2 ===6CO 2 + 6H 2 O 解析 由题意可知,微生物电池的原理是在微生物作用下 O 2 与 C 6 H 12 O 6 发生氧化还原反应,将化学能转化为电能, B 正确;氧气在正极反应,由于质子交换膜只允许 H + 通过,则正极反应为 O 2 + 4e - + 4H + ===2H 2 O ,没有 CO 2 生成, A 项错误;负极发生反应: C 6 H 12 O 6 - 24e - + 6H 2 O===6CO 2 + 24H + , H + 在负极区生成,移向正极区,在正极被消耗, C 项正确;总反应为 C 6 H 12 O 6 + 6O 2 ===6CO 2 + 6H 2 O , D 项正确。 答案 A 命题调研 (2014 ~ 2018 五年大数据 ) 命题角度 设项方向 频数 难度 1. 新型化 学电源 正、负极判断 5 0.43 离子移动方向 电极反应式、总原电池方程式的正误判断 电极及电解液转移电子计算 2. 电解原理在工、农业生产中的应用 阴、阳极的判断 3 0.51 离子交换膜的作用 副反应分析及溶液酸碱性的改变 电极方程式的正误判断 3. 金属的腐蚀与防护 电化学腐蚀的原因分析 1 0.60 防止金属腐蚀的措施 在 2019 年高考中,对于电化学的考查将继续坚持以新型电池及电解应用装置为背景材料,以题干 ( 装置图 ) 提供电极构成材料、交换膜等基本信息,基于电化学原理广泛设问,综合考查电化学基础知识及其相关领域的基本技能,包括电极与离子移动方向判断、电极反应式书写、溶液的酸碱性和 pH 变化、有关计算及其与相关学科的综合考查等。预测以二次电池以及含有离子交换膜的电解池为背景的命题将成为热点题型,因为二次电池不仅实现电极材料循环使用,符合 “ 低耗高效 ” 的时代需求,而且命题角度丰富,便于同时考查原电池和电解池工作原理;含有离子交换膜的电解池设问空间大,便于考查考生的探究能力。 判断依据 电极材料 电极反应 电子流向 离子移向 电极现象 原电池 负极 活泼金属 氧化反应 流出 阴离子移向 电极质量减小 正极 不活泼 金属 或非金属 还原反应 流入 阳离子移向 电极增重或质 量不变 电解池 阳极 与电源正 极相连 氧化 反应 流出 阴离子 移向 电极溶解或 pH 减小 阴极 与电源负 极相连 还原 反应 流入 阳离子 移向 电极增重或 pH 增大 (1) 燃料电池电极反应式的书写 ( 以氢氧燃料电池为例 ) ① 注意介质环境 ② 掌握书写程序 (2) 其他新型一次电池 (3) 充电 ( 可逆 ) 电池 [ 解题模型 ] [ 模型解题 ] 答案 C (1) 常见的离子交换膜 种类 允许通过的离子及移动方向 说明 阳离子交换膜 阳离子 → 移向电解池的阴极或原电池的正极 阴离子和气体不能通过 阴离子交换膜 阴离子 → 移向电解池的阳极或原电池的负极 阳离子和气体不能通过 质子交 换膜 质子 → 移向电解池的阴极或原电池的正极 只允许 H + 通过 (2) [ 解题模型 ] [ 模型解题 ] [ 典例演示 1] 世界某著名学术刊物介绍了一种新型中温全瓷铁 空气电池,其结构如图所示。 下列有关该电池放电时的说法正确的是 ( ) A . a 极发生氧化反应 B .正极的电极反应式为 FeO x + 2 x e - ===Fe + x O 2 - C .若有 22.4 L( 标准状况 ) 空气参与反应,则电路中有 4 mol 电子转移 D .铁表面发生的反应为 x H 2 O(g) + Fe===FeO x + x H 2 解析 a 极通入空气, O 2 在该电极发生得电子的还原反应, A 错误; O 2 在正极发生反应,电极反应式为 O 2 + 4e - ===2O 2 - , B 错误;由 B 项分析可知,电路中有 4 mol 电子转移时正极上消耗 1 mol O 2 ,在标准状况下的体积为 22.4 L ,则通入空气的体积约为 22.4 L×5 = 112 L , C 错误;由图可知,铁表面 H 2 O(g) 参与反应生成 H 2 ,则发生的反应为 x H 2 O(g) + Fe===FeO x + x H 2 , D 正确。 答案 D A .充电时, Zn 2 + 向 ZnMn 2 O 4 电极迁移 B .充电时,阳极反应: ZnMn 2 O 4 - 2 x e - ===Zn 1 - x Mn 2 O 4 + x Zn 2 + C .放电时,每转移 1 mol e - , ZnMn 2 O 4 电极质量增加 65 g D .充放电过程中,只有 Zn 元素的化合价发生变化 解析 放电时锌失电子发生氧化反应,所以锌是负极材料,尖晶石型锰酸锌 (ZnMn 2 O 4 ) 为正极,充电时, Zn 为阴极,阳离子 (Zn 2 + ) 向 Zn( 阴极 ) 迁移, A 错误; B 正确;放电时,每转移 2 mol e - , ZnMn 2 O 4 电极质量增加 65 g , C 错误;充放电时锌与锰的化合价都发生变化, D 错误。 答案 B [ 典例演示 2] CO 2 是重要的温室气体,对地球温室效应的 “ 贡献 ” 最大,如何利用 CO 2 是摆在科技工作者面前的重要课题。下图所示电解装置可将 CO 2 转化为乙烯,该装置的电解质溶液为强酸性水溶液,电极材料为惰性电极。下列有关说法正确的是 ( ) A . a 为电池的正极 B .电解过程中 H + 移向阳极 C .反应前后溶液的 pH 保持不变 D .阴极反应式: 2CO 2 + 12H + + 12e - ===C 2 H 4 + 4H 2 O 解析 二氧化碳得电子生成乙烯,为阴极反应,所以 a 为电池的负极, A 错误;电解过程中 H + 移向阴极, B 错误;阴极二氧化碳得电子生成乙烯,阳极氢氧根失电子放出氧气,总反应为 2CO 2 + 2H 2 O===C 2 H 4 + 3O 2 ,消耗水, H + 浓度增大, pH 减小, C 错误; D 正确。 答案 D [ 题型训练 2] (2017· 海南卷 ) 一种电化学制备 NH 3 的装置如下图所示,图中陶瓷在高温时可以传输 H + 。下列叙述错误的是 ( ) A . Pd 电极 b 为阴极 B .阴极的反应式: N 2 + 6H + + 6e - ===2NH 3 C . H + 由阳极向阴极迁移 D .陶瓷可以隔离 N 2 和 H 2 解析 此装置为电解池,总反应式是 N 2 + 3H 2 ===2NH 3 , Pd 电极 b 上是氢气发生氧化反应,即氢气失去电子化合价升高, Pd 电极 b 为阳极,故 A 说法错误;根据 A 选项分析, Pd 电极 a 为阴极,反应式为 N 2 + 6H + + 6e - ===2NH 3 ,故 B 说法正确;根据电解池的原理,阳离子在阴极上放电,即由阳极移向阴极,故 C 说法正确;根据装置图,陶瓷可以隔离 N 2 和 H 2 ,故 D 说法正确。 答案 A [ 典例演示 3] (2018· 北京理综, 12) 验证牺牲阳极的阴极保护法,实验如下 ( 烧杯内均为经过酸化的 3%NaCl 溶液 ) 。 ① ② ③ 在 Fe 表面生成蓝色沉淀 试管内无明显变化 试管内生成蓝色沉淀 下列说法不正确的是 ( ) A .对比 ②③ ,可以判定 Zn 保护了 Fe B .对比 ①② , K 3 [Fe(CN) 6 ] 可能将 Fe 氧化 C .验证 Zn 保护 Fe 时不能用 ① 的方法 D .将 Zn 换成 Cu ,用 ① 的方法可判断 Fe 比 Cu 活泼 解析 ② 中 Zn 作负极,发生氧化反应生成 Zn 2 + , Fe 作正极被保护,所以取出的少量 Fe 附近的溶液中滴入铁氰化钾溶液,试管内无明显变化。但 ③ 中没有 Zn 保护 Fe , Fe 在酸性环境中发生析氢腐蚀, Fe 作负极被氧化生成 Fe 2 + ,所以取出的少量 Fe 附近的溶液中滴入铁氰化钾溶液,生成蓝色沉淀,对比 ②③ 可知 Zn 保护了 Fe , A 项正确; ① 与 ② 的区别在于:前者是将铁氰化钾溶液直接滴入烧杯中,而后者是在取出的少量 Fe 附近的溶液中滴加铁氰化钾溶液, ① 中出现了蓝色沉淀,说明有 Fe 2 + 生成。对比分析可知,可能是铁氰化钾氧化 Fe 生成了 Fe 2 + , B 项正确;通过上述分析可知,验证 Zn 保护 Fe 时不能用 ① 的方法, C 项正确;若将 Zn 换成 Cu ,铁氰化钾仍会将 Fe 氧化为 Fe 2 + ,在铁的表面同样会生成蓝色沉淀,所以无法判断 Fe 2 + 是不是负极产物,即无法判断 Fe 与 Cu 的活泼性, D 项错误。 答案 D [ 题型训练 3] 深埋在潮湿土壤中的铁管道,在硫酸盐还原菌作用下,能被硫酸根腐蚀,其电化学腐蚀原理如下图所示,下列与此原理有关的说法错误的是 ( ) A .正极反应: SO + 5H 2 O + 8e - ===HS - + 9OH - B .输送暖气的管道不易发生此类腐蚀 C .这种情况下, Fe 腐蚀的最终产物为 Fe 2 O 3 · x H 2 O D .管道上刷富锌油漆可以延缓管道的腐蚀 答案 C查看更多