- 2021-04-16 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
河南省部分重点高中2020届高中毕业班10月联合检测——化学
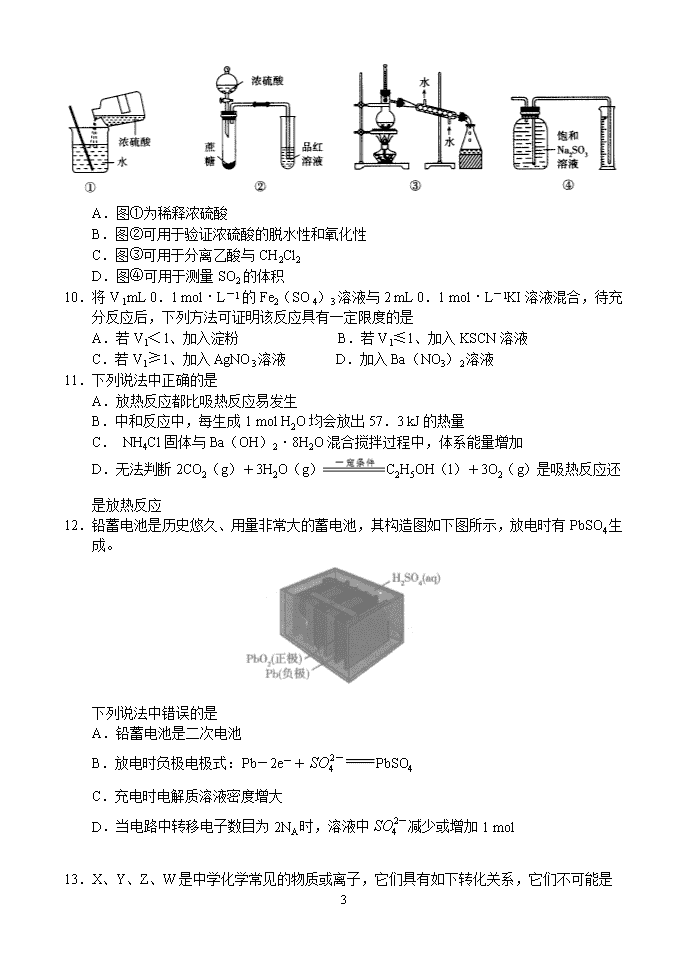
河南省部分重点高中2020届高中毕业班10月联合检测 化 学 考生注意: 1.答题前,考生务必将自己的姓名、考生号填写在试卷和答题卡上,并将考生号条形码粘贴在答题卡上的指定位置。 2.回答选择题时,选出每小题答案后,用铅笔把答题卡对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。 3.考试结束后,将本试卷和答题卡一并交回。 可能用到的相对原子质量:H 1 N 14 O 16 Na 23 S 32 Cl 35.5 一、选择题:本大题共16小题,每小题3分,共48分。在每小题给出的四个选项中,只有一项是符合题目要求的。 1.2013年浙江大学以石墨烯为原料研制的“碳海绵”是一种气凝胶,它是处理海上原油泄漏最好的材料:它能把漏油迅速吸进来,吸进的油又能挤出来回收,碳海绵还可以重新使用,下列有关“碳海绵”的说法中错误的是 A.对有机溶剂有很强的吸附性 B.内部应有很多孔隙,充满空气 C.有很强的弹性 D.密度较大,化学性质稳定 2.下列有关说法中正确的是 A.纳米Fe3O4分散到适当的分散剂中可得到胶体,能产生丁达尔效应 B.加热条件下金属单质在空气中均可表现出还原性 C.不能导电的化合物均不是电解质 D.电解质溶液导电过程中,离子仅仅发生了定向移动 3.下列有关叙述正确的是 ①氧化镁:可用作耐火材料;②二氧化硅:制造计算机芯片;③水玻璃:可作木材防火剂;④铝热反应既可用于焊接钢轨,也可用于工业上冶炼铁;⑤水煤气属于清洁能源;⑥浓硫酸:可用于吸收Cl2、SO2、H2S等气体 A.①③⑤ B.②⑤⑥ C.②③④⑤ D.①③⑥ 4.设NA是阿伏加德罗常数的值,下列说法正确的是 A.12g NaHSO4晶体中-数目为0.1NA B.2.0g D2O中含有的中子数为NA C.2.24L Cl2与足量Na2SO3溶液反应时转移的电子数为0.2NA D.标准状况下,4.48 L HF所含原子数目为0.4NA 5.25℃时,下列各组离子在指定溶液中一定能大量共存的是 A.无色透明的溶液中:k+、Cu2+、、Cl- 7 B.加石蕊试液后变红色的溶液中:Ba2+、Na+、ClO-、 C.能使Al转化为的溶液中:Na+、K+、、Cl- D.加入盐酸后能形成不溶于硝酸的白色沉淀的溶液中:K+、Ca2+、Br-、OH- 6.2017年5月9日,我国科学技术名词审定委员会等单位正式发布115号等4种人工合成的新元素的名称、元素符号,115号元素名称为“镆”,符号为Mc。下列有关说法正确的是 A.Mc的最低负化合价为-3 B.Mc的最高价氧化物的化式为Mc2O 5 C.的中子数为115 D.通过化学反应可使转化为 7.实验测得浓度均为0.5 mol·L-1的Pb(CH 3COO)2溶液的导电性明显弱于Pb(NO 3)2溶液,又知PbS是不溶于水及稀酸的黑色沉淀,下列离子方程式书写错误的是 A.Pb(NO 3)2溶液与CH 3COONa溶液混合:Pb 2++2CH3COO-Pb(CH3COO)2 B.Pb(NO3)2溶液与K2S溶液混合:Pb2++S2-PbS↓ C.Pb(CH3COO)2溶液与K2S溶液混合:Pb2++S2-PbS↓ D.Pb(CH 3COO)2 在水中电离:Pb(CH3COO)2 Pb 2++2CH3COO- 8.使用下列试剂或进行下列操作,能达到相应实验目的的是 9.下列图示中的实验操作、仪器、试剂(部分夹持装置已略)均正确的是 7 A.图①为稀释浓硫酸 B.图②可用于验证浓硫酸的脱水性和氧化性 C.图③可用于分离乙酸与CH2Cl2 D.图④可用于测量SO2的体积 10.将V 1mL 0.1 mol·L-1的Fe2(SO 4)3溶液与2 mL 0.1 mol·L-1KI溶液混合,待充分反应后,下列方法可证明该反应具有一定限度的是 A.若V1<1、加入淀粉 B.若V1≤1、加入KSCN溶液 C.若V1≥1、加入AgNO3溶液 D.加入Ba(NO3)2溶液 11.下列说法中正确的是 A.放热反应都比吸热反应易发生 B.中和反应中,每生成1 mol H2O均会放出57.3 kJ的热量 C. NH4Cl固体与Ba(OH)2·8H2O混合搅拌过程中,体系能量增加 D.无法判断2CO2(g)+3H2O(g)C2H5OH(l)+3O2(g)是吸热反应还 是放热反应 12.铅蓄电池是历史悠久、用量非常大的蓄电池,其构造图如下图所示,放电时有PbSO4生成。 下列说法中错误的是 A.铅蓄电池是二次电池 B.放电时负极电极式:Pb-2e-+PbSO4 C.充电时电解质溶液密度增大 D.当电路中转移电子数目为2NA时,溶液中减少或增加1 mol 13.X、Y、Z、W是中学化学常见的物质或离子,它们具有如下转化关系,它们不可能是 7 14.X、Y、Z、W是原子序数依次增大的短周期主族元素,它们之间可形成组成不同的多种可溶性常见盐,其中有两种组成为ZXY3、ZWY4。下列说法中正确的是 A.简单离子半径:r(W)>r(Z)>r(Y)>r(X) B.最常见氢化物的稳定性:X>Y C.Z2Y2中含有共价键且在熔融状态下能导电 D.HWY分子中各原子均途到8电子稳定结构 15.某研究性学习小组的同学在实验室模拟用粉煤灰(主要含Al2O3、SiO2等)制备碱式硫酸铝 [Al2(SO4)x(OH)6-2x]溶液,并用于烟气脱硫研究,相关过程如下: 下列说法错误的是 A.滤渣Ⅰ、Ⅱ的主要成分分别为SiO2、CaSO4 B.若将pH调为4,则可能导致溶液中铝元素的含量降低 C.吸收烟气后的溶液中含有的离子多于5种 D.完全热分解放出的SO2量总是等于吸收的SO2量 16.100℃时,向某恒容密闭容器中加入1.6 mol ·L-1的W后会发生如下反应:2W(g)M(g) △H =a kJ · mol-1。其中M的物质的量浓度随时间的变化如图所示: 下列说法错误的是 A.从反应开始到刚达到平衡时间段内,v(W)=0.02 mol·L-1·s-1 B.a、b两时刻生成W的速率:v(a)<v(b) 7 C.用W浓度变化值表示的ab、bc两个时段内的反应速率:v(ab)>v(bc)=0 D.其他条件相同,起始时将0.2 mol·L-1氦气与W混合,则反应达到平衡所需时间少于60 s 二、非选择题:本题共5小题,共52分。 17.(7分)某同学利用下图所示的装置进行实验(实验条件下气体摩尔体积为Vm),实验开始前各活塞均关闭(两烧瓶容积相同)。 (1)同温同压下,两个烧瓶内HCl与NH3分子数目之比为__________,烧瓶Ⅱ中喷泉的颜色是__________。 (2)实验结束后烧瓶Ⅰ中c(Cl-)=__________mol·L-1. (3)实验表明,若只是关闭b、打开a、c,则易在烧瓶Ⅰ中观察到白烟,这表明气体分子扩散速率随着气体相对分子质量的增大而__________(填“增大”或“减小”) 18.(12分)氨基锂(LiNH2)是一种白色固体,溶点为390℃、沸点为430 ℃,溶于冷水,遇热水强烈水解,主要用于有机合成和药物制造。实验室制备少量氨基锂的装置如下图所示(部分夹持装置已略): (1)A中装置是用于制备氨气的,若制备氨气的试剂之一是熟石灰,则A中制气装置是__________(从方框中选用,填序号);用浓氨水与生石灰反应也可制取NH3,反应的化学方程式为________________________________________。 (2)试剂X是____________________,装置D的作用是____________________。 (3)实验中需要先向C通入一段时间的NH3再点燃C处酒精灯,这样做的目的是_______,可根据E中______________________________(填现象)开始给锂加热。 (4)某同学经理论分析认为LiNH2遇热水时可生成一种气体,试设计一种方案检验该气体:____________________________________________________________ 。 19.(12分)X、Y、Z均是中学化学中常见的物质,某同学用X、Y两种单质及Z 7 的溶液进行实验,部分实验内容如下表所示: (1)Ⅰ中反应物与生成物总能量的大小:E(反应物)__________E(生成物)(填“>”“<”或“=”),仅仅由Ⅰ、Ⅱ中的信息可知,Z可能是__________。 (2)若X是铝,在温度不变时向Ⅰ中分别加入(适量)等物质的量的NaCl、KCl、CsCl后,产生无色气泡的速率明显加快,导致这种变化最可能的原因是__________________。 (3)若X是铝,Ⅱ中反应产生的气泡有特殊颜色,则发生反应的离子方程式为_________; 单质Y不可能是__________(填字母)。 A.铅 B.石墨 C.镁 D.银 (4)若Ⅲ中溶液最终变成蓝色,写出负极上电极反应式:____________________ ,变化过程中,参与正极上放电的离子是____________________。 20.(10分)α-FeO(OH)在高档涂料、油墨的生产中有着重要的用途。某化工厂以氧化铁废料(含少量的 FeO、SiO2)为原料制备FeO(OH)的流程如下图所示: 请回答下列有关问题: (1)FeO(OH)中铁元素的化合价为__________,滤液3中溶质的主要成分是__________。 (2)酸浸时主要反应的离子方程式为________________________________________,试剂a最好是__________。 (3)通入空气的反应中,消耗的氧化剂与还原剂的物质的量之比为__________。操作X为向滤液2中加入乙醇而不是蒸发浓缩、冷却结晶,这说明绿矾晶体在乙醇中的溶解度__________(填“大”或“小”)。若操作X为蒸发浓缩、冷却结晶,可能造成的不良后果是________________________________________ 。 21.(11分)原子序数依次增大的X、Y、Z、W、M五种短周期主族元素中,X、Y两元素间能形成原子个数比分别为1 :1和1 :2的固态化合物A和B,Y是短周期元素中失电子能力最强的元素,W、M的最高价氧化物对应的水化物化学式分别为H3WO4、HMO4,Z的单质能与盐酸反应。 (1)根据上述条件不能确定的元素是__________(填代号),A的电子式为__________,举例说明Y、Z的金属性相对强弱:______________________________( 7 写出一个即可)。 (2)W能形成多种含氧酸及对应的盐,其中NaH2WO2能与盐酸反应但不能与NaOH溶液反应,则下列说法中正确的是__________(填字母) A. H3WO2是三元酸 B.H3WO2是一元弱酸 C.NaH2WO2是酸式盐 D.NaH2WO2不可能被硝酸氧化 (3)X、M形成的一种化合物MX2是一种优良的水处理剂,某自来水化验室利用下列方法检测处理后的水中MX2残留量是否符合饮用水标准(残留MX2的浓度不高于0.1 mg·L-1,已知不同pH环境中含M粒子的种类如下图所示: Ⅰ.向100.00 mL水样中加入足量的KI,充分反应后将溶液调至中性,再加入2滴淀粉溶液。 Ⅱ.向Ⅰ中所得溶液中滴加2.0×10-4mol·L-1的Na2S2O3溶液至终点时消耗5.00 mL标准溶液(已知+I2 +2I-)。 ①则该水样中残留的MX2的浓度为__________mg·L-1。 ②若再向Ⅱ中所得溶液中加硫酸调节水样pH至1~3,溶液又会呈蓝色,其原因是 ___________________(用离子方程式表示)。 7查看更多