- 2021-04-16 发布 |
- 37.5 KB |
- 33页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
杭州专版2020中考化学复习方案第08课时盐和化肥课件
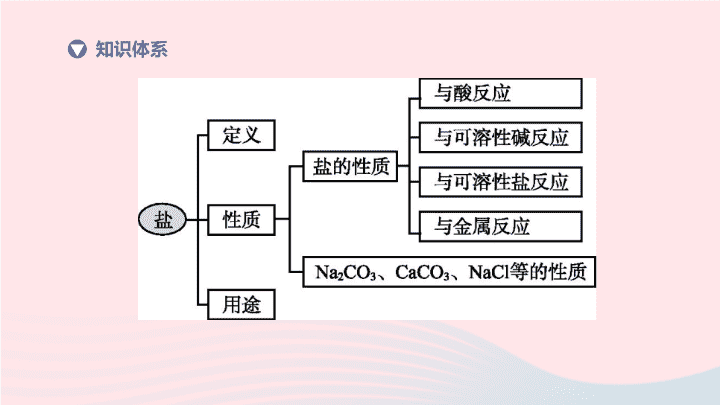
第 8 课时 盐和化肥 化学 | 第一部分 考点过关 知识体系 1. 说出盐的含义及主要化学性质 (1) 含义:由 ( 或 ) 和 构成的化合物 . 盐实质上是 和 反应的产物 . (2) 盐的溶解性: ①常见的可溶性盐: 、 、 、 . ②常见的难溶性盐: 盐酸盐除 难溶外均可溶; 硫酸盐除 难溶, CaSO 4 、 Ag 2 SO 4 微溶外均可溶; 碳酸盐大多难溶 ( 除 K 2 CO 3 、 Na 2 CO 3 、 (NH 4 ) 2 CO 3 等 ). 重点梳理 金属阳离子 铵根离子 酸根离子 酸 碱 钾盐 钠盐 铵盐 硝酸盐 AgCl BaSO 4 (3) 主要化学性质: ①与酸反应生成 和 . ②与可溶性碱反应生成 和 . ③与可溶性盐反应生成 和 . ④与金属反应生成 和 . 新盐 新酸 新盐 新碱 新盐 新盐 新盐 新金属 2. 概述氯化钠、纯碱、碳酸钙的主要性质及用途 (1) 碳酸钠 ①碳酸钠 (Na 2 CO 3 ) 俗称 、 ,是一种 色固体, 溶于水,它的水溶液呈 性,能使无色酚酞试液 . 主要用于造纸、纺织、玻璃、洗涤剂的生产 . 碳酸钠的结晶水合物即碳酸钠晶体 (Na 2 CO 3 ·10H 2 O) 易风化失去结晶水而形成粉末状碳酸钠 . ②碳酸钠的主要化学性质: 酸碱灭火器: Na 2 CO 3 +2HCl ; 土法制碱: Na 2 CO 3 +Ca(OH) 2 ; Na 2 CO 3 +BaCl 2 . 纯碱 苏打 白 易 碱 变红 2NaCl+H 2 O+CO 2 ↑ 2NaOH+CaCO 3 ↓ 2NaCl+BaCO 3 ↓ (2) 碳酸钙 ①碳酸钙 (CaCO 3 ) 是一种 色、 溶于水的固体,是汉白玉、大理石和石灰石的主要成分 . 常用于建筑材料、补钙剂和牙膏中的摩擦剂 . ②碳酸钙的主要化学性质: 实验室制取二氧化碳: ; 工业制取二氧化碳: . 白 难 (3) 氯化钠 ①氯化钠 (NaCl) 是 的主要成分,有咸味,无色晶体,含杂质, 溶于水 . 来源于海水晒盐等 . 可调味,作防腐剂、融雪剂,农业上用氯化钠溶液选种,可配制 0.9% 的生理盐水,具有杀菌作用,腌制食品,是重要的化工原料 . ②氯化钠的主要化学性质: 与硝酸银溶液反应生成难溶于稀硝酸的白色氯化银沉淀: NaCl+AgNO 3 . 食盐 易 AgCl ↓ +NaNO 3 3. 知道一些盐的检验方法 (1) 可溶性盐酸盐 (Cl - ) 的检验方法:先取少量的待检物于试管中 ( 固体待检物可加水配成溶液 ) ,向其中滴加适量的硝酸银溶液;若有白色沉淀生成,则继续滴加足量稀硝酸;若沉淀不溶解,则证明该盐中含有 Cl - ,是一种盐酸盐 . 对点练习 考点 重要的盐 1. [2017· 株洲 ] 我国制碱工业的先驱 —— 侯德榜先生, 1921 年留美回国后,潜心研究制碱技术,发明了将制碱与制氨结合起来的联合制碱法 ( 又称侯氏制碱法 ) ,为纯碱和氮肥工业技术的发展作出了杰出贡献 . 下列物质中能与纯碱发生反应的是 ( ) A.NaOH B.NaHCO 3 C.H 2 SO 4 D.K 2 SO 4 C 2. [2019· 广州 ] 下列关于氯化钠的认识,正确的是 ( ) A. 组成:含有钠和氯两种单质 B. 性质:与盐酸类似,能与碳酸盐反应 C. 用途:可用于生产金属钠 D. 生产:常用钠与氯气通过化合反应获得 C 3. [2019· 福建 ] 下列关于碳酸钙的说法错误的是 ( ) A. 大理石的主要成分是碳酸钙 B. 实验室常用碳酸钙与稀硫酸反应制取 CO 2 C. 碳酸钙可用作补钙剂 D. 石灰浆粉刷墙壁, “ 出汗 ” 后变成碳酸钙 B 4. 检验生石灰中是否含有未分解的石灰石,可选用的试剂是 ( ) A. 氢氧化钠溶液 B. 硝酸银溶液 C. 氯化钡溶液 D. 稀盐酸 D 5. 氯化铵 (NH 4 Cl) 是 “ 侯氏制碱法 ” 的一种副产品 . 已知氯化铵的水溶液显酸性 . 下列关于氯化铵的说法正确的是 ( ) A. 氯化铵属于酸 B. 氯化铵是一种复合肥 C. 氯化铵与熟石灰混合使用可提高肥效 D. 氯化铵溶液与硝酸银溶液混合会产生白色沉淀 D 6. 图 H8-1 中各组物质 ( 或其溶液 ) 反应均可生成盐 ( 中心盐 ). (1) 分析图中信息,填写相应的文字,完善该图 . (2) 列举相应的化学方程式说明①、②: ① ; ② . 金属 图 H8-1 非金属氧化物 碱 Cu+2AgNO 3 2Ag+Cu(NO 3 ) 2 CO 2 +2NaOH Na 2 CO 3 +H 2 O 7. [2019· 福建 ] 小婷和小彤在帮助老师整理药品时,发现有四瓶失去标签的溶液,只知道它们分别是氢氧化钙溶液、硫酸铜溶液、碳酸钠溶液和稀盐酸 . 小婷很快就判断出其中一瓶是硫酸铜溶液 . 小彤把其他三种溶液分别编号成 A 、 B 、 C ,然后两两混合进行如下实验: 据此,小彤很快就分辨出了三种未知溶液 . 回答下列问题 . (1) 小婷判断出硫酸铜溶液的依据是 . (2)C 溶液中溶质的化学式是 . 硫酸铜溶液为蓝色,其他三种溶液为无色 实验 A+B B+C A+C 现象 无明显现象 有白色沉淀产生 有气体产生 Na 2 CO 3 7. [2019· 福建 ] 小婷和小彤在帮助老师整理药品时,发现有四瓶失去标签的溶液,只知道它们分别是氢氧化钙溶液、硫酸铜溶液、碳酸钠溶液和稀盐酸 . 小婷很快就判断出其中一瓶是硫酸铜溶液 . 小彤把其他三种溶液分别编号成 A 、 B 、 C ,然后两两混合进行如下实验: 据此,小彤很快就分辨出了三种未知溶液 . 回答下列问题 . (3)A 与 B 反应的基本类型是 . (4)B 与 C 反应的化学方程式是 . 复分解反应 实验 A+B B+C A+C 现象 无明显现象 有白色沉淀产生 有气体产生 Na 2 CO 3 +Ca(OH) 2 2NaOH+CaCO 3 ↓ 重点一 盐的主要化学性质 例 1 某学校的课外活动小组要测定某块盐碱地中的 NaCl 、 Na 2 SO 4 、 Na 2 CO 3 的含量,为盐碱地的改造提供依据 . 下面是他们的测定步骤: Ⅰ. 确定要测定地块的采样点; Ⅱ. 将采集好的土样晾干、粉碎、称量,加蒸馏水充分搅拌后过滤,取滤液; Ⅲ. 对所取滤液进行以下实验: ( 实验过程中所加试剂均是足量的,得到的所有沉淀中的阴离子都来自原土壤滤出液中 ) ; 图 H8-2 Ⅳ. 称量实验中得到的各种沉淀质量,计算得出盐碱地中上述三种盐的含量 . 请回答下列问题 . (1) 上述实验中试剂 A 的化学式是 ,试剂 B 的化学式是 ,气体和试剂 C 反应的化学方程式是 . (2) 若上述实验中试剂 A 为氯化钡溶液,则按上述实验步骤最终测得土壤中 的含量偏高 . Ba(NO 3 ) 2 图 H8-2 HNO 3 ( 或 HCl) CO 2 +Ba(OH) 2 BaCO 3 ↓ +H 2 O NaCl( 或氯化钠 ) 【 名师点津 】 氯化钠可以通过加入硝酸银,测定氯化银的质量确定氯化钠的质量;硫酸钠可以通过加入钡盐,生成的硫酸钡确定硫酸钠的质量;根据图示,首先加入硝酸钡将氯化钠分离出来;然后再根据碳酸钡可溶于酸,硫酸钡不溶于酸,通过测定硫酸钡的质量进而计算硫酸钠的质量;再通过生成二氧化碳与氢氧化钡反应生成碳酸钡的质量计算所含碳酸钠的质量 .(2) 无论测定哪种盐的含量,都要排除干扰;若加入试剂 A 为氯化钡溶液,则会增加溶液中氯离子的量,使生成的氯化银质量增加,从而造成测得土壤中氯化钠的含量偏高 . 【 变式 】 “ 低钠盐 ” 可以控制钠的摄入量从而防治高血压等疾病 . 制备 “ 低钠盐 ” 在食盐中按照配方比例添加食用 KCl. 国内某些生产厂家为改变 “ 低钠盐 ” 口味还会加入少量镁盐 ( 仅限 MgSO 4 或 MgCl 2 ). (1) 测得某 “ 低钠盐 ” 样品 a 中含有 NaCl 和 KCl 的质量分数均为 50%. 该样品 a 的水溶液中,含量最多的离子是 ( 填离子符号 ). Cl - 实验操作 预期现象及结论 步骤 1 :取少量样品 b 于烧杯中 , 样品溶解,形成无色溶液 步骤 2 :取少量步骤 1 形成的溶液于试管中,再滴加少量 NaOH 溶液,振荡 ,说明样品 b 中添加了镁盐 步骤 3 : _________________________ (2) 探究某 “ 低钠盐 ” 样品 b 中是否添加镁盐,以及添加的是何种镁盐 (MgSO 4 或 MgCl 2 中的一种 ). 请设计实验方案,完成下列表格 . 限选试剂: BaCl 2 溶液、 NaOH 溶液、 AgNO 3 溶液、蒸馏水 . 加足量蒸馏水,并用玻璃棒搅拌 有白色沉淀生成 取少量步骤 1 形成的溶液于试管中,再滴加少量的 BaCl 2 溶液振荡 若有白色沉淀产生,则添加的是 MgSO 4 ;若无明显现象,则添加的是 MgCl 2 重点二 食盐、纯碱、碳酸钙的主要性质及用途 例 2 Na 2 CO 3 是一种常见的盐,多角度看物质可以提高对该物质的认识 . (1)Na 2 CO 3 俗称 . (2) 从类别看, Na 2 CO 3 可以看作是某种碱和某种氧化物反应的产物 . 该反应的化学方程式为 . (3) 从用途看, Na 2 CO 3 可制备某些物质,如 Na 2 CO 3 +M→NaOH+N ,写出该反应的化学方程式: . 纯碱 2NaOH+CO 2 Na 2 CO 3 +H 2 O Na 2 CO 3 +Ca(OH) 2 CaCO 3 ↓ +2NaOH 实验步骤 实现现象 实验结论 取适量 NaCl 溶液于试管中,滴加石蕊试液,振荡 ① Na + 和 Cl - 与溶液的酸碱性无关 取适量滴有酚酞试液的 Na 2 CO 3 溶液少许于试管中,滴加 ② ③ ④ (4) 从组成看, Na 2 CO 3 、 NaCl 均属钠盐, NaCl 溶于水显中性,但 Na 2 CO 3 溶于水显碱性 . 请完善实验方案,探析上述性质差异的初步原因: 无明显现象 过量 CaCl 2 ( 或 BaCl 2 ) 溶液 产生白色沉淀, 溶液红色消失 Na 2 CO 3 溶于水呈碱性与 有关 1. 实验表明,用碱性溶液浸泡新鲜的蔬菜,能有效除去蔬菜上的残留农药,从而降低对人体的损害 . 根据上述原理,对刚买回来的蔬菜,你认为应浸泡在哪种溶液中 ( ) A. 白酒 B. 食醋 C. 烧碱溶液 D. 碳酸钠溶液 D 2. 玲玲猜测一瓶久置于空气中的 NaOH 溶液中可能含有了 Na 2 CO 3 ,她设计的下列实验能对此猜测提供有力实证的是 ( ) A. 滴加适量 CuSO 4 溶液 B. 滴加酚酞试液 C. 滴加足量稀盐酸 D. 滴加石蕊试液 C 3. 在人体的血液中,如果钾元素含量偏高,会引起心脏衰竭,甚至死亡;如果钾元素含量偏低,又会影响肌肉和神经的功能,这时就需要补充钾 . 医院常用一种含钾化合物的水溶液静脉注射补充钾元素,已知这种含钾化合物的水溶液能跟硝酸银溶液反应生成不溶于稀硝酸的白色沉淀 . 该化合物是 ( ) A.KNO 3 B.K 2 CO 3 C.KCl D.KOH C 4. “ 部分酸、碱和盐的溶解性表 ( 室温 )” 是学习化学的重要工具,下表是截取溶解性表中的一部分,有关①处物质的说法不正确的是 ( ) A. ①处物质的化学式是 FeCl 2 B. ①处物质的名称是氯化铁 C. ①处物质可溶于水 D. ①处物质类别属于盐 阴离子 阳离子 OH - Cl - … … … Fe 2+ 不 ① … … … B 5. 下列盐的用途中,错误的是 ( ) A. 用含亚硝酸钠的工业盐制香肠 B. 用碳酸钙作补钙剂 C. 用氯化钠配制生理盐水 D. 用碳酸氢钠作焙制糕点的发酵粉 A 6. 雨雪天气,公路路面结冰,给行车留下了极大的安全隐患,交通部门为此使用了大量的融雪剂 . 某公司生产的融雪剂主要成分为 NaCl ,可能还含有 KCl 、 BaCl 2 、 MgCl 2 和 CaCO 3 中的一种或几种 . 根据以下实验推断: (1) 取融雪剂样品于试管中加足量水,搅拌,得到无色澄清溶液 . 该融雪剂一定不含 . (2) 将上述所得溶液分为两份,往其中一份溶液中滴加氢氧化钠溶液,有白色沉淀产生 . 该融雪剂一定含 ,写出产生该白色沉淀的化学方程式: . (3) 往另一份溶液中滴加适量的硫酸钠溶液,无明显现象 . 该融雪剂一定不含 ,由以上实验现象,该融雪剂还可能含有 . CaCO 3 MgCl 2 MgCl 2 +2NaOH Mg(OH) 2 ↓ +2NaCl BaCl 2 KCl 7. [2019· 福建 ] 化学实验室有失去标签的稀硫酸、氢氧化钠、氢氧化钙、碳酸钠、氯化钡五瓶无色溶液,将其任意编号为 A 、 B 、 C 、 D 、 E ,然后两两混合进行实验,其部分实验现象如下表 ( 说明:硫酸钙视为可溶物 ). (1) 写出溶液 A 中溶质的化学式: . (2) 写出溶液 A 与 B 反应的化学方程式 : . (3) 写出溶液 C 和 D 反应的化学方程式: . Ca(OH) 2 Ca(OH) 2 +Na 2 CO 3 CaCO 3 ↓ +2NaOH 实验 A+B B+C B+D C+D 现象 产生沉淀 产生气体 产生沉淀 产生沉淀 BaCl 2 +H 2 SO 4 BaSO 4 ↓ +2HCl Na 2 CO 3 小于查看更多