理综化学卷·2018届河南省郑州市一中高二下学期入学测试(2017
河南省郑州市第一中学2016-2017学年高二下学期入学测试
理综化学
一、 选择题(共7小题,每题6分, 共42分)
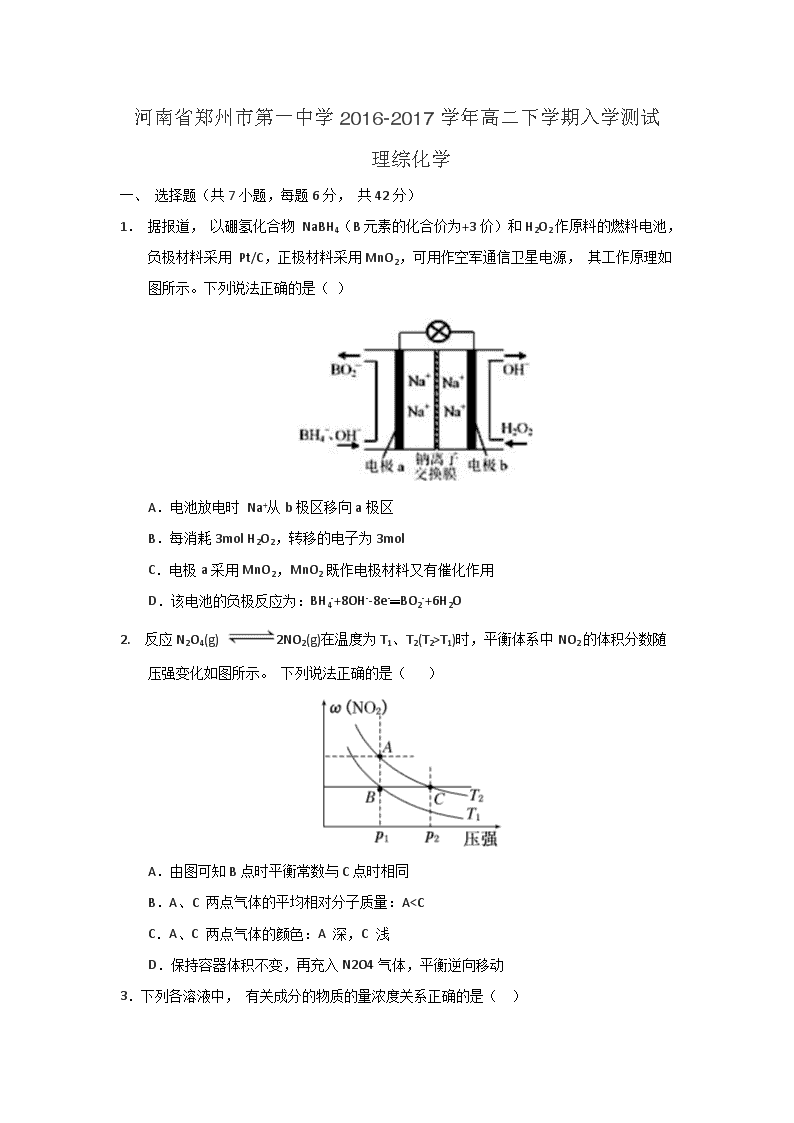
1. 据报道, 以硼氢化合物 NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用 Pt/C,正极材料采用MnO2,可用作空军通信卫星电源, 其工作原理如图所示。下列说法正确的是( )
A.电池放电时 Na+从b极区移向a极区
B.每消耗3mol H2O2,转移的电子为3mol
C.电极a采用MnO2,MnO2既作电极材料又有催化作用
D.该电池的负极反应为:BH4-+8OH--8e-═BO2-+6H2O
2. 反应N2O4(g) 2NO2(g)在温度为T1、T2(T2>T1)时,平衡体系中NO2的体积分数随压强变化如图所示。 下列说法正确的是( )
A.由图可知B点时平衡常数与C点时相同
B.A、C 两点气体的平均相对分子质量:A
c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B.0.1 mol·L-1 pH为4的NaHB溶液中: c(HB-)>c(H2B)>c(B2-)
C.硫酸氢铵溶液中滴加氢氧化钠至溶液恰好呈中性:
c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
D.pH 相等的(NH4)2SO4、(NH4)2Fe(SO4)2和NH4Cl溶液中:
c[(NH4)2SO4]>c[(NH4)2Fe(SO4)2]>c(NH4Cl)
4. 一定温度下, 三种碳酸盐 MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如下图所示。 已知:pM=-lgc(M),pc(CO32-)=-lgc(CO32-)。 下列说法正确的是
A.MgCO3、CaCO3、MnCO3 的Ksp依次增大
B. c点可表示MgCO3 的不饱和溶液,且 c(Mg2+)<c(CO32—)
C.b 点可表示 CaCO3的饱和溶液,且 c(Ca2+)<c(CO32—)
D. a 点可表示 MnCO3 的不饱和溶液,且c(Mn2+)= c(CO32—)
5. 现有四种元素的基态原子的电子排布式如下: ①1s22s22p63s23p4; ②1s22s22p63s23p3;
③1s22s22p5。 则下列有关比较中正确的是
A.第一电离能: ③>②>① B.原子半径: ③>②>①
C.电负性: ③>②>① D.最高正化合价: ③>②>①
6. 温度为T时, 向2.0L恒容密闭容器中充入1.0 molPCl5, 反应 PCl5(g) PCl3(g)+Cl2(g)。经一段时间后达到平衡。 反应过程中测定的部分数据见下表:
t/s
0
50
150
250
350
n(PCl3)/ mol
0
0.16
0.19
0.20
0.20
下列说法正确的是
A.反应在前50 s的平均速率为 v(PCl3)=0.0032 mol/(L·s)
B.保持其他条件不变, 升高温度, 平衡时, c(PCl3)=0.11 mol/L,则反应的△H<0
C.相同温度下, 起始时向容器中充入1.0molPCl5、0.20molPCl3和0.20molCl2, 达到平衡前 v(正)>v(逆)
D.相同温度下, 起始时向容器中充入2.0molPCl3、2.0molCl2, 达到平衡时,PCl3的转化率小于80%
7. 用铜片、 银片、 Cu(NO3)2 溶液、 AgNO3溶液、 导线和盐桥( 装有琼脂-KNO3的U型管)构成一个原电池。 以下有关该原电池的叙述正确的是( )
①在外电路中, 电流由铜电极流向银电极 ②正极反应为:Ag++e-=Ag
③实验过程中取出盐桥,原电池仍继续工作 ④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
A.①② B.②③ C.③④ D. ②④
二、 非选择题(共58分)
8.(1)工业生产甲醇的常用方法是: CO(g)+2H2(g) CH3OH(g) △H=-90.8 kJ/mol。
已知:2 H2(g)+ O2(g)= 2H2O (l) △H=-571.6 kJ/mol
H2(g)+1/2O2(g) = H2O (g) △H=-241.8 kJ/mol
①H2的燃烧热为______kJ/mol。
②CH3OH(g)+O2(g) CO(g)+2H2O (g)的反应热△H=_____________。
(2)N2、H2合成氨气为放热反应。 800 K时向下列起始体积相同的密闭容器中充入2 mol N2、3mol H2 H2, 甲容器在反应过程中保持压强不变, 乙容器保持体积不变, 丙是绝热容器,三容器各自建立化学平衡。
①达到平衡时, 平衡常数 K甲________K乙________K丙。
②达到平衡时N2的浓度 c甲(N2)________c 乙(N2), c 乙(N2)________c 丙(N2)。
③对甲、乙、丙三容器的描述,以下说法正确的是________。
A.乙容器气体密度不再变化时,说明此反应已达到平衡状态
B.在甲中充入稀有气体He,化学反应速率增大
C.向甲容器中充入氨气,正向速率减小,逆向速率增大
D.丙容器温度不再变化时说明已达平衡状态
9. 常温下,向100mL 0.01mol•L-1 HA 溶液中逐滴加入0.02 mol•L-1 MOH溶液, 图中所示的曲线表示混合溶液的pH变化情况(溶液体积变化勿略不计)。 回答下列问题:
(1)由图中信息可知HA为_______酸( 填“强”或“弱”)。
(2)常温下一定浓度的MA稀溶液的pH=a,则a_____7,用离子方程式表示其原因_________,此时,溶液中水电离出的c(OH-)=__________。
(3)请写出K点所对应的溶液中离子浓度的大小关系:_______________。
(4)K点所对应的溶液中,c(M+) + c(MOH) ______2c(A-); 若此时溶液的pH=10,则c(MOH)+c(OH-)= ________mol•L-1
10.如图,E为沾有Na2SO4溶液的滤纸,并加入几滴酚酞。A,B分别为Pt片,压在滤纸两端,R、S为电池的电极。M、N是用多微孔的Ni制成的电极材料,它在碱性溶液中可以视为惰性电极。G为电流计,K为开关。C、D和电解池中都充满浓KOH 溶液。 若在滤纸中央点上一滴紫色的KMnO4溶液,打开K,接通电源一段时间后,C、D中有气体产生。
(1)R为________(填“正”或“负”)极。
(2)A极附近溶液的现象是____________,B 极附近发生的电极反应式为_______________。
(3)滤纸上的紫色点向________(填“A”或“B”)方移动。
(4)当 C、D里的气体产生到一定量时,切断外电源并接通开关K,经过一段时间,C、D中气体逐渐减少,C中的电极为____极,电极反应式为_______________。
(5)人工光合作用能够借助太阳能, 用CO2和H2O制备化学原料。 右图是通过人工光合作用制备HCOOH 的原理示意图,催化剂a附近酸性,催化剂b表面的反应是______________。
11. 元素 X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p轨道上有4个电子。 元素Z的原子最外层电子数是其内层的3倍。元素W比元素X序数小5。
(1)X与Y所形成化合物晶体的晶胞如右图所示。
①在1个晶胞中,X离子的数目为_____________。
②该化合物的化学式为_______________。
③写出元素W的价电子排布式______________。
(2)在Y的氢化物(H2Y)分子中,Y原子轨道的杂化类型是__________。
(3)Z的氢化物 (H2Z) 在乙醇中的溶解度大于H2Y,其原因是_____________。
(4)Y与Z可形成YZ42-,YZ42-的空间构型为__________(用文字描述)。
(5)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,该配合物的1个配体中含有σ键的数目为_______。
参考答案
1.D 2.B 3.C 4.B 5.A 6.C 7.D
8.(14分,每空2分)
(1)①285.8 ②-392.8 kJ/mol
(2) ①= > ②> < ③CD
9.(14分,每空2分)
(1)强
(2)<;M+ + H2O= MOH+ H+ ;10-a
(3)c(M+)>c(A-)>c(H+)>c(OH-)
(4)=;0.005
10.(16分,每空2分)
(1)负
(2)溶液变红 4OH--4e-===2H2O+O2↑
(3)B
(4)负 2H2+4OH--4e-===4H2O
(5)减弱 CO2 +2H++2e一=HCOOH
11.(14分,每空2分)
(1)①4 ②ZnS ③3d54s1
(2)sp3
(3)水分子与乙醇分子之间形成氢键
(4)①正四面体 (5)3个