- 2021-04-16 发布 |
- 37.5 KB |
- 24页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
备战2021 高考化学 考点59 晶体结构与性质(原卷版)
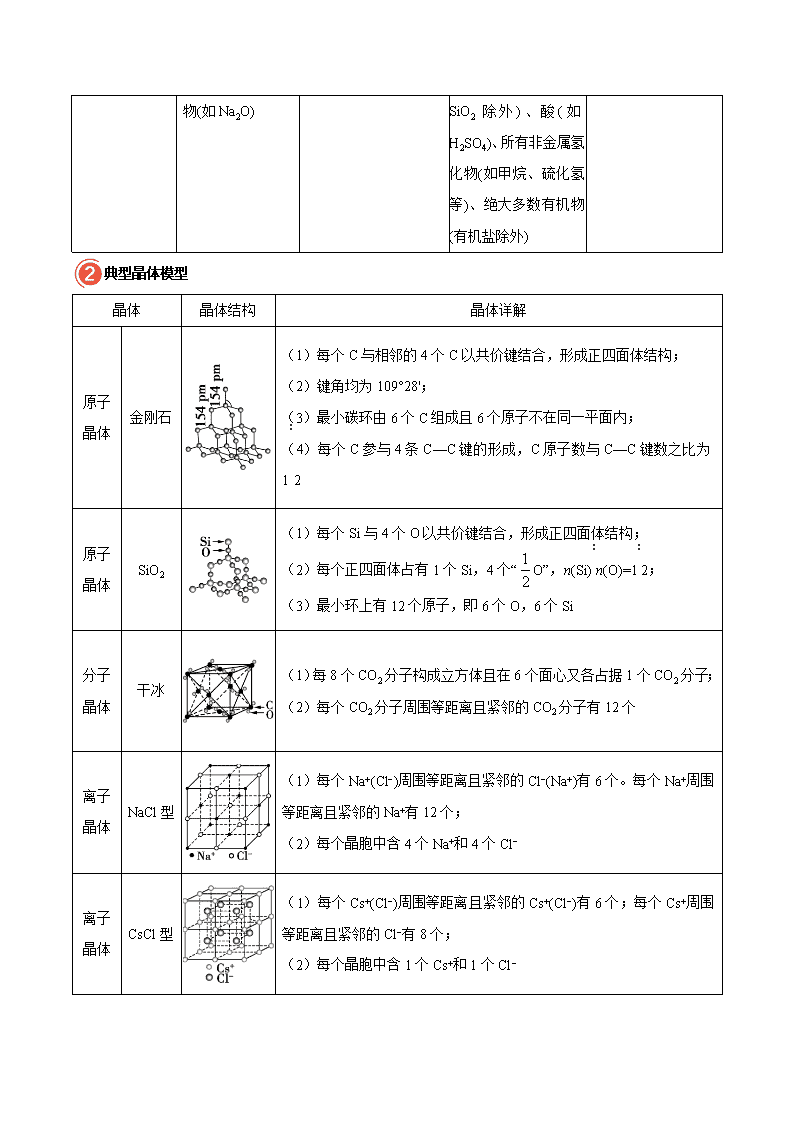
考点 59 晶体结构与性质 一、晶体常识 1.晶体与非晶体 比较 晶体 非晶体 结构特征 结构粒子周期 性有序排列 结构粒子无序排列 性质 特征 自范性 有 无 熔点 固定 不固定 异同 表现 各向异性 各向同性 二者区 分方法 ①间接方法:测定其是否有固定的熔点; ②科学方法:对固体进行 X−射线衍射实验 2.获得晶体的三条途径 (1)熔融态物质凝固。 (2)气态物质冷却不经液态直接凝固(凝华)。 (3)溶质从溶液中析出。 3.晶胞 (1)概念:描述晶体结构的基本单元。 (2)晶体中晶胞的排列——无隙并置 ①无隙:相邻晶胞之间没有任何间隙。 ②并置:所有晶胞平行排列、取向相同。 ③形状:一般而言晶胞都是平行六面体。 4.晶格能 (1)定义:气态离子形成 1 摩离子晶体释放的能量,通常取正值,单位:kJ·mol−1。 (2)影响因素 ①离子所带电荷数:离子所带电荷数越多,晶格能越大。 ②离子的半径:离子的半径越小,晶格能越大。 (3)与离子晶体性质的关系 晶格能越大,形成的离子晶体越稳定,且熔点越高,硬度越大。 易错警示: (1)具有规则几何外形的固体不一定是晶体,如切割整齐的玻璃。 (2)晶胞是从晶体中“截取”出来具有代表性的最小部分,而不一定是最小的“平行六面体”。 二、四类晶体的组成和性质 四种类型晶体的比较 类型 比较 离子晶体 金属晶体 分子晶体 原子晶体 概念 离子间通过离子 键结合而成的晶 体 金属原子通过金属键相 互结合形成的单质晶体 分子间以分子间作用 力相结合而形成的晶 体 相邻原子间以共价键 相结合而形成的具有 空间网状结构的晶体 构成晶体微粒 阴、阳离子 金属阳离子、自由电子 分子 原子 微粒之间的作用 力 离子键 金属键 分子间作用力 共价键 物理性 质 熔、沸点 较高 有的高(如钨)、有的低 (如汞) 较低 很高 硬度 较大 有的高(如铬)、有的低 (如钠) 较小 很大 导电性 熔融或在水溶液 中导电 良 本身不导电,溶于水时 发生电离后可导电 绝缘体(或半导体) 延展性 无 良 无 无 溶解性 易溶于极性溶剂, 难溶于有机溶剂 一般不溶于溶剂,钠等活 泼金属可与水、醇、酸反 应 极性分子易溶于极性 溶剂;非极性分子易溶 于非极性溶剂 不溶于任何溶剂 典型实例 强碱(如 NaOH)、 绝 大 部 分 盐 ( 如 NaCl)、金属氧化 金属单质(如钠、铝、铁 等)与合金 大多数非金属单质(如 P4、硫等)、非金属氧 化物(如 CO2、SO2 等, 金刚石、晶体硅、二氧 化硅等 物(如 Na2O) SiO2 除 外 ) 、 酸 ( 如 H2SO4)、所有非金属氢 化物(如甲烷、硫化氢 等)、绝大多数有机物 (有机盐除外) 典型晶体模型 晶体 晶体结构 晶体详解 原子 晶体 金刚石 (1)每个 C 与相邻的 4 个 C 以共价键结合,形成正四面体结构; (2)键角均为 109°28'; (3)最小碳环由 6 个 C 组成且 6 个原子不在同一平面内; (4)每个 C 参与 4 条 C—C 键的形成,C 原子数与 C—C 键数之比为 1∶2 原子 晶体 SiO2 (1)每个 Si 与 4 个 O 以共价键结合,形成正四面体结构; (2)每个正四面体占有 1 个 Si,4 个“ 1 2 O”,n(Si)∶n(O)=1∶2; (3)最小环上有 12 个原子,即 6 个 O,6 个 Si 分子 晶体 干冰 (1)每 8 个 CO2 分子构成立方体且在 6 个面心又各占据 1 个 CO2 分子; (2)每个 CO2 分子周围等距离且紧邻的 CO2 分子有 12 个 离子 晶体 NaCl 型 (1)每个 Na+(Cl−)周围等距离且紧邻的 Cl−(Na+)有 6 个。每个 Na+周围 等距离且紧邻的 Na+有 12 个; (2)每个晶胞中含 4 个 Na+和 4 个 Cl− 离子 晶体 CsCl 型 (1)每个 Cs+(Cl−)周围等距离且紧邻的 Cs+(Cl−)有 6 个;每个 Cs+周围 等距离且紧邻的 Cl−有 8 个; (2)每个晶胞中含 1 个 Cs+和 1 个 Cl− 金属 晶体 简单立 方堆积 典型代表为 Po,配位数为 6,空间利用率为 52% 面心立 方最密 堆积 又称为 A1 型或铜型,典型代表为 Cu、Ag、Au,配位数为 12,空间利 用率为 74% 体心立 方堆积 又称为 A2 型或钾型,典型代表为 Na、K、Fe,配位数为 8,空间利用 率为 68% 六方最 密堆积 又称为 A3 型或镁型,典型代表为 Mg、Zn、Ti,配位数为 12,空间利 用率为 74% 三、晶体类型的判断及熔、沸点比较 1.晶体类型的判断方法 (1)依据构成晶体的微粒和微粒间的作用力判断 ①离子晶体的构成微粒是阴、阳离子,微粒间的作用力是离子键。 ②原子晶体的构成微粒是原子,微粒间的作用力是共价键。 ③分子晶体的构成微粒是分子,微粒间的作用力是范德华力。 ④金属晶体的构成微粒是金属阳离子和自由电子,微粒间的作用力是金属键。 (2)依据物质的分类判断 ①金属氧化物(如 K2O、Na2O 等)、强碱(NaOH、KOH 等)和绝大多数的盐是离子晶体。 ②大多数非金属单质(除金刚石、石墨、晶体硅等外)、非金属氢化物、非金属氧化物(除 SiO2 外)、绝大 多数酸、绝大多数有机物(除有机盐外)是分子晶体。 ③常见的单质类原子晶体有金刚石、晶体硅、晶体硼等,常见的化合类原子晶体有碳化硅、二氧化硅 等。 ④金属单质及合金是金属晶体。 (3)依据晶体的熔点判断 离子晶体的熔点较高;原子晶体的熔点很高;分子晶体的熔点较低;金属晶体多数熔点高,但也有比 较低的。 (4)依据导电性判断 ①离子晶体溶于水或处于熔融状态时能导电。 ②原子晶体一般为非导体。 ③分子晶体为非导体,但分子晶体中的电解质(主要是酸和强极性非金属氢化物)溶于水,使分子内的化 学键断裂形成自由移动的离子,也能导电。 ④金属晶体是电的良导体。 (5)依据硬度和机械性能判断 离子晶体硬度较大(或硬而脆);原子晶体硬度大;分子晶体硬度小且较脆;金属晶体多数硬度大且具有 延展性,但也有硬度较低的。 2.不同类型晶体的熔、沸点的比较 (1)不同类型晶体的熔、沸点高低的一般规律:原子晶体>离子晶体>分子晶体。 但应注意原子晶体的熔点不一定比离子晶体高,如 MgO 具有较高的熔点,金属晶体的熔点不一定比分 子晶体的熔点高,如汞常温时为液态。 (2)金属晶体的熔、沸点差别很大,如钨、铂等金属的熔、沸点很高,汞、铯等金属的熔、沸点很低。 3.同种类型晶体的熔、沸点的比较 (1)原子晶体 原子半径越小→键长越短→键能越大→熔、沸点越高 如熔点:金刚石>碳化硅>硅。 (2)离子晶体 ①一般地,离子所带的电荷数越多,离子半径越小,则离子间的作用力就越强,其离子晶体的熔、沸 点就越高,如熔点:MgO>MgCl2>NaCl>CsCl。 ②衡量离子晶体稳定性的物理量是晶格能。晶格能越大,形成的离子晶体越稳定,熔点越高,硬度也 越大。 (3)分子晶体 ①分子间作用力越大,物质的熔、沸点越高;能形成氢键的分子晶体熔、沸点反常得高,如 H2O>H2Te>H2Se>H2S。 ②组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越高,如 SnH4>GeH4>SiH4>CH4。 ③组成和结构不相似的物质(相对分子质量接近),分子的极性越大,其熔、沸点越高,如 CO>N2, CH3OH>CH3CH3。 ④同分异构体,支链越多,熔、沸点越低。 如 CH3—CH2—CH2—CH2—CH3> > (4)金属晶体 金属离子半径越小,离子所带电荷数越多,其金属键越强,金属的熔、沸点越高,如熔、沸点:Na查看更多