- 2021-04-16 发布 |
- 37.5 KB |
- 12页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
河南省洛阳市宜阳一高2020-2021学年高二上学期化学周练试卷(12
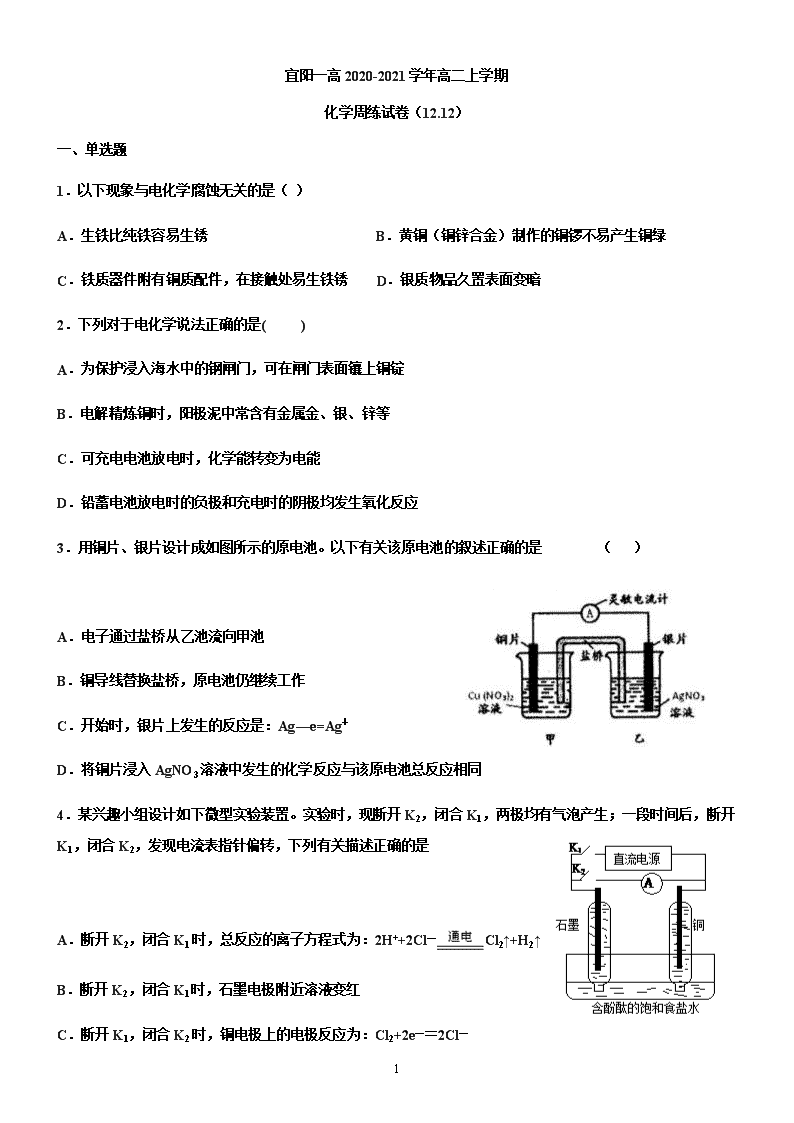
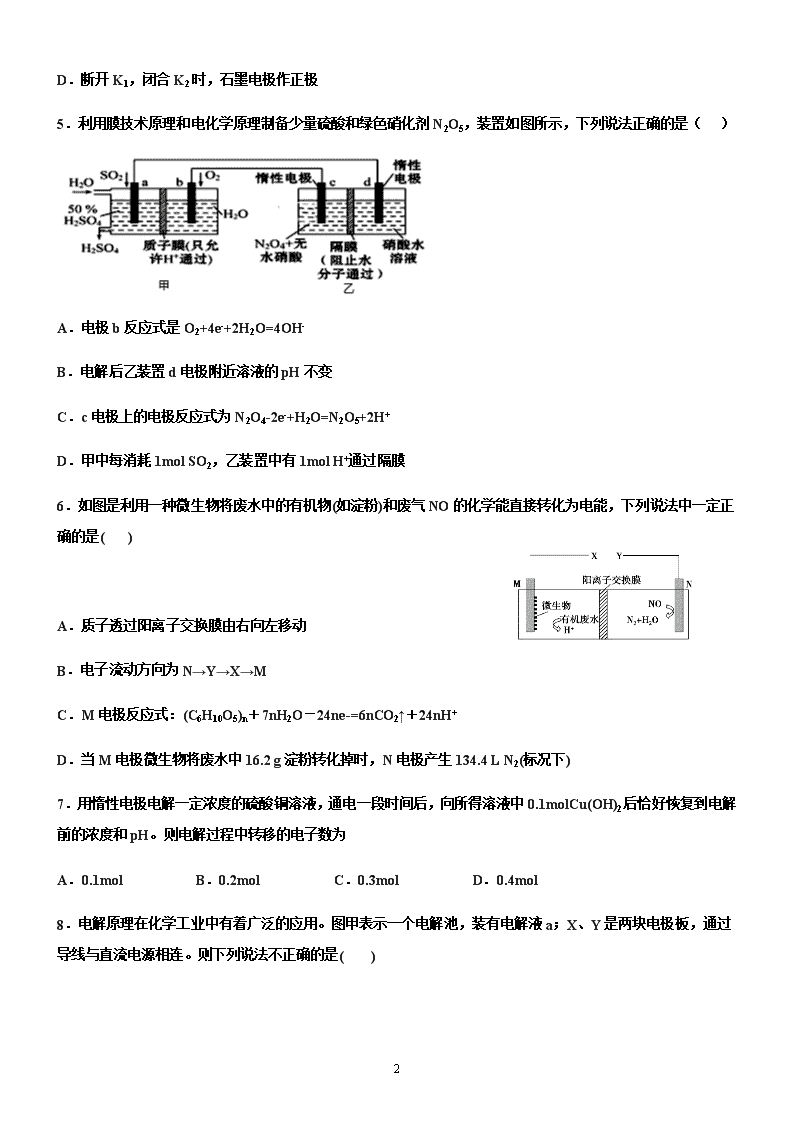
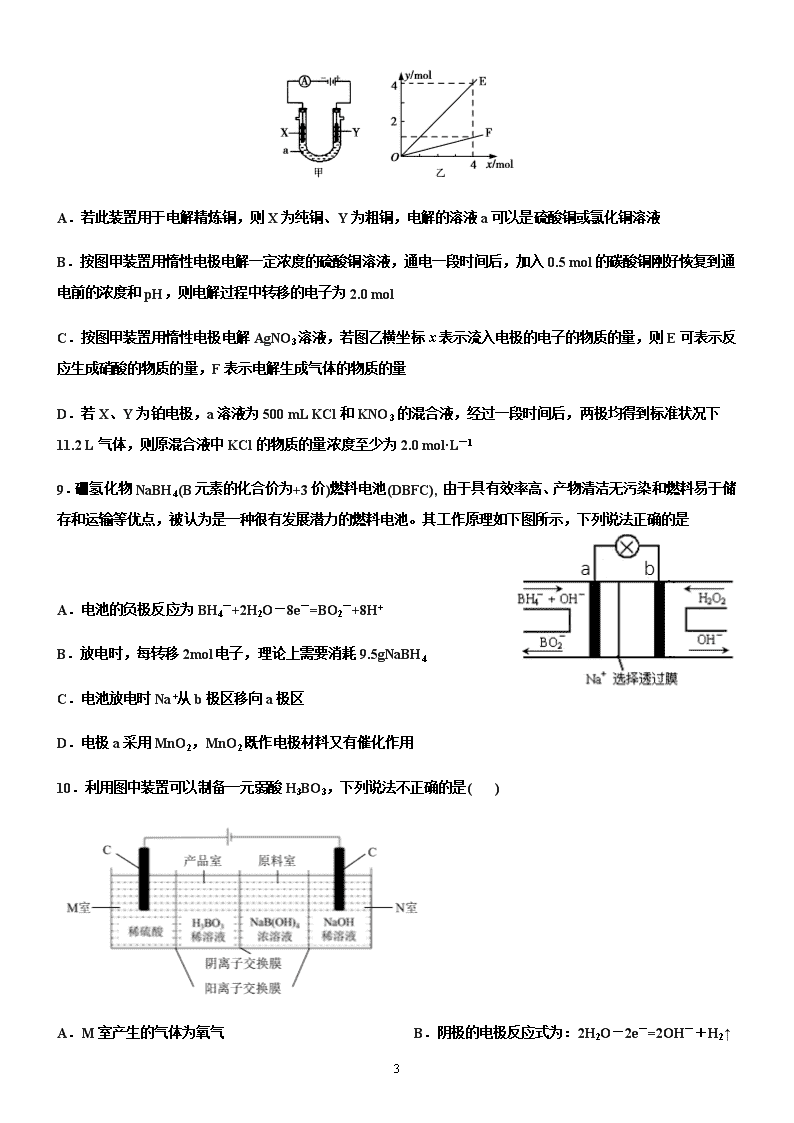
1 宜阳一高 2020-2021 学年高二上学期 化学周练试卷(12.12) 一、单选题 1.以下现象与电化学腐蚀无关的是( ) A.生铁比纯铁容易生锈 B.黄铜(铜锌合金)制作的铜锣不易产生铜绿 C.铁质器件附有铜质配件,在接触处易生铁锈 D.银质物品久置表面变暗 2.下列对于电化学说法正确的是( ) A.为保护浸入海水中的钢闸门,可在闸门表面镶上铜锭 B.电解精炼铜时,阳极泥中常含有金属金、银、锌等 C.可充电电池放电时,化学能转变为电能 D.铅蓄电池放电时的负极和充电时的阴极均发生氧化反应 3.用铜片、银片设计成如图所示的原电池。以下有关该原电池的叙述正确的是 ( ) A.电子通过盐桥从乙池流向甲池 B.铜导线替换盐桥,原电池仍继续工作 C.开始时,银片上发生的反应是:Ag—e=Ag+ D.将铜片浸入 AgNO3 溶液中发生的化学反应与该原电池总反应相同 4.某兴趣小组设计如下微型实验装置。实验时,现断开 K2,闭合 K1,两极均有气泡产生;一段时间后,断开 K1,闭合 K2,发现电流表指针偏转,下列有关描述正确的是 A.断开 K2,闭合 K1 时,总反应的离子方程式为:2H++2Cl— Cl2↑+H2↑ B.断开 K2,闭合 K1 时,石墨电极附近溶液变红 C.断开 K1,闭合 K2 时,铜电极上的电极反应为:Cl2+2e—=2Cl— 2 D.断开 K1,闭合 K2 时,石墨电极作正极 5.利用膜技术原理和电化学原理制备少量硫酸和绿色硝化剂 N2O5,装置如图所示,下列说法正确的是( ) A.电极 b 反应式是 O2+4e-+2H2O=4OH- B.电解后乙装置 d 电极附近溶液的 pH 不变 C.c 电极上的电极反应式为 N2O4-2e-+H2O=N2O5+2H+ D.甲中每消耗 1mol SO2,乙装置中有 1mol H+通过隔膜 6.如图是利用一种微生物将废水中的有机物(如淀粉)和废气 NO 的化学能直接转化为电能,下列说法中一定正 确的是( ) A.质子透过阳离子交换膜由右向左移动 B.电子流动方向为 N→Y→X→M C.M 电极反应式:(C6H10O5)n+7nH2O-24ne-=6nCO2↑+24nH+ D.当 M 电极微生物将废水中 16.2 g 淀粉转化掉时,N 电极产生 134.4 L N2(标况下) 7.用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中 0.1molCu(OH)2 后恰好恢复到电解 前的浓度和 pH。则电解过程中转移的电子数为 A.0.1mol B.0.2mol C.0.3mol D.0.4mol 8.电解原理在化学工业中有着广泛的应用。图甲表示一个电解池,装有电解液 a;X、Y 是两块电极板,通过 导线与直流电源相连。则下列说法不正确的是( ) 3 A.若此装置用于电解精炼铜,则 X 为纯铜、Y 为粗铜,电解的溶液 a 可以是硫酸铜或氯化铜溶液 B.按图甲装置用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,加入 0.5 mol 的碳酸铜刚好恢复到通 电前的浓度和 pH,则电解过程中转移的电子为 2.0 mol C.按图甲装置用惰性电极电解 AgNO3 溶液,若图乙横坐标 x 表示流入电极的电子的物质的量,则 E 可表示反 应生成硝酸的物质的量,F 表示电解生成气体的物质的量 D.若 X、Y 为铂电极,a 溶液为 500 mL KCl 和 KNO3 的混合液,经过一段时间后,两极均得到标准状况下 11.2 L 气体,则原混合液中 KCl 的物质的量浓度至少为 2.0 mol·L-1 9.硼氢化物 NaBH4(B 元素的化合价为+3 价)燃料电池(DBFC), 由于具有效率高、产物清洁无污染和燃料易于储 存和运输等优点,被认为是一种很有发展潜力的燃料电池。其工作原理如下图所示,下列说法正确的是 A.电池的负极反应为 BH4 -+2H2O-8e-=BO2 -+8H+ B.放电时,每转移 2mol 电子,理论上需要消耗 9.5gNaBH4 C.电池放电时 Na+从 b 极区移向 a 极区 D.电极 a 采用 MnO2,MnO2 既作电极材料又有催化作用 10.利用图中装置可以制备一元弱酸 H3BO3,下列说法不正确...的是( ) A.M 室产生的气体为氧气 B.阴极的电极反应式为:2H2O-2e-=2OH-+H2↑ 4 C.原料室的[B(OH)4]-穿过阴离子交换膜进入产品室 D.当电路中通过 1mol 电子时,可得到 1molH3BO3 11.X、Y、Z、W 均为短周期主族元素,它们在周期表中的相对位置如图所示,下列说法中正确的是( ) A.Y 的价层电子排布式是 B.四种元素所形成的最简单氢化物中,沸点最高的是可能 Y 的氢化物 C.Y、Z 之间可形成离子型化合物 D.X、Z、W 的最高价氧化物所对应的水化物不可能均是强酸 12.有 5 种元素 X、Y、Z、Q、T。X 原子 M 层上有 2 个未成对电子且无空轨道;Y 原子的特征电子构型为 3d64s2; Z 原子的 L 电子层的 p 能级上有一个空轨道;Q 原子的 L 电子层的 P 能级上只有一对成对电子;T 原子的 M 电 子层上 p 轨道半充满。下列叙述不正确的是( ) A.X 和 Q 结合生成的化合物为离子化合物 B.T 和 Z 各有一种单质的空间构型为正四面体形 C.元素 Y 和 Q 可形成化合物 Y2O3 D.ZO2 是极性键构成的非极性分子 13.下表列出了前 20 号元素中的某些元素性质的有关数据 元素 R 的原子半径为 1.02×10-10 m,下列有关叙述正确的是 A.以上 10 种元素的原子中,失去核外第一个电子所需能量最少的是⑧ B.由⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为 8 电子稳定结构的物质可 能是 PCl5 和 CCl4 C.元素 R 在周期表中位于第三周期第ⅤI 族 D.若物质 Na2R3 是一种含有非极性共价键的离子化合物,则其化合物的电子式 5 14.以下有关元素性质的说法不正确的是 A.具有下列电子排布式的原子中:①1s22s22p63s23p2,②1s22s22p3,③1s22s22p2,④1s22s22p63s23p4,原子半径 最大的是① B.具有下列价电子排布式的原子中:①3s23p1,②3s23p2,③3s23p3,④3s23p4,第一电离能最大的是③ C.①Na、K、Rb,②N、P、As,③O、S、Se,④Na、P、Cl,元素的电负性随原子序数增大而递增的是④ D.某元素气态基态离子的逐级电离能分别为 738、1 451、7 733、10 540、13 630、17 995、21 703,当它与氯 气反应时可能生成的阳离子是 X3+ 15.下列有关表述中正确的是 A.共价键的键能越大,共价键越不容易断裂,由此形成的分子越稳定 B.同一原子中 1s、2s、3s 电子的能量逐渐减小,同一原子中 2p、3p、4p 能级的轨道数依次增多 C.C—C,C=C,C≡C 键能之比为 1.00:1.77:2.34,根据以上数据,可知乙烯和乙炔不容易发生反应 D.SiH4、CH4、P4 分子的空间构型为正四面体形,键角都相同;CO2、C2H2 均为直线形分子 16.[Zn(CN)4]2-在水溶液中可与 HCHO 发生反应生成[Zn(H2O)4]2+和 HOCH2CN,下列说法错误的是( ) A.Zn2+基态核外电子排布式为[Ar]3d10 B.1molHCHO 分子中含有σ键的数目为 3mol C.HOCH2CN 分子中碳原子轨道的杂化类型是 sp3 D.[Zn(CN)4]2-中 Zn2+与 CN-的 C 原子形成配位键,结构可表示为 17.下列说法正确的是( ) A.水很稳定是因为水中含有大量的氢键 B.ABn 型分子中,若中心原子没有孤电子对,则 ABn 为空间对称结构,属于非极性分子 C.H2O、NH3、CH4 分子中的 O、N、C 分别形成 2 个、3 个、4 个键,故 O、N、C 分别采取 sp、sp2、sp3 杂 6 化 D.配合物[Cu(H2O)4]SO4 中,中心离子是 Cu2+,配体是 SO42-,配位数是 1 18.氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作 高温润滑剂,但不能导电。立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如图所示。关于这两 种晶体的说法,正确的是 A.立方相氮化硼含配位键 B→N B.六方相氮化硼层间作用力小,所以质地软,熔点低 C.两种氮化硼中的硼原子都是采用 sp2 杂化 D.六方相氮化硼晶体其结构与石墨相似却不导电,原因是没有可以自由移动的电子 19.下列说法正确的是 A.HF、HCl、HBr、HI 的熔沸点、还原性都依次升高(增强) B.通常测定氟化氢的相对分子质量大于理论值,因分子间存在氢键 C.BF3、NCl3、PCl5 分子中所有原子都满足最外层为 8 电子结构的是 NCl3、PCl5 D.氯的各种含氧酸的酸性由强到弱排列为 HClO>HClO2>HClO3>HClO4 20.据报道,大气中存在一种潜在的温室气体 SF5—CF3,虽然其数量有限,但它是已知气体中吸热最高的气体。 关于 SF5—CF3 的说法正确的是 A.分子中有σ键也有π键 B.分子中的 S 原子和 C 原子的杂化方式都是 sp3 C.分子中的所有原子在同一平面内 D.1 mol SF5—CF3 分子中有 9 mol 共用电子对 21.下列各项比较中前者高于(或大于或强于)后者的是 A.CCl4 和 SiCl4 的熔点 B.对羟基苯甲醛( )和邻羟基苯甲醛( )的沸点 C.I2 在水中的溶解度和 I2 在 CCl4 溶液中的溶解度 D.H2SO3 和 H2SO4 的酸性 7 22.铜离子是人体内多种酶的辅因子,某化合物与 Cu+结合形成如图所示的离子。下列有关该离子说法正确的 是( ) A.该离子中碳原子的杂化方式为 sp2 B.该离子中氮原子的杂化方式为 sp2 C.该离子中只有共价键(含配位键),没有离子键 D.H、N、Cu 三种元素的电负性顺序为:Cu>H>N 23.下列叙述正确的是( ) ①离子化合物可能含有共价键 ②构成分子的微粒一定含有共价键 ③共价化合物中不可能含有离子键 ④非 极性分子中一定含有非极性键 A.①② B.①③ C.②④ D.③④ 24.S2Cl2 是橙黄色液体,少量泄漏会产生窒息性气体,喷水雾可减慢其挥发,并产生酸 性悬浊液。其分子结构如图所示。下列关于 S2Cl2 的说法中错误的是( ) A.S2Cl2 为非极性分子 B.分子中既含有极性键又含有非极性键 C.与 S2Br2 结构相似,熔、沸点 S2Br2>S2Cl2 D.与水反应的化学方程式可能为 2S2Cl2+2H2O===SO2↑+3S↓+4HCl 25.第ⅤA 族元素的原子 R 与 A 原子结合形成 RA3 气态分子,其立体 结构呈三角锥形。RCl5 在气态和液态时,分子结构如图所示,下列关 于 RCl5 分子的说法中正确..的是( ) A.每个原子都达到 8 电子稳定结构 B.键角(Cl—R—Cl)有 90°、120°、180°几种 C.RCl5 受热后会分解生成分子 RCl3,RCl5 和 RCl3 都是极性分子 D.分子中 5 个 R—Cl 键键能各不相同 第 II 卷(非选择题) 26.叠氮化合物是一类重要的化合物,其中氢叠氮酸(HN3)是一种弱酸,其分子结构可表示为 H—N=N≡N, 肼(N2H4)被亚硝酸氧化时便可得到氢叠氮酸(HN3),发生的反应为 N2H4+HNO2=2H2O+HN3。HN3 的酸性和 醋酸相近,可微弱电离出 H+和 N3-。试回答下列问题: 8 (1)下列有关说法正确的是___ (填序号)。 A.HN3 中含有 5 个σ键 B.HN3 中的三个氮原子均采用 sp2 杂化 C.HN3、HNO2、H2O、N2H4 都是极性分子 D.N2H4 沸点高达 113.5℃,说明肼分子间可形成氢键 (2)叠氮酸根能与许多金属离子等形成配合物,如[Co(N3)(NH3)5]SO4,在该配合物中钴显___价;根据价层电 子对互斥理论判断 SO42-的空间构型为___ 。 (3)与 N3-互为等电子体的分子有___ (写两种即可)。 27.臭氧( 3O )在 2+ 2 6Fe H O 催化下能将烟气中的 2SO 、 xNO 分别氧化为 2- 4SO 和 - 3NO , xNO ,也可在其 他条件下被还原为 2N 。 (1) 2- 4SO 中心原子轨道的杂化类型为__________; - 3NO 的空间构型为__________(用文字描述)。 (2)与 3O 分子互为等电子体的一种阴离子为__________(填化学式)。 (3) 2N 分子中 σ 键与 π 键的数目比 n σ n π =: __________。 (4) 2+ 2 6Fe H O 与 NO 反应生成的 2+ 2 5Fe(NO) H O 中, NO 以 N 原子与 2+Fe 形成配位键。请在 2+ 2 5Fe(NO) H O 结构示意图的相应位置补填缺少的配体_________。 28.某盐的组成可表示为 3[H3ON5]·3[NH4N5]·NH4Cl。回答下列问题: (1)氯原子的电子排布式为________________。 (2)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周 期部分元素的 E1 变化趋势如图(a)所示,其中除氮元素外,其他元素的 E1 自左而右依次增大的原因是 _________________;氮元素的 E1 呈现异常的原因是__________________。 9 (3)经 X 射线衍射测得化合物 3[H3ON5]·3[NH4N5]·NH4Cl 的晶体结构,其局部结构如图(b)所示。 ①H3O+中心原子的杂化类型为________,NH4+的空间构型为________。 ②3[H3ON5]·3[NH4N5]·NH4Cl 中阴离子 N5-中的σ键总数为________个。分子中的大π键可用符号Π n m 表示,其中 m 代表参与形成大π键的原子数,n 代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π 6 6 ),则 N5-中的 大π键应表示为________。 ③图(b)中虚线代表氢键,其中表示式为(NH4+)N—H…Cl、________、________。 29.如图是一个电化学过程的示意图,请按要求回答下列问题 (1)甲池是 _______装置(填“原电池”或“电解池”) (2)写出电极反应式:通入 CH4 的电极________; A(Fe)电极_______ 。 (3) 反应一段时间后,甲池中消耗 1.6g 甲烷,则乙池中某电极的质量增加 _____ g。 (4)反应一段时间后,乙池中溶液成分发生了变化,想要完全恢复到电解前可加入的物质是____ (5)某工厂烟气中主要含 SO2,可用 NaOH 溶液吸收烟气中的 SO2,将所得的 Na2SO3 溶液进行电解,可循环再 生 NaOH,同时得到 H2SO4,其原理如下图所示(电极材料为石墨)。 10 ①图中 a 极要连接电源的______(填“正”或“负”)极,C 口流出的物质是______。 ②SO32-放电的电极反应式为______。 30.电化学在我们的生产生活中占有越来越重要的地位。 (1)①燃料电池是一种绿色环保、高效的化学电源。上图为甲醇燃料电池,则负极反应式为____。 ②用甲醇燃料电池电解 300mL 饱和食盐水,则电解的化学方程式为_________。电解一段时间后,当溶液的 pH 值为 13 时,消耗 O2 的质量为______g。(忽略溶液体积变化,不考虑损耗) ③用甲醇燃料电池电解 2L,1mol/L 硫酸铜溶液,一段时间后:两极共收集到标准状况下的气体 89.6L,则电路 中共转移_______mol 电子。 (2)利用电化学原理,将 NO2、O2 和熔融 KNO3 制成燃料电池,模拟工业电解法来处理含 Cr2O72-废水,如下 图所示;电解过程中溶液发生反应:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。 ①甲池工作时,NO2 转变成绿色硝化剂 Y,Y 是 N2O5,可循环使用,则石墨Ⅱ附近发生的电极反应式为__。 11 ②向完全还原为 Cr3+的乙池工业废水中滴加 NaOH 溶液,可将铬以 Cr(OH)3 沉淀的形式除去, 已知 Cr(OH)3 存在以下溶解平衡:Cr(OH)3(s) Cr3+(aq)+3OH-(aq),常温下 Cr(OH)3 的溶 度积 Ksp=c(Cr3+)•c3(OH-)=1.0×10-32,要使 c(Cr3+)降至 10-5mol•L-1,溶液的 pH 应调至________。 12 高二化学参考答案 1.D2.C3.D4.D5.B6.C7.D8.B9.B10.B11.B12.A13.D14.D15.A16.C 17.B18.D19.B20.D21.B22.C23.B24.A25.B 26.(1)CD (2) +3 正四面体形 (3) CO2、CS2 、N2O 等 27.(1) 3sp 平面(正)三角形 (2) - 2NO (3) 1:2 (4) 28.(1)1s22s22p63s23p5 (2) 同周期元素随核电荷数增大,原子半径逐渐变小,吸引电子能量增强,故结合一个电子释放 出的能量(E1)依次增大 N 原子的 2p 轨道为半充满状态,具有稳定性,故不易结合一个 电子 (3) sp3 杂化 正四面体 5 Π (H3O+)O—H…N(N ) (NH )N—H…N(N ) 29.(1)原电池 (2) CH4-8e-+10OH-=CO32-+ 7H2O Ag++e-=Ag (3) 86.4g (4) Ag2O (5)负 较浓的硫酸 SO32--2e + H2O-= SO42-+2H+ 30.(1)CH3OH-6e-+8OH-=CO32-+6H2O 2NaCl+2H2O 电解 2NaOH+H2↑+Cl2↑ 0.24g 8 (2)O2+4e-+2N2O5=4NO3- 5查看更多