- 2021-04-15 发布 |
- 37.5 KB |
- 10页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【化学】江苏省盐城市2019-2020学年高二下学期期末考试
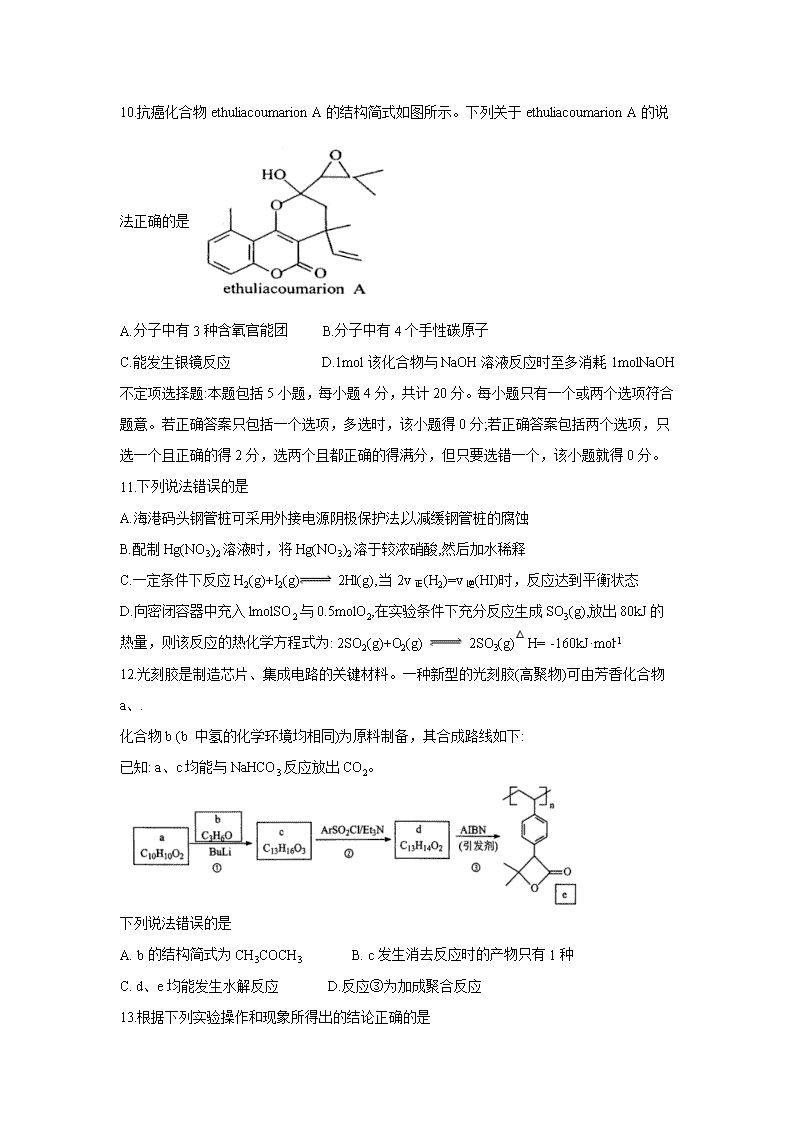
江苏省盐城市2019-2020学年高二下学期期末考试 可能用到的相对原子质量: H1 C12 N 14 选择题 单项选择题:本题包括10小题,每小题2分,共计20分。每小题只有一个选项符合题意。 1.近年来,德国研究人员利用O2、N2、CH4、NH3、H2O和HCN这6种远古地球上存在的简单物质,再使用硫醇和铁盐等物质模拟当时环境,成功制得核酸的4种基本模块。下列说法正确的是 A. O2的沸点比N2的低 B. NH3 分子呈三角锥形 C.配离子[Fe(H2O)6]3+中H与中心原子配位 D.元素C、N、O、S的第一电离能依次增大 请阅读下列材料,回答2~4题。 利用Kolbe's电解法制取乙炔的反应原理为: 2.下列表示反应中相关微粒的化学用语错误的是 A.中子数为20的钾原子: B. K+的结构示意图: C. CO2的电子式: D. C2H2 的结构式: 3.有关该反应的下列说法正确的是 A.化学能转变为电能 B.电解槽中向阴极迁移的主要是H+ C.电解过程中溶液pH不断减小 D.阴极的电极反应式为2H2O+ 2e-==20H-+ H2↑ 4.下列羧酸钾盐中,其水溶液电解生成的烃主要是CH2=CH2的是 A. CH3COOK B. CH3CH2COOK C. CH2=CHCOOK D. KOOCCH2CH2COOK 5.下列有关物质性质与用途具有对应关系的是 A. NaCl0能使蛋白质变性,可用于配制消杀剂 B. Na2CO3易溶于水,可用于去除餐具表面油污 C. FeCl3 水解显酸性,可用于催化H2O2的分解 D.醋酸具有挥发性,可用于溶洗热水器内水垢 6.下列反应均可在室温下自发进行,其中△H>0,△S>0的是 A. (NH4)2CO3(s) =NH3(g) + NH4HCO3(s) B. Mg(s) + 2HCl(aq) = MgCl2(aq) + H2(g) C.4Fe(OH)2(s)+O2(g)+2H2O(l) = 4Fe(OH)3(s) D. Al(OH)3(s)+3HNO3(aq) =Al(NO3)3(aq)+ 3H2O(l) 7.实验室以乙醇为原料制备少量1,2-二溴乙烷的相关装置如下图所示。下列说法正确的是 A.用装置甲制取乙烯,加热混合液使温度缓慢上升至170°C B.用装置乙净化乙烯,瓶中盛放的试剂可以是KMnO4酸性溶液 C.用装置丙制备1,2-二溴乙烷,冰水浴、液溴液面上加少量水等措施均可减少Br2的挥发 D.用装置丁净化尾气,可除去尾气中的Br2和未反应的乙烯气体 8.室温下,下列各组离子在指定溶液中能大量共存的是 A.能使甲基橙变红的溶液: Na+、 K+、AlO2-、 C1- B.0.1 mol·L-1苯酚溶液: K+、 Na+、 CO32-、OH- C.0.1 mol·L-1 NH4Fe(SO4)2溶液: H+、 Mg2+、 NO3-、 CI- D.由水电离产生的c(OH-)=1x10-13 mol·L-1的溶液: Na+、 NH4+、SO42-、CH3C0O- 9.下列指定反应的离子方程式错误的是 A. AgCl悬浊液中加入KI,沉淀由白色变为黄色: AgCl+I-=AgI + C1- B.用惰性电极电解MgCl2溶液: C. CaCO3与FeCl3溶液反应: 3CaCO3+2Fe3++3H2O = 3Ca2++2Fe(OH)3↓+3CO2↑ D.向佛水中滴加饱和氯化铁溶液得到红褐色液体: Fe3++3H2O Fe(OH)(胶体)3+3H+ 10.抗癌化合物ethuliacoumarion A的结构简式如图所示。下列关于ethuliacoumarion A的说法正确的是 A.分子中有3种含氧官能团 B.分子中有4个手性碳原子 C.能发生银镜反应 D.1mol该化合物与NaOH溶液反应时至多消耗1molNaOH 不定项选择题:本题包括5小题,每小题4分,共计20分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。 11.下列说法错误的是 A.海港码头钢管桩可采用外接电源阴极保护法,以减缓钢管桩的腐蚀 B.配制Hg(NO3)2溶液时,将Hg(NO3)2溶于较浓硝酸,然后加水稀释 C.一定条件下反应H2(g)+I2(g) 2Hl(g),当2v正(H2)=v逆(HI)时,反应达到平衡状态 D.向密闭容器中充入lmolSO2与0.5molO2,在实验条件下充分反应生成SO3(g),放出80kJ的 热量,则该反应的热化学方程式为: 2SO2(g)+O2(g) 2SO3(g)△ H= -160kJ·mol-1 12.光刻胶是制造芯片、集成电路的关键材料。一种新型的光刻胶(高聚物)可由芳香化合物a、. 化合物b (b 中氢的化学环境均相同)为原料制备,其合成路线如下: 已知: a、c均能与NaHCO3反应放出CO2。 下列说法错误的是 A. b的结构简式为CH3COCH3 B. c发生消去反应时的产物只有1种 C. d、e均能发生水解反应 D.反应③为加成聚合反应 13.根据下列实验操作和现象所得出的结论正确的是 14.肼(N2H4) 为二元弱碱,在水中的电离方式与NH3相似。25°C时, 水合肼(N2H4·H2O) 的电离常数K1、K2 依次为9.55x10-7、1.26x10-15。 下列推测或叙述一定错误的是 A. N2H4易溶于水和乙醇 B. N2H4分子中所有原子处于同- -平面 C. N2H6Cl2溶液中: 2c(N2H62+)+ c(N2H52+)>c(Cl-)+ c(OH-) D.25°C时,反应H++N2H4 N2H5+ 的平衡常数K=9.55x107 15. T°C时,在密闭容器中进行的反应: COCl2(g) CO(g)+ Cl2(g) △H= 108kJ·mol-1 ,在4min、10min、14min 时均只改变影响平衡的一个条件,各物质的浓度变化如下图所示: 下列说法正确的是 A.4min 时改变的条件是:降低体系的温度 B. 10min时改变的条件是:向体系中再充入Cl2 C.14min 时改变的条件是:增大容器的体积 D.若T°C时,起始向2L的恒容密闭容器中充入COCI2、Cl2、 CO均为0.20mol,则达到平衡 前,v正>v逆 非选择题 16. (10 分)铜酸镧是- -种反铁磁绝缘体,可由Cu(NO3)2和La(NO3)3为起始原料、水为溶剂、柠檬酸为络合剂,采用溶胶-凝胶法制备。 (1) Cu2+基态核外电子排布式为 (2)与NO3-互为等电子体的阴离子为 。 (3)柠檬酸(结构简式为 )分子中碳原子的轨道杂 化类型为 ; 1mol 柠檬酸分子含σ键数目为 mol。 (4)铜酸镧的晶胞结构如右图所示,写出其化学式: 。 17. (10 分) HCN是常见的化工原料,其有机衍生物往往以甙的形式广泛存在于植物界中。 (1) HCN中三种元素的电负性从大到小的顺序为 。 (2)室温时HCN的Ka=6.2x10-10,写出HCN的电离方程式: ; 向NaCN溶液中通入 CO2,发生反应的离子方程式为 (H2CO3 的Ka1=4.45x10-7、Ka2=4.7x10-11)。 (3)已知下列热化学反应: (4)测定木薯肉水解产物中HCN含量的步骤如下:称取a g木薯肉进行水解,将产生的HCN 蒸出,用V1 mLc1 mol·L-1Hg(NO3)2 溶液吸收HCN[Hg(NO3)2+2HCN =Hg(CN)2+2HNO3]; 以NH4Fe(SO4)2·12H2O作指示剂,用C2 mol·L-1 KSCN 标准溶液滴定上述剩余的Hg(NO3)2 [ Hg(NO3)2+2KSCN = Hg(SCN)2+ 2KNO3];滴定至终点时消耗KSCN溶液V2 mL。该木薯 肉样品中所含HCN的质量分数cHCN)= (用c1、c2、V1 、V2表示)。 18. (14分)藁本酚是一种新发现的倍半萜类化合物,具有较强的抗炎活性,其-种合成路线如下: (1) A中含氧官能团的名称为 和_ 。 (2) B→C的反应类型为 (3) D的分子式为C12Hl6O3,写出D的结构简式: . (4) E的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式: 。 ①只有两种不同化学环境的氢; ②碱性水解后酸化,得到两种产物,其中-种能与FeCl3溶液发生显色反应。 (5)写出以CH3CHO和为原料制备的合成路 线流程图(无机试剂任用,合成路线流程图示例见本题题干)。 19. (12分) 甲醇(CH3OH) 是一种重要的化工原料,可由H2与CO或CO2反应制备,主要用于制 备羧基甲酯等。 (1)水杨酸甲酯是无色透明油状液体,密度为1.54g·cm -3, 常作为医药制剂的赋香剂。制备及 提纯水杨酸甲酯的实验步骤如下: 步骤1.在三口烧瓶中加入3.5g (0.025mol) 水杨酸、15mL (0.375mol) 甲醇、1mL浓硫酸,几粒沸石,在85~ 95°C加热回流1.5h (装置如图所示)。. 步骤2.向回收甲醇后剩余液中加入10mL水,振荡、静置,分液出有机相。 步骤3.有机相依次用水、10%Na2CO3 溶液、水洗涤。 步骤4.干燥,蒸馏并收集221 ~224°C馏分。 ①图中仪器W的名称是 ②步骤3,第一次水洗的主要目的是 ; 第二次水洗的目的是 。 ③合成水杨酸甲酯的化学方程式为 ; 实验中加入过量甲醇的目的是 。 (2)工业上制备甲醇的主要反应有: 维持n(H2):[n(CO2)+n(CO)]=75:25, CO、CO2以及n(CO2):n(CO)=1:2,用不同催化 剂时甲醇的产率随温度的变化如下图所示: ①平衡常数K3= (用K1、 K2表示);△H 0 (填“>"或“<”)。 ②下列叙述正确的是 (填标号)。 A.催化剂Cu/ ZnO不能催化反应(I) B.催化剂Cu/ZnO在温度低于480K时活性很低 C.图中a点所示条件下,延长反应时间能提高甲醇的产率 D.图中b点所示条件下,若增加H2的浓度不能提高甲醇的产率 ③400K时向某恒容密闭容器中充入CO和H2,使c(CO)=0.10mol·L-1 , c(H2)=0.20mol·L-1, 且只发生反应(II); 平衡时c(CH;OH)=0.08mol·L-1.该温度下反应(I) 的平衡常数为 20. (14 分)水体富营养化是由于水体中N、P等营养盐含量过多而引起的水质污染现象。去除水体中N、P的方法很多。 (1)化学沉淀法去除水体中的PO43-,常用的化合物有AlCl3、Ca(OH)2 等。 ①AICl3溶液中AI3+水解的离子方程式为 。 ②Ca5(PO4)3OH的Ksp为6.8X10-37, 其溶度积常数表达式为Ksp[Ca5(PO4)3OH]= 。 (2)为探究将废水中氨态氮(NH3-N) 和PO43-同时去除,按n(NH4C1):nNa2HPO4):n(MgCl2) =1:1:1加入水中,实验测得不同pH下,氨态氮和PO43-的去除率如图(a)所示: 已知: (I) 去除的主要反应为: Mg2++NH4++HPO42-+6H2O MgNH4PO4 6H2O↓+H+ , (II)室温时,Ksp(MgNH4PO4 6H2O)=2.5X10-13, Ksp[Mg(OH)2]= 1.8x10-11, Ksp[Mg3(PO4)2]=6.3X10-31。 ①pH在8.5~10.5时,氨态氮和PO43-去除率随pH增大而增大,其原因是 (从平衡移动角度说明)。 ②当pH> 10.5时,氨态氮和PO43-去除率随pH增大而减小,其原因是 (从平衡移动角度说明)。 (3) -种浸没式SMDDC电池可用于去除地下水中硝态氮,其装置如图(b)所示: ①装置工作时,H+向 极(填“X”或“Y")室迁移。 ②X极上(CH2O)n→CO2 的电极反应式为 ; Y极上NO3-→>N2的电极反应式为 。 参考答案 单项选择题:本题包括10 小题, 每小题2 分, 共计20 分。 1.B 2.C 3.D 4.D 5.A 6.A 7.C 8.C 9.B 10.A 11.D 12.B 13.AC 14.BC 15.CD 不定项选择题:本题包括5小题,每小题4分,共计20分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。 16.(10分) (1)[Ar]3d9或1s22s22p63s23p63d9(2分) (2)CO32-(2分) (3)sp2和sp3(2分) 20(2分) (4)La2CuO4(2分) 17.(10分) (1)N、C、H(2分) (2)HCNH++CN-(2分) CO2+ CN-+H2O = HCO3-+ HCN(2分) (3)255.9(2分) (4)(2分) 18.(14分) (1)(酮)羰基(1分) (酚)羟基(1分) (2)加成反应(2分) (3)(3分) (4)(3分) (5)(4分) 19.(12分) (1)①(球形)冷凝管(1分) ②除去大部分的水杨酸和硫酸(1分) 除去水杨酸钠等盐(1分) ③(2分) 提高水杨酸的(平衡)转化率(1分) (2)①K1 / K2(1分) <(1分) ②BC(2分) ③2.5×103(2分) 20.(14分) (1)①Al3+ + 3H2OAl(OH)3 + 3H+(2分) ② c5(Ca2+)·c3(PO43-)·c(OH-)(2分) (2)①产物中H+与OH-结合生成H2O,使平衡右移(2分) ②生成Mg(OH)2和Mg3(PO4)2沉淀,c(Mg2+)减小,使平衡左移(2分) (3)① Y(2分) ② (CH2O)n + nH2O-4n e-= nCO2↑+4nH+(2分) 2NO3-+ 12H+ + 10e-= N2↑+6H2O(2分)查看更多