- 2021-04-15 发布 |
- 37.5 KB |
- 100页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届高考化学二轮复习物质的结构与元素周期律课件(100张)
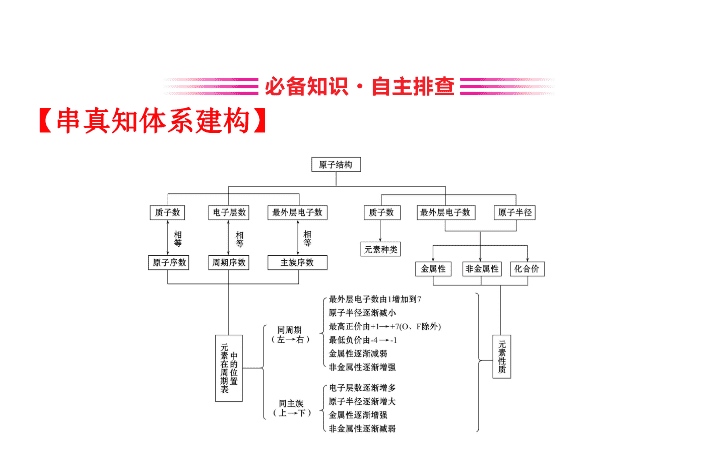
专题三 基 本 理 论 第 6 讲 物质的结构与元素周期律 【 串真知体系建构 】 【 研核心思维激活 】 【 研习任务 1】 2019 年 4 月 23 日 , 一场隆重的海上阅兵在 黄海上进行。国家主席、中央军委主席习近平登上检 阅台 , 检阅受邀参加海上阅兵的 13 国海军 18 艘舰艇。此 次参加海上阅兵 , 囊括了航母、新型核潜艇、驱逐舰、 战机等海军新型主战舰机。低丰度的浓缩铀可作为航 母的动力源泉 是核反应堆的重要原料。 (1) 的中子数为 ______ 和 是两种核素 , 它 们互称 ____________ 。 (2) 某元素的一种同位素 X 原子的质量数为 A, 含 N 个中子 , 它与 1 H 原子构成 H m X 分子 , 在 a g H m X 中所含原子的物质 的量为 ________, 所含中子的物质的量为 ________, 所 含质子数为 ________, 所含电子数为 ________ 。 答案 : (1)143 同位素 (2) (m+1) mol N mol (m+A-N)N A (m+A-N)N A 【 研习任务 2】 碳酸氢铵、硫酸铵和氯化铵三种物质是农业生产中常见的氮肥 , 分析它们的结构回答下列问题。 (1) 按构成微粒分类 , 它们属于哪类化合物 ? (2) 写出氯化铵的电子式 , 分析三种物质中存在什么化学键 ? 答案 : (1) 碳酸氢铵、硫酸铵和氯化铵属于铵盐 , 铵盐是 铵根离子和酸根离子结合而形成的化合物 , 由于是由离 子构成的 , 所以属于离子化合物。 (2) 氯化铵的电子式为 , 铵根离子中 有共价键 , 三种物质中既存在离子键也存在共价键。 【 研习任务 3】 现如今 , 世界各地的学生都会背元素周 期表 , 它被许多人视为化学领域最伟大的发现。 1869 年 , 俄国化学家德米特里 · 门捷列夫发现了化学元素的周 期性 , 并将已知的化学元素按照其各自的物理性质进行 了排列。元素周期表给化学世界带来了秩序 , 并预测了 一些当时尚未被发现的元素 , 为未来的理论研究指明了 方向。根据元素周期表填空 : 主族 周期 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0 一 H 二 ① ② ③ ④ 三 ⑤ ⑥ ⑦ ⑧ ⑨ ⑩ ⑪ ⑫ (1) 这些元素中 ,________( 填元素符号 ) 是最活泼的金 属元素 ,________ 是最活泼的非金属元素 ,________ 是 最不活泼的元素。 (2) 这些元素中 , 最高价氧化物对应的水化物中酸性最 强的是 ________, 碱性最强的是 ______, 呈两性的是 __________ 。 (3)⑤ 、⑥、⑦三元素的金属性由强到弱的顺序是 __________, 其最高价氧化物对应的水化物碱性由强到 弱的顺序是 __ 。 (4)⑧ 、⑨、⑩、⑪四元素的非金属性由强到弱的顺 序为 __________, 其最高价氧化物对应的水化物酸性由 强到弱的顺序是 __________, 氢化物的稳定性由强到弱 的顺序是 __ 。 答案 : (1)Na F Ar (2)HClO 4 NaOH Al(OH) 3 (3)Na 、 Mg 、 Al NaOH 、 Mg(OH) 2 、 Al(OH) 3 (4)Cl 、 S 、 P 、 Si HClO 4 、 H 2 SO 4 、 H 3 PO 4 、 H 2 SiO 3 HCl 、 H 2 S 、 PH 3 、 SiH 4 热点一 原子结构和微粒间的相互作用 【 研典例探究升华 】 角度一 : 原子结构及“四同”比较 【 典例 1】 (2019· 福州模拟 ) 近年 , 科学家发现了 116 号 元素 Lv 。下列关于 293 Lv 和 294 Lv 的说法错误的是 ( ) A. 两者电子数相差 1 B. 两者质量数相差 1 C. 两者中子数相差 1 D. 两者互为同位素 【 解析 】 选 A 。 293 Lv 和 294 Lv 的电子数都是 116,A 错误 ; 293 Lv 的质量数是 293, 294 Lv 的质量数是 294, 质量数相差 1,B 正确 ; 293Lv 的中 子数是 177, 294 Lv 的中子数是 178, 中子 数相差 1,C 正确 ; 293 Lv 和 294 Lv 是质子数相同 , 中子数不同 的同种元素的不同原子 , 互为同位素 ,D 正确。 【 规律方法 】 元素、核素、同位素、同素异形体之间的联系 角度二 : 原子结构示意图和电子式 【 典例 2】 (2019· 江苏高考 ) 反应 NH 4 Cl+NaNO 2 ==== NaCl+N 2 ↑+2H 2 O 放热且产生气体 , 可用于冬天石油开采。 下列表示反应中相关微粒的化学用语正确的是 ( ) A. 中子数为 18 的氯原子 B.N 2 的结构式 :N N C.Na + 的结构示意图 : D.H 2 O 的电子式 : 【 解析 】 选 D 。 A 项 ,Cl 的质子数为 17, 中子数为 18, 则质 量数为 35, 表示为 , 错误 ;B 项 ,N 2 分子中 N 与 N 之间 形成三键 , 结构式为 N≡N, 错误 ;C 项 ,Na 失去最外层一个 电子为 Na + , 结构示意图为 , 错误 ;D 项 ,H 2 O 为共 价化合物 ,H 和 O 之间为共用电子对 , 正确。 角度三 : 化学键与物质类型 【 典例 3】 (2019· 济南模拟 ) 一种碱金属与 C 60 形成的 新型超导材料球碳盐 K 3 C 60 , 属于离子化合物 , 下列分析 正确的是 ( ) A.C 60 中含有共价键 , 属于共价化合物 B.K 3 C 60 中既有离子键 , 又有共价键 C.1 mol K 3 C 60 中含有的阴离子个数为 3×6.02×10 23 D.C 60 和 K 3 C 60 , 两种物质中都存在分子间作用力 【 解析 】 选 B 。 C 60 只由一种元素组成 , 含有共价键 , 属 于单质 ,A 错误 ; 依据 K 3 C 60 属于离子化合物可知 , 该化合 物中一定含有离子键 , 但碳原子与碳原子之间只能形成 共价键 ,B 正确 ;K 3 C 60 中的阴离子为 , 则 1 mol K 3 C 60 中 含有的阴离子数为 6.02×10 23 ,C 错误 ;K 3 C 60 属于离子化 合物 , 不存在分子间作用力 ,D 错误。 【 规律方法 】 微粒之间的相互作用力判断方法 【 精整合技法指导 】 1. 原子构成的符号 2. 书写“电子式”需要注意 5 个问题 (1) 首先要判断是阴离子还是阳离子 , 是离子化合物还 是共价化合物。 (2) 不能漏写没有参与成键的电子对 , 如 NH 3 的电子式不 是 。 (3) 不能错误合并离子 , 如 Na 2 O 2 的电子式写成 2Na + 是错误的。 (4) 不能混淆化学键的类别 , 如 H 2 O 2 的电子式写成 H + 2- H + 是错误的。 (5) 离子 ( 或根 ) 带电荷 , 基团不显电性 , 如 OH - 为 ,-OH 为 H 。 3. 化学键与化合物的关系 (1) 离子化合物中一定含离子键 , 可能含非极性键和极性键 ; (2) 共价化合物一定含极性键 , 可能含非极性键 , 一定不含离子键 ; (3) 既有极性键又有非极性键的共价化合物一般由多个原子组成 , 如 H 2 O 2 、 C 2 H 4 等 ; (4) 既有离子键又有极性共价键的物质 , 如 NaOH 、 K 2 SO 4 等 ; 既有离子键又有非极性共价键的物质 , 如 Na 2 O 2 等。 【 练类题巩固拓展 】 1. (2019· 南京模拟 ) 下列有关化学用语的表示正确的 是 ( ) A. 氯分子的电子式 : B. 氯离子 (Cl - ) 的结构示意图 : C. 质子数为 17 、中子数为 20 的氯原子 D. 氯乙烯分子的结构简式 :H 3 C-CH 2 Cl 【 解析 】 选 A 。 A. 氯分子中每个氯原子最外层都满足 8 电子稳定结构 , 其电子式为 , 故 A 正确 ;B. 为氯原子结构示意图 , 氯离子的核外电子总数为 18, 最 外层满足 8 电子稳定结构 , 其正确的离子结构示意图 为 , 故 B 错误 ;C. 质子数为 17 、中子数为 20 的氯 原子的质量数为 37, 其正确的表示方法为 , 故 C 错误 ; D. 氯乙烯分子中含有 1 个碳碳双键 , 其正确的结构简 式为 H 2 C CHCl, 故 D 错误。 2. 下列叙述不正确的是 ( ) A. 6 Li 和 7 Li 的电子数相等 , 中子数也相等 B. 1 H 和 2 H 是不同的核素 , 它们的质子数相等 C. 14 C 和 14 N 的质量数相等 , 它们的中子数不等 D. 13 C 和 14 C 属于同一种元素 , 它们互为同位素 【 解析 】 选 A 。 A 项 , 6 Li 和 7 Li 的质子数都为 3, 电子数也 都为 3, 中子数分别为 6-3=3 、 7-3=4, 所以中子数不相等 , 错误 ;B 项 , 1 H 和 2 H 的质子数都为 1, 中子数分别为 0 、 1, 所以 1 H 和 2 H 是不同的核素 , 正确 ;C 项 , 14 C 和 14 N 的质量数 相等 , 质子数分别为 6 、 7, 中子数分别为 14-6=8 、 14- 7=7, 所以它们的中子数不等 , 正确 ;D 项 , 13 C 和 14 C 的质子 数都为 6, 属于同一种元素 , 中子数分别为 13-6=7 、 14-6=8, 所以它们互为同位素 , 正确。 3.(2019· 滨州模拟 )X 、 Y 为两种短周期元素 , 其原子的 最外层电子数分别是 1 和 6, 则 X 、 Y 两种元素形成的常见 化合物或者离子不可能是 ( ) A. 只含极性键的共价化合物 B. 含非极性键的共价化合物 C. 阴阳离子个数之比为 1∶1 的离子化合物 D. 含非极性键的离子化合物 【 解析 】 选 C 。由题意可知 ,X 可能为 H 、 Li 、 Na,Y 可能为 O 、 S, 故 X 、 Y 形成的化合物有 H 2 O 、 H 2 O 2 、 H 2 S 、 Na 2 O 2 、 Na 2 O 、 Na 2 S 等。 【 加固训练 】 1. 科学家最近发现了一种只由四个中子构成的粒子 R, 这标志着人类对化学微观世界的研究又取得了新的进 展。下列有关 R 的说法不正确的是 ( ) A.R 与其他原子一样呈电中性 B.R 的质量数与 4 He 相同 C. 与氢元素的质子数相同 D.R 中不含质子可称为“零号元素” 【 解析 】 选 C 。 A. 该粒子由四个中子构成 , 中子不带电 , 所以该粒子也不显电性 ,A 正确 ;B. 该粒子由四个中子构成 , 所以该粒子的质量数为 4, 质量数与 4 He 相同 ,B 正确 ;C. 由于该粒子质子数为 0, 而氢元素的质子数为 1, 质子数不同 ,C 错误 ;D.R 中不含质子 , 可称为“零号元素” ,D 正确。 2. 下列各组中两种微粒所含电子数不相等的是 ( ) A.H 3 O + 和 OH - B.CO 和 N 2 C.HNO 2 和 N D.C 和 【 解析 】 选 D 。中性微粒的电子数 = 质子数 , 阳离子的电 子数 = 质子数 - 所带电荷数 , 阴离子的电子数 = 质子数 + 所 带电荷数 , 则 A 、 H 3 O + 和 OH - 均含有 10 个电子 ,A 不正确 ;B 、 CO 和 N 2 均含有 14 个电子 ,B 不正确 ;C 、 HNO 2 和 N 均含 有 24 个电子 ,C 不正确 ;D 、 C 中含有 8 个电子 , 而 含有 10 个电子 ,D 正确。 3. 下列说法正确的是 ( ) A.CO 2 的沸点低于 SiO 2 , 其原因是分子间作用力 : CO 2查看更多