- 2021-04-15 发布 |
- 37.5 KB |
- 3页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
人教版九年级化学上册教案(第三单元课题2 分子和原子第2课时)
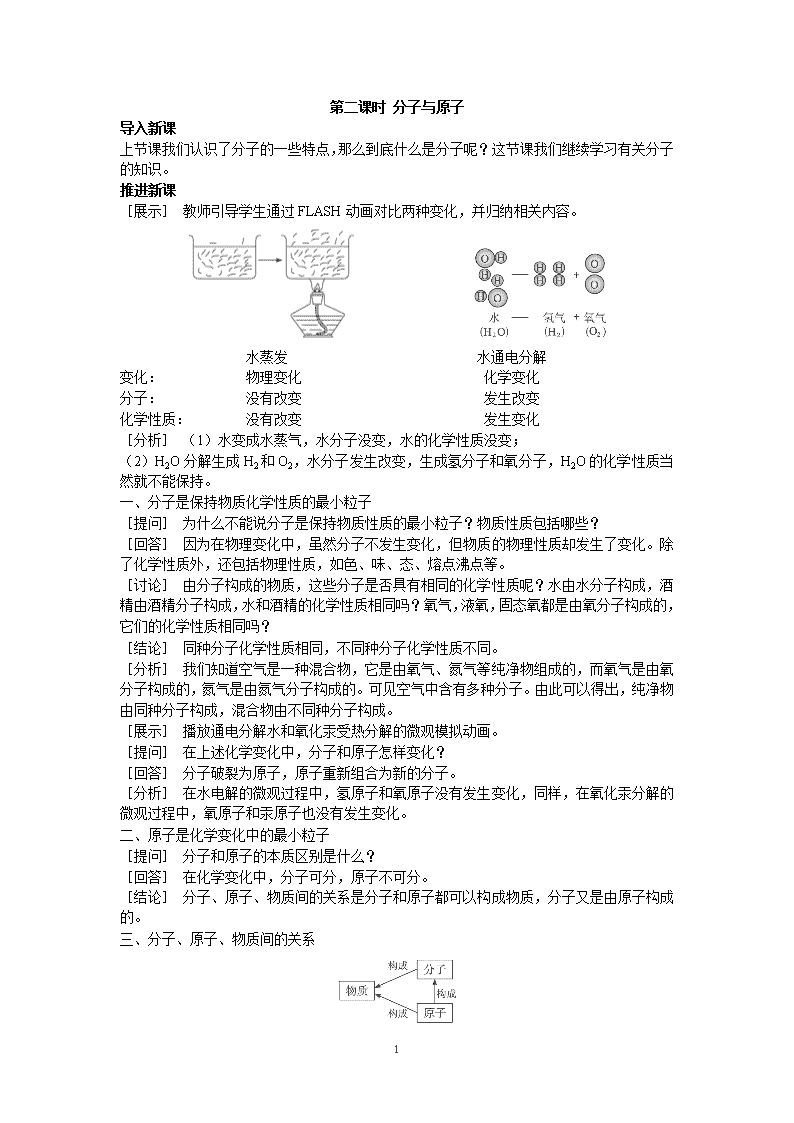
1 第二课时 分子与原子 导入新课 上节课我们认识了分子的一些特点,那么到底什么是分子呢?这节课我们继续学习有关分子 的知识。 推进新课 [展示] 教师引导学生通过 FLASH 动画对比两种变化,并归纳相关内容。 水蒸发 水通电分解 变化: 物理变化 化学变化 分子: 没有改变 发生改变 化学性质: 没有改变 发生变化 [分析] (1)水变成水蒸气,水分子没变,水的化学性质没变; (2)H2O 分解生成 H2 和 O2,水分子发生改变,生成氢分子和氧分子,H2O 的化学性质当 然就不能保持。 一、分子是保持物质化学性质的最小粒子 [提问] 为什么不能说分子是保持物质性质的最小粒子?物质性质包括哪些? [回答] 因为在物理变化中,虽然分子不发生变化,但物质的物理性质却发生了变化。除 了化学性质外,还包括物理性质,如色、味、态、熔点沸点等。 [讨论] 由分子构成的物质,这些分子是否具有相同的化学性质呢?水由水分子构成,酒 精由酒精分子构成,水和酒精的化学性质相同吗?氧气,液氧,固态氧都是由氧分子构成的, 它们的化学性质相同吗? [结论] 同种分子化学性质相同,不同种分子化学性质不同。 [分析] 我们知道空气是一种混合物,它是由氧气、氮气等纯净物组成的,而氧气是由氧 分子构成的,氮气是由氮气分子构成的。可见空气中含有多种分子。由此可以得出,纯净物 由同种分子构成,混合物由不同种分子构成。 [展示] 播放通电分解水和氧化汞受热分解的微观模拟动画。 [提问] 在上述化学变化中,分子和原子怎样变化? [回答] 分子破裂为原子,原子重新组合为新的分子。 [分析] 在水电解的微观过程中,氢原子和氧原子没有发生变化,同样,在氧化汞分解的 微观过程中,氧原子和汞原子也没有发生变化。 二、原子是化学变化中的最小粒子 [提问] 分子和原子的本质区别是什么? [回答] 在化学变化中,分子可分,原子不可分。 [结论] 分子、原子、物质间的关系是分子和原子都可以构成物质,分子又是由原子构成 的。 三、分子、原子、物质间的关系 2 [课堂练习] 保持二氧化碳化学性质的最小粒子是( ) A.二氧化碳分子 B.氧分子 C.碳原子 D.氧原子 答案:A [课堂小结] 本节课内容较少,主要学习了分子和原子的概念以及分子、原子与物质间的 关系。这部分内容比较重要,它是研究化学的基础,也是化学科学研究的一大特点。 板书设计 分子与原子 一、分子是保持物质化学性质的最小粒子 二、原子是化学变化中的最小粒子 三、分子、原子、物质间的关系 布置作业 1.能证明分子在化学变化中可以再分的事实是( ) A.水结成冰 B.水分蒸发 C.水被电解 D.水汽化 2.分子和原子的主要区别是( ) A.分子大、原子小 B.分子间有间隔,原子间没有间隔 C.在化学变化中,分子可以再分,而原子不可再分 D.分子在不停地运动,原子不运动 答案:1.C 2.C 教学反思 教学中通过动画演示了化学变化的微观过程,从多个侧面让学生去感觉、去体会、去认 知、去学习,效果较好。 备课资料 原子、分子概念的发展简史 早在公元前 500 年,印度哲学家蹇拿陀(Konad)就提出质点又由比它本身还小的、不能 再分割的某些质点所组成。他的说法接近于现代原子、分子的观点。 公元前 5 世纪,我国的著名哲学家墨翟(公元前 479—381)说,“非半不则不动,说在 端。……必半,毋与非半,不可也。……端,是无间也。”(见《墨经》)意思是说,物质到 了没有一半的时候,就不能拆开它了。物质如果没有可分的条件,那就不能分了。墨子的“端” 即物质的最小单位,有现代“原子”的意义,意味着他对物质的非连续性的认识。与此同时, 希腊哲学家德谟克利特(Democritus,约公元前 460—370)认为宇宙万物皆由大量的极微小的、 硬的、不可穿透的、不可分割的粒子所组成,他称这些粒子为原子(希腊文即“不可分割”的 意思)。按照这种学说:各种原子没有质的区别,只有大小、形状和位置的差异;原子遵循 必然的规律在“虚空”里不断运动;它们集合时形成物体,分离时物体就消灭;物体“投射”出 来的形象(影像)跟感官接触就引起色、声等感觉,感觉是认识的基础。到古希腊后期的伊壁 鸠鲁(Epicurus,公元前 372—271)和古罗马的卢克莱修(Lucretius,公元前 99—55)继承和发展 了前人的学说,认为各种原子在质上也有差异。当时正处于实用及自然哲学时期,化学发展 的特点是,进行实践的人不讲求理论探索(以罗马人为代表),而讲理论的人又不做实验,和 3 实践完全脱节(以希腊人为代表)。 经过了漫长的中世纪之后,原子概念受到了不少科学家的重视。随着生产和自然科学的 发展,原子学说也得到了发展。英国化学家道尔顿(Dalton,1766—1844)于 1803 年提出了原 子学说,包括以下几个要点: (1)元素的最终组成称为简单原子,它们是不可见的,是既不能创造,也不能毁灭和不可再 分割的。它们在一切化学变化中保持其本性不变。 (2)同一元素的原子,其形状、质量及各种性质都是相同的,不同种元素的原子在形状、质 量及各种性质上则各不相同。每一种元素以其原子的质量为其最基本的特征(这一点是道尔 顿原子学说的核心)。 (3)不同元素原子以简单数目的比例相结合,就形成化学中的化合现象。化合物的原子称为 复杂原子。复杂原子的质量为所含各种元素原子质量的总和。同一化合物的复杂原子,其形 状、质量和性质也必然相同。 道尔顿的原子论使当时的一些化学基本定律得到了统一的解释,因此很快地为当时化学 界所接受和重视。只是他忽视了原子和分子的区别。后来法国化学家盖·吕萨克(Gay-Lussac, 1778—1850)通过气体反应体积定律提出了分子假说作为对原子学说的补充。之后意大利的 阿伏加德罗(Avogadro,1778—1850)于 1811 年发表了一篇论文,引入了分子概念,并指出分 子跟原子的区别和联系。 原子分子学说虽然逐渐被人们接受了,但原子和分子当时还没有得到科学上的证实。直 到 1827 年英国植物学家布朗查看更多