- 2021-04-15 发布 |
- 37.5 KB |
- 12页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019高考化学二轮复习化学反应速率学案
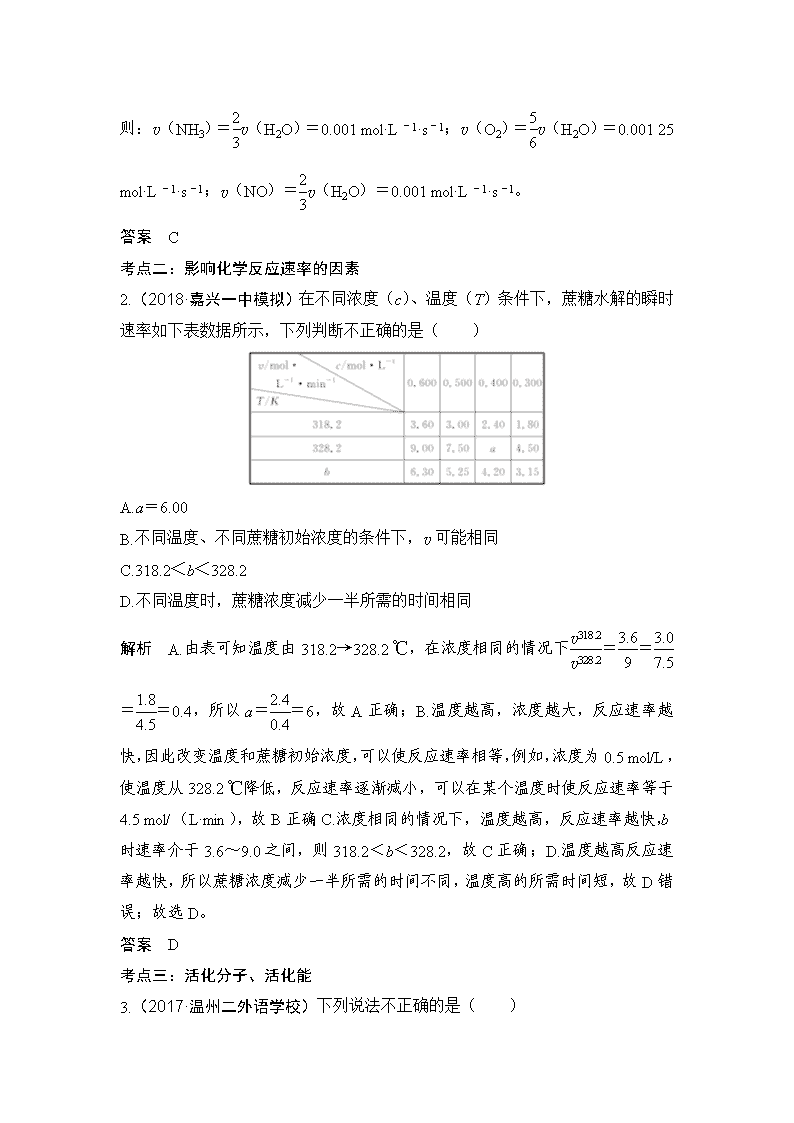
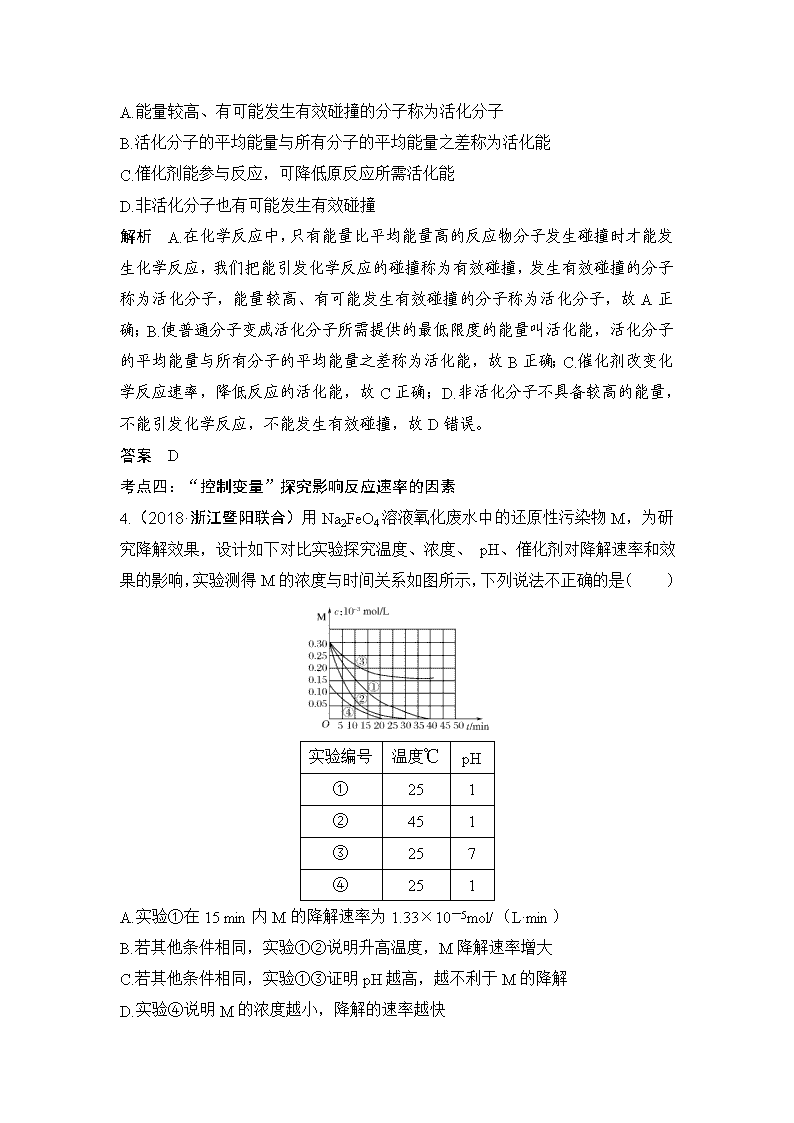
化学反应速率 [考试标准] 考点 知识条目 必考要求 加试要求 考情分析 化学反应速率及其简 单计算 a b 2015.10T20、2016.4T18、 2018.4、6T22 影响化学反应速率的 因素,控制反应条件 在生产和科学研究中 的作用 a b 2016.4T12、2016.4T30、 2016.10T21、2017.4T12、 2018.4、6T22 活化分子、活化能、 有效碰撞的概念 a 2016.10T30 有效碰撞理论 b 2016.10T30 化学反 应速率 实验数据的记录与处 理 c 2016.10T21、2017.4T21、 2018.4、6T22 考点一:化学反应速率的定量分析 1.(2017·浙江温州十校联合体)反应 4NH 3(g)+5O2(g) 4NO(g)+ 6H2O(g)在 10 L 密闭容器中进行,半分钟后,水蒸气的物质的量增加了 0.45 mol,则此反应的平均速率 v(x)(反应物的消耗速率或产物的生成速率)可表 示为( ) A.v(NH3)=0.010 mol·L-1·s-1 B.v(O2)=0.001 0 mol·L-1·s-1 C.v(NO)=0.001 0 mol·L-1·s-1 D.v(H2O)=0.045 mol·L-1·s-1 解析 在 10 L 密闭容器中进行,半分钟后,水蒸气的物质的量增加了 0.45 mol, 则 v(H2O)= 0.45 mol 10 L × 30s =0.001 5 mol·L-1·s-1,速率之比等于化学计量数之比, 则:v(NH3)=2 3v(H2O)=0.001 mol·L-1·s-1;v(O2)=5 6v(H2O)=0.001 25 mol·L-1·s-1;v(NO)=2 3v(H2O)=0.001 mol·L-1·s-1。 答案 C 考点二:影响化学反应速率的因素 2.(2018·嘉兴一中模拟)在不同浓度(c)、温度(T)条件下,蔗糖水解的瞬时 速率如下表数据所示,下列判断不正确的是( ) A.a=6.00 B.不同温度、不同蔗糖初始浓度的条件下,v 可能相同 C.318.2<b<328.2 D.不同温度时,蔗糖浓度减少一半所需的时间相同 解析 A.由表可知温度由 318.2→328.2 ℃,在浓度相同的情况下v318.2 v328.2 =3.6 9 =3.0 7.5 =1.8 4.5 =0.4,所以 a=2.4 0.4 =6,故 A 正确;B.温度越高,浓度越大,反应速率越 快,因此改变温度和蔗糖初始浓度,可以使反应速率相等,例如,浓度为 0.5 mol/L, 使温度从 328.2 ℃降低,反应速率逐渐减小,可以在某个温度时使反应速率等于 4.5 mol/(L·min),故 B 正确;C.浓度相同的情况下,温度越高,反应速率越快, b 时速率介于 3.6~9.0 之间,则 318.2<b<328.2,故 C 正确;D.温度越高反应 速率越快,所以蔗糖浓度减少一半所需的时间不同,温度高的所需时间短,故 D 错误;故选 D。 答案 D 考点三:活化分子、活化能 3.(2017·温州二外语学校)下列说法不正确的是( ) A.能量较高、有可能发生有效碰撞的分子称为活化分子 B.活化分子的平均能量与所有分子的平均能量之差称为活化能 C.催化剂能参与反应,可降低原反应所需活化能 D.非活化分子也有可能发生有效碰撞 解析 A.在化学反应中,只有能量比平均能量高的反应物分子发生碰撞时才能发 生化学反应,我们把能引发化学反应的碰撞称为有效碰撞,发生有效碰撞的分子 称为活化分子,能量较高、有可能发生有效碰撞的分子称为活化分子,故 A 正 确;B.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,活化分子 的平均能量与所有分子的平均能量之差称为活化能,故 B 正确;C.催化剂改变化 学反应速率,降低反应的活化能,故 C 正确;D.非活化分子不具备较高的能量, 不能引发化学反应,不能发生有效碰撞,故 D 错误。 答案 D 考点四:“控制变量”探究影响反应速率的因素 4.(2018·浙江暨阳联合)用 Na2FeO4 溶液氧化废水中的还原性污染物 M,为研 究降解效果,设计如下对比实验探究温度、浓度、 pH、催化剂对降解速率和效 果的影响,实验测得 M 的浓度与时间关系如图所示,下列说法不正确的是( ) 实验编号 温度℃ pH ① 25 1 ② 45 1 ③ 25 7 ④ 25 1 A.实验①在 15 min 内 M 的降解速率为 1.33×10-5mol/(L·min) B.若其他条件相同,实验①②说明升高温度,M 降解速率增大 C.若其他条件相同,实验①③证明 pH 越高,越不利于 M 的降解 D.实验④说明 M 的浓度越小,降解的速率越快 解析 A.根据化学反应速率的数学表达式,v(M)=(0.3-0.1)×10-3/15 mol/ (L·min)=1.33×10-5mol/(L·min),故 A 说法正确;B.①②不同的是温度,② 的温度高于①,在相同的时间段内,②中 M 的浓度变化大于①,说明②中 M 的 降解速率大,故 B 说法正确;C.①③对比温度相同,③的 pH 大于①,在相同的 时间段内,①中 M 浓度变化大于③,说明①的降解速率大于③,故 C 说法正确; D.①④对比 M 的浓度不同,0~15 时间段内,④中 M 浓度变化小于①,说明 M 的浓度越小,降解速率越小,故 D 说法错误。 答案 D 考点五:反应速率图像 5.(2017·浙江绍兴诸暨中学)一定温度下,将 1 mol A 和 1 mol B 气体充入 2 L 恒容密闭容器中,发生反应:A(g)+B(g) xC(g)+D(s),t1 时达到 平衡。在 t2、t3 时刻分别改变反应的一个条件,测得容器中气体 C 的浓度随时间 的变化如图所示。下列说法正确的是( ) A.反应方程式中的 x=1 B.t2 时刻改变的条件是使用催化剂 C.t3 时刻改变的条件是移去少量物质 D D.t1~t3 间该反应的平衡常数均为 4 解析 A.t2 时刻 C 的浓度增大,但平衡不移动,应是增大压强造成的,压强不影 响该平衡,所以有 x=1+1=2,故 A 错误;B.加入催化剂 C 的浓度不发生变化, 故 B 错误;C.D 为固体,减少 D 的量,不影响平衡,C 的浓度不发生变化,故 C 错误;D.t1~t3 间温度相同,平衡常数相同,由图可知平衡时 C 的浓度为 0.5 mol/L, 则: 所以平衡常数 K= c2(C) c(A) × c(B)= 0.52 0.25 × 0.25 =4,故 D 正确。 答案 D 易错点一 不能准确计算化学反应速率 1.计算化学反应速率时,要注意题目要求用何种物质表示,且注意是单位时间内 物质的量浓度的变化量,一般不用物质的量的变化量来表示。 2.化学反应速率是在一段时间内的平均速率,且均取正值。 3.固体和纯液体(不是溶液),其浓度可视为常数,因此不用固体和纯液体表示 化学反应速率。 [易错训练 1] (2018·宁波高三适应性测试)近些年,地表水和地下水域中的高 氯酸盐污染及其降解受到环境工作者的关注。某科研小组研究了一定条件下温度、 酸碱性对其降解的影响(初始质量浓度均为 100 mg/L),测得数据如图所示,下 列说法不正确的是( ) A.在 pH=7.5、温度为 35 ℃时,0~60 h 内高氯酸盐的降解平均速率为 1 mg/ (L· h) B.当 pH=7.5 时,高氯酸盐降解最适宜温度为 30 ℃ C.当温度一定时,随 pH 的减小,高氯酸盐的降解速率不一定增大 D.当降解时间为 100 h 时 ,pH=7.5、温度为 28 ℃与 pH=7.3、温度为 30 ℃两 种条件下高氯酸盐的降解率可能相等 解析 A.在 pH=7.5、温度为 35 ℃时,0~60 h 内高氯酸盐的浓度改变量约为 100 mg/L-60 mg/L=40 mg/L,所以降解平均速率为 2/3 mg/(L·h),故 A 错误;B. 由图像可知,当 pH=7.5 时,高氯酸盐降解最适宜温度为 30 ℃,故 B 正确;C. 当温度一定时,随 pH 的减小,高氯酸盐的降解速率不一定增大,例如,pH=9.0 时的降解速率低于 pH=10.0 时的降解速率,故 C 正确;D.由图像中的变化趋势 分析可得,当降解时间为 100 h 时 ,pH=7.5、温度为 28 ℃与 pH=7.3、温度为 30 ℃两种条件下高氯酸盐的降解速率可能相等,大约都是 0.6 mg/(L·h),所以 D 正确。本题正确答案为 A。 答案 A 易错点二 不能正确理解外界条件对速率的影响 1.误认为随着化学反应的进行,化学反应速率一定逐渐减小。其实不一定,因为 反应速率不仅受浓度影响,而且受温度影响,一般会先增大后减小。 2.误认为纯固体和纯液体不会改变化学反应速率。实际上不能用纯固体和纯液体 物质的浓度变化表示化学反应速率,但若将固体的颗粒变小(增大固体的接触面 积)则化学反应速率会加快。 3.误认为只要增大压强,化学反应速率一定增大。实际上反应在密闭固定容积的 容器中进行,若充入氦气(或不参与反应的气体),压强增大,但参与反应的各 物质的浓度不变,反应速率不变;若反应在密闭容积可变的容器中进行,充入氦 气(或不参与反应的气体)而保持压强不变,相当于压强减小,反应速率减小。 [易错训练 2] (2018·嘉兴高三二模)已知:2N2(g)+6H2O(g) 4NH3 (g)+3O2(g) ΔH=+Q kJ·mol -1,下图为该反应在不同初始浓度的 N2 和 不同催化剂Ⅰ、Ⅱ作用下(其他条件相同),体积为 2 L 的密闭容器中 n(NH3) 随反应时间的变化曲线,下列说法正确的是( ) A.0~6 h 内,催化剂Ⅰ的催化效果比催化剂Ⅱ的好 B.a 点时,催化剂Ⅰ、Ⅱ作用下 N2 的转化率相等 C.0~5 h 内,在催化剂Ⅰ的作用下,O2 的反应速率为 0.12 mol/(L·h) D.0~12 h 内,催化剂Ⅱ作用下反应吸收的热量比催化剂Ⅰ的多 解析 A.催化剂Ⅰ和催化剂Ⅱ的条件下,N2 的初始浓度不同,催化剂Ⅰ和催化 剂Ⅱ的催化效果没法比较,A 错误;B.N2 的初始浓度不同,a 点时生成 NH3 的物 质的量相等,因此 N2 的转化率不相等,B 错误;C.由图像可知 0~5 h 内,在催 化剂Ⅰ的作用下,生成 NH3 的物质的量为 0.8 mol,根据方程式可知生成 O2 的物 质的量为 0.6 mol,所以 O2 的反应速率为: 0.6 mol 5 h × 2 L =0.06 mol/(L·h),C 错误; D.0~12 h 内,催化剂Ⅱ作用下生成 NH3 的物质的量比催化剂Ⅰ的多,因此催化 剂Ⅱ作用下反应吸收的热量比催化剂Ⅰ的多,D 正确。答案选 D。 答案 D 易错点三 不会判断外界条件对 v 正、v 逆的影响 误认为温度、压强等条件的改变对正、逆反应速率影响不一致,如认为升温既然 使化学平衡向吸热方向移动,则对于放热反应,升温时,逆反应速率增大,而正 反应速率减小。其实不然,温度升高,正、逆反应速率都增大,只是吸热反应方 向速率增大程度大;增加压强,v 正、v 逆均增大,对气体系数和大的一方,速率 改变大。 [易错训练 3] (2018·嘉兴第一中学高三)对利用甲烷消除 NO2 污染进行研究, CH4+2NO2 N2+CO2+2H2O。在 1 L 密闭容器中,控制不同温度,分别加 入 0.50 mol CH4 和 1.2 mol NO2,测得 n(CH4)随时间变化的有关实验数据见下 表。 组别 温度 时间/min n/mol 0 10 20 40 50 ① T1 n(CH4) 0.50 0.35 0.25 0.10 0.10 ② T2 n(CH4) 0.50 0.30 0.18 0.15 下列说法正确的是( ) A.组别①中,0~20 min 内,NO2 的降解速率为 0.02 5 mol·L-1·min-1 B.由实验数据可知实验控制的温度 T1<T2 C.40 min 时,表格中 T2 对应的数据为 0.18 D.0~10 min 内,CH4 的降解速率①>② 解析 A.随着反应的进行,反应物的浓度降低,反应速率减小,故组别①中,0~ 20 min 内,NO2 的降解平均速率为 0.025 mol·L-1·min-1,选项 A 错误;B.温度 越高反应速率越大,达平衡所需时间越短,由实验数据可知实验控制的温度 T1查看更多