- 2021-04-15 发布 |
- 37.5 KB |
- 3页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学第一轮复习课件第3讲 化学平衡常数 化学反应进行的方向-热点模型11 “图像、表格类”的审读
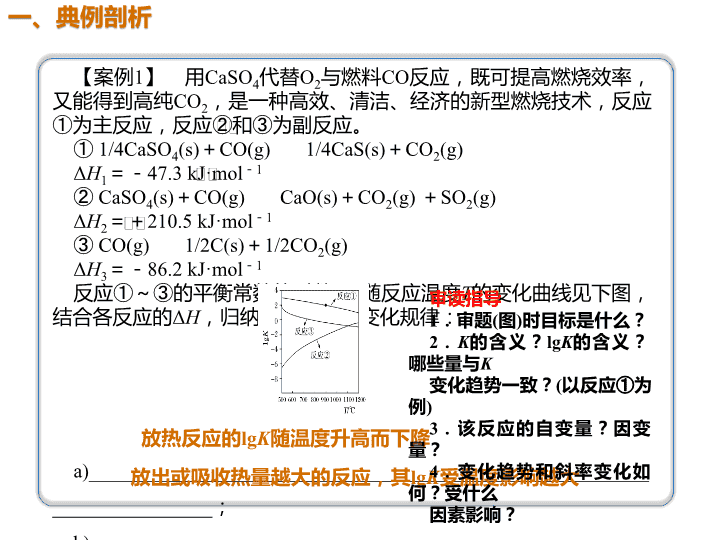
04 【案例1】 用CaSO4代替O2与燃料CO反应,既可提高燃烧效率, 又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应 ①为主反应,反应②和③为副反应。 ① 1/4CaSO4(s)+CO(g) 1/4CaS(s)+CO2(g) ΔH1=-47.3 kJ·mol-1 ② CaSO4(s)+CO(g) CaO(s)+CO2(g) +SO2(g) ΔH2=+210.5 kJ·mol-1 ③ CO(g) 1/2C(s)+1/2CO2(g) ΔH3=-86.2 kJ·mol-1 反应①~③的平衡常数的对数lgK随反应温度T的变化曲线见下图, 结合各反应的ΔH,归纳lgK~T曲线变化规律: a)________________________________________________________ ________________; b)________________________________________________________ ________________。 放热反应的lgK随温度升高而下降 放出或吸收热量越大的反应,其lgK受温度影响越大 审读指导 1.审题(图)时目标是什么? 2.K的含义?lgK的含义? 哪些量与K 变化趋势一致?(以反应①为 例) 3.该反应的自变量?因变 量? 4.变化趋势和斜率变化如 何?受什么 因素影响? 分析方法: 1.提取什么? 审清题,明确目标,并做好标注。 2.怎么提取? 分析变化趋势和斜率变化。 3.答题模板:其他条件不变,随着自变量(横坐标) 变化(增大或减少),XX因变量(纵坐标)逐渐(增大/减 少)。或者就横坐标、自变量分区作答(非单调曲线)。 写规律时的原则:先整体后局部。 分析原因型分析方法: 答题模板:什么因素的改变使什么平衡向什么方向 移动,结果是什么。 作图策略: 分析图表信息,确定横竖坐标,做好“三点一变化”: 起点、终点、转折点和变化趋势。查看更多