河南省商丘市第一高级中学2019-2020高一化学下学期期末考试试卷(Word版附答案)
商丘市第一高级中学2019-2020学年高一下学期期末考试
化 学 试 卷
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Cl-35.5 Br-80
第Ⅰ卷(选择题,共80分)
一、 选择题(共18个题,每小题3分,共计54分)
1.根据原子结构及元素周期律的知识,下列推断正确的是( )
A.同主族元素含氧酸的酸性随核电荷数的增加而减弱
B.核外电子排布相同的微粒化学性质也相同
C.Cl-、S2-、Ca2+、K+半径逐渐减小
D.Cl与Cl得电子能力相同
2.为提纯下列物质(括号内为杂质),所用的除杂试剂和分离方法都正确的是( )
序号
不纯物
除杂试剂
分离方法
A
CH4(C2H4)
酸性KMnO4溶液
洗气
B
苯(Br2)
NaOH溶液
过滤
C
C2H5OH(H2O)
新制生石灰
蒸馏
D
乙酸乙酯(乙酸)
饱和Na2CO3溶液
蒸馏
3.若乙酸分子中的羧基是16O,乙醇分子中的氧都是18O,二者在浓硫酸作用下发生反应,一段时间后,分子中含有18O的物质有( )
A.1种 B.2种 C.3种 D.4种
4.下列金属的冶炼中,通过在高温下加入还原剂来完成的是( )
A.Na B. Fe C. Al D.Ag
5.下列变化中主要属于化学变化的有( )项
①风化 ②皂化 ③酯化 ④煤的气化 ⑤煤的液化 ⑥石油裂化 ⑦苯的硝化 ⑧盐析 ⑨石油分馏 ⑩焰色反应
A.5 B.6 C.7 D.8
6.下列说法正确的是( )
A.糖类、油脂、蛋白质均能发生水解
B.氨基酸均只含有一个羧基和一个氨基
C.植物油能使溴的四氯化碳溶液褪色
D.聚乙烯、油脂、纤维素均为高分子化合物
7.青菜含有维生素C和植物纤维有助于清除人体吸入的粉尘颗粒。已知维生素C的结构如图所示,有关判断不正确的是( )
A.维生素C中含有3种官能团
B.维生素C分子式为C6H8O6
C.维生素C能使酸性高锰酸钾溶液褪色
D.维生素C在碱性溶液中能稳定存在
8.现有两个热化学方程式:下列说法中正确的是( )
A.反应①②中都存在:ΔS>0
B.反应②高温时,可自发进行
C.在通常情况下,①②都能自发进行
D.反应①一定不能自发进行
9.臭氧是理想的烟气脱硝剂,其脱硝反应为2NO2(g)+O3(g) N2O5(g)十O2(g),在T温度下,向2.0 L恒容密闭容器中充入2.0 mol NO2和1.0 mol O3,经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列有关说法正确的是( )
t/s
0
3
6
12
24
n(O2)/mol
0
0.36
0.60
0.80
0.80
A.反应在0~3s内的平均速率v(NO2)=0.24 mol·L-1·s-1
B.24 s后,若保持其他条件不变,降低温度,达到新平衡时测得c(O2)=0.44 mol·L-1, 则反应的ΔH>0
C.在T温度下,起始时向容器中充入1.0 mol NO2、0.5 mol O3和0.50 mol N2O5、0.50 mol O2,反应达到平衡时,压强为起始时的0.88倍
D.在T温度下,起始时向容器中充入2.0 mol N2O5和2.0 mol O2,达到平衡时,N2O5 的转化率大于20%
10.下列各有机物的数目与分子式C4H7ClO2且能与NaHCO3溶液反应生成CO2的有机物的数目(不考虑立体异构)相同的是( )
A. 分子式为C5H10的烯烃 B. 甲苯的一氯代物
C. 相对分子质量为74的一元醇 D. 立方烷()的二硝基取代物
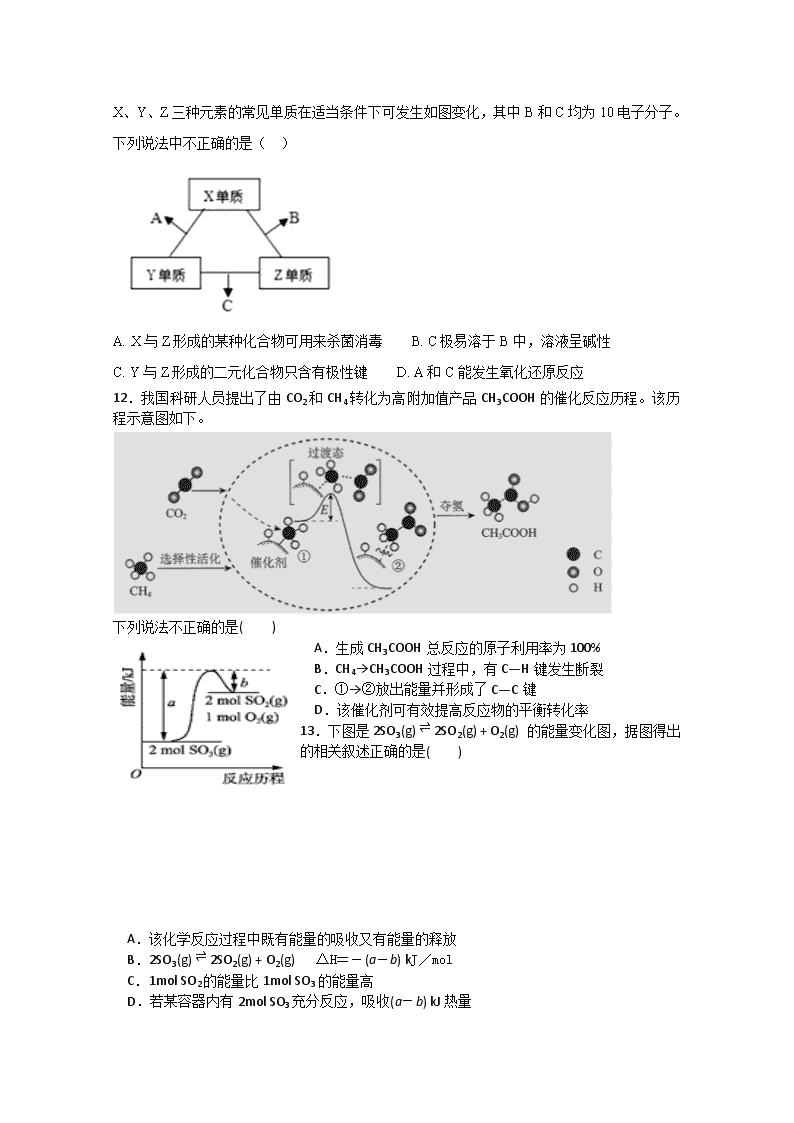
11.有X、Y、Z三种短周期元素,原子半径大小关系为r(Y)>r(X)>r(Z),原子序数之和为16。
X、Y、Z三种元素的常见单质在适当条件下可发生如图变化,其中B和C均为10电子分子。下列说法中不正确的是( )
A. X与Z形成的某种化合物可用来杀菌消毒 B. C极易溶于B中,溶液呈碱性
C. Y与Z形成的二元化合物只含有极性键 D. A和C能发生氧化还原反应
12.我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。
下列说法不正确的是( )
A.生成CH3COOH总反应的原子利用率为100%
B.CH4→CH3COOH过程中,有C―H键发生断裂
C.①→②放出能量并形成了C―C键
D.该催化剂可有效提高反应物的平衡转化率
13.下图是2SO3(g) ⇌ 2SO2(g) + O2(g) 的能量变化图,据图得出的相关叙述正确的是( )
A.该化学反应过程中既有能量的吸收又有能量的释放
B.2SO3(g) ⇌ 2SO2(g) + O2(g) △H=-(a-b) kJ/mol
C.1mol SO2的能量比1mol SO3的能量高
D.若某容器内有2mol SO3充分反应,吸收(a-b) kJ热量
14.短周期元素W、X、Y、Z的原子序数依次增加。m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,r溶液为强电解质溶液,s通常是难溶于水的混合物。上述物质的转化关系如图所示。下列说法正确的是( )
A.原子半径的大小W
X>Y
C.Y的氢化物常温常压下为液态
D.X的最高价氧化物的水化物为强酸
15. 一种气态烷烃和一种气态烯烃的混合物共10g,平均相对分子质量为25。使混合气通过足量溴水,溴水增重8.4g,则混合气中的烃分别是( )
A.甲烷和乙烯 B.甲烷和丙烯
C.乙烷和乙烯 D.乙烷和丙烯
16.海洋约占地球表面积的71%,对其进行开发利用的部分流程如下图所示。下列说法不正确的是( )
A.可用BaCl2溶液除去粗盐中的SO
B.从苦卤中提取Br2的反应的离子方程式为2Br-+Cl2===2Cl-+Br2
C.试剂1可以选用石灰乳
D.工业上,通常电解氯化镁溶液来冶炼金属镁
17.合成导电高分子化合物PPV的反应为:
下列说法正确的是( )
A. PPV 是聚苯乙烯 B.该反应为加聚反应
C. 属于芳香烃
D.1mol最多可与5molH2发生反应
18.一种海水电池的反应原理可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,有关反应的说法正确的是( )
A.反应中MnO2是还原剂
B.电池工作时,海水起导电作用,其中NaCl浓度保持不变
C.Ag为负极,电极反应为Ag-e-+Cl-=AgCl
D.每生成1 mol Na2Mn5Ol0转移1mol电子
第Ⅱ卷(非选择题,共46分)
19.(12分) 工业中很多重要的原料都是来源于石油化工,回答下列问题
(1)A的结构简式为 。
(2)丙烯酸中含氧官能团的名称为 。
(3)①③反应的反应类型分别为______________、 。
(4)写出下列反应方程式
① 反应②的方程式 ;
② 反应④的方程式 ;
③ 丙烯酸 + B 丙烯酸乙酯 。
(5)丙烯酸(CH2 = CH — COOH)的性质可能有( )
① 加成反应 ②取代反应 ③加聚反应 ④中和反应 ⑤氧化反应
A.只有①③ B.只有①③④
C.只有①③④⑤ D.①②③④⑤
(6)丙烯分子中,最多有 个原子共面。
(7)B和C制备乙酸乙酯,原子利用率为 %(保留整数)
(8)与乙酸乙酯互为同分异构体,且能和氢氧化钠溶液反应的结构有 种
20. (10分)设反应①Fe(s)+CO2(g)FeO(s)+CO(g)的平衡常数为K1;
反应②Fe(s)+H2O(g)FeO(s)+H2(g)的平衡常数为K2。
测得在不同温度下,K1、K2值如下:
温度/℃
K1
K2
500
1.00
3.15
700
1.47
2.26
900
2.40
1.60
(1)若500 ℃时进行反应①,CO2的起始浓度为2 mol/L,CO2的转化率为_______________。
(2)900 ℃时进行反应③H2(g)+CO2(g)H2O(g)+CO(g),其平衡常数K3=______________。
(3)反应②的焓变ΔH____________(填“>”、“<”或“=”)0。
(4)700 ℃时反应②达到化学平衡,要使该平衡向正反应方向移动,当其他条件不变时,可采取的措施有 。
A. 缩小容器容积 B.加入更多的水蒸气
C.升高温度至900 ℃ D.使用合适的催化剂
(5)下列图像符合反应①的是________________________。
21.(10分)元素X、Q、Y、Z、M、R均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3:4,M原子的最外层电子数与次外层电子数之比为3:
4;R-、Z+、X+离子半径逐渐减小;化合物XR常温下为气体,Q和Y在周期表中的位置相邻,请回答下列问题:
(1)写出单质R的一种工业用途_______________________。
(2)M和R的最高价氧化物的水化物中酸性最强的是 (用化学式表示)。
(3)下图表示由上述元素中的某两种元素组成的气体分子在一定条件下的密闭容器中充分反应前后的转化关系,写出该转化过程的化学方程式为____________________。
(4)由X、Y、Z、M四种元素组成的一种离子化合物A,已知A,既能与盐酸反应,又能与氢氧化钠溶液反应,还能和氯水反应,写出A与氯水反应的离子方程式___________。
(5)科学家认为存在QX5这种物质,且预测其与水剧烈反应放出气体,所得水溶液呈弱碱性,已知QX5中含有离子键和极性键,写出化合物的电子式_________ 。
22.(14分)某科学小组制备硝基苯的实验装置如下,有关数据列如下表。已知存在的主要副反应有:在温度稍高的情况下会生成间二硝基苯。
实验步骤如下:
取100mL烧杯,用20 mL浓硫酸与足量浓硝酸配制混和酸,将混合酸小心加入B中。把18 mL(15.84 g)苯加入A中。向室温下的苯中逐滴加入混酸,边滴边搅拌,混和均匀。在50~60℃下发生反应,直至反应结束。
将反应液冷却至室温后倒入分液漏斗中,依次用少量水、5%NaOH溶液和水洗涤。分出的产物加入无水CaCl2颗粒,静置片刻,弃去CaCl2,进行蒸馏纯化,收集205~210℃馏分,得到纯硝基苯18g。
回答下列问题:
(1) 图中装置C的作用是 。
(2) 制备硝基苯的化学方程式 。
(3) 叙述配制混合酸操作: 。
(4) 为了使反应在50℃~60℃下进行,常用的方法是 。反应结束并冷却至室温后A中液体就是粗硝基苯,粗硝基苯呈黄色的原因是 (用化学方程式说明),除去该有色物质选择的试剂是 ,分离提纯的方法为 ,涉及的离子方程式为 。
(5)在洗涤操作中,第二次水洗的作用是 。
(6)在蒸馏纯化过程中,因硝基苯的沸点高于140℃,应选用空气冷凝管,不选用水直形冷凝管的原因是 。
(7)本实验所得到的硝基苯产率是______________________。
化学参考答案
一、选择题(每题3分,共54分)
1-5:DCCBC
6-10:CDDCA
11-15:CDACA
16-18:DDC
二、非选择题(46分)
19.(12分,最后一问2分,其余1分)
(1)CH2 = CH2 (2) 羧基 (3) 取代反应、 氧化反应
(4)CH2 = CH2 + H2O ——CH3CH2OH
CH2= CH—COOH + CH3CH2OH CH2 = CH—COOC2H5 + H2O
(5) D (6) 7 (7)83 (8)5
20.(10分,每空2分)
(1)50% (2)1.50 (3)< (4)B (5)A
21.(10分)(1)制漂白粉,制漂白液,自来水消毒等合理答案 (2分)
(2)HClO4 (2分)
(3)2SO2+O2 2SO3 (不打可逆符号不给分)(2分)
(4) HSO3-+ H2O + Cl2=SO42-+ 2Cl-+3H+ (2分)
(5) (2分)
22.(14分)
(1)冷凝回流 (1分)
(2) (2分)
(3)略(2分)(4)水浴加热(1分) , 4HNO3=4NO2+O2+2H2O(1分), 氢氧化钠溶液
(1分),分液(1分),NO2+2OH-=NO3-+NO2-+H2O(1分)
(5)洗去残留的NaOH及生成的钠盐 (1分)
(6)防止直形冷凝管通水冷却导致玻璃温差大而炸裂(或水冷却效果差;答案合理即可给分) (1分)
(7)72% (2分)