- 2021-04-15 发布 |
- 37.5 KB |
- 11页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
陕西省西安中学2019-2020学年高二上学期期中考试化学试卷
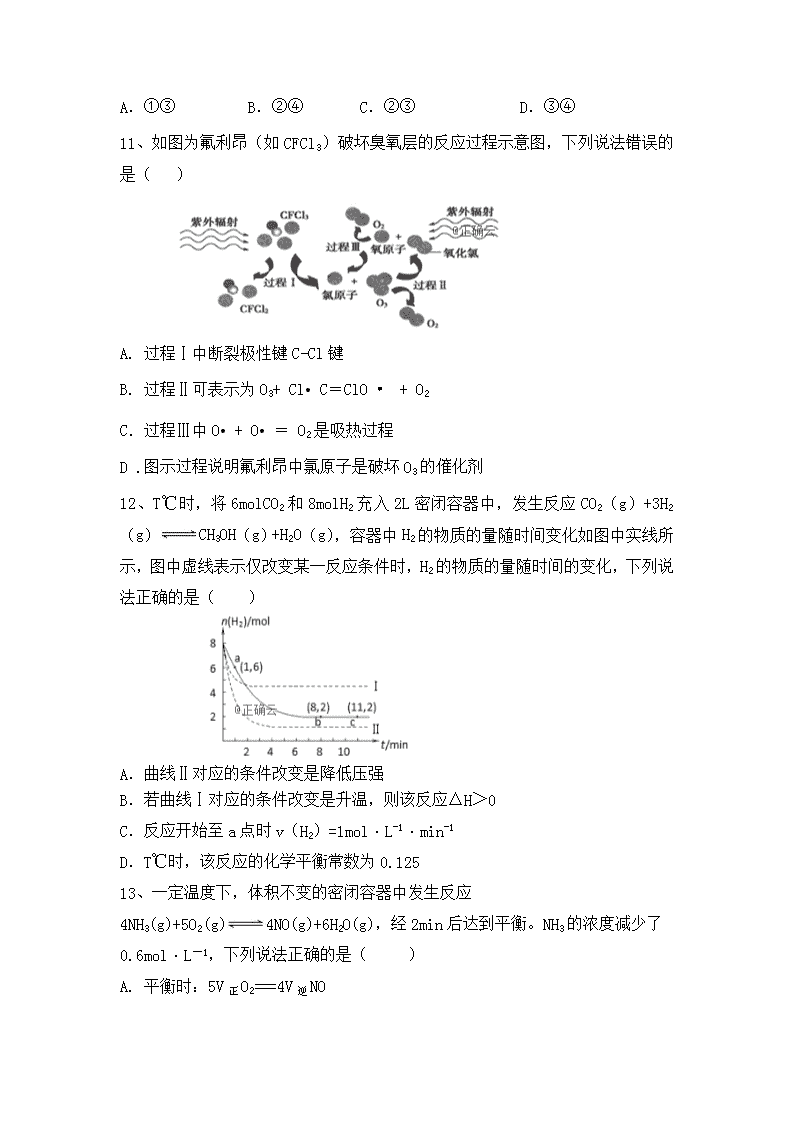
高二化学试题 可能用到的相对原子质量:H-1 C-12 O-16 S-32 N-14 Fe-56 Cu-64 Zn-65 一、选择题(每小题2分,共48分,每小题只有一个选项符合答案) 1、某化学反应其ΔH =-125 kJ/mol,∆S = -81 J/(mol·K),则此反应在下列哪种情况下可自发进行 ( ) A.在任何温度下都能自发进行 B.在任何温度下都不能自发进行 C.仅在高温下自发进行 D.仅在低温下自发进行 2、下列说法正确的是( ) A.电解质溶液的浓度越大,其导电性能一定越强 B.强酸和强碱一定是强电解质,不论其水溶液浓度大小,都能完全电离 C.共价化合物不一定都是强电解质 D.多元酸、多元碱的导电性一定比一元酸、一元碱的导电性强 3、 常温条件下,下列各组离子在相应的条件下可能大量共存的是( ) A.能使pH试纸变红的溶液中:CO32-、K+、Cl-、Na+ B.由水电离产生的c(OH-)=1×10-10 mol·L-1的溶液中:NO3-、Mg2+、Na+、SO42- C.在c(OH-)/c(H+)=1×1012的溶液中:NH4+、Fe3+、Cl-、NO3- D.Kw/C(H+)=10-10 mol·L-1的溶液中:Na+、HCO3-、Cl-、K+ 4、已知:2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ/mol;CO(g)+O2(g)===CO2(g)△H =-282.9 kJ/mol。某H2和CO的混合气体完全燃烧时放出113.74 kJ热量,同时生成3.6 g液态水,则原混合气体中的H2和CO的物质的量之比为( ) A.2∶1 B.1∶2 C.1∶1 D.2∶3 5、 下列事实能用化学平衡移动原理来解释的是( ) A. 加入催化剂,使N2和H2在一定条件下转化为NH3 B. 将FeS2矿石粉碎更有利于焙烧制备SO2气体 C. 对于反应2HI(g)H2(g)+I2(g),增大平衡体系的压强(压缩体积),可使体系颜色变深 D. 用排饱和食盐水的方法收集氯气 6.在25℃时向VmLpH=m的HNO3中,滴加pH=n的KOH溶液10 V mL时,溶液中NO3- 物质的量恰好等于加入的K+的物质的量 ,则m+n的值为( ) A.13 B.14 C.15 D.无法确定 7、下列说法正确的有( ) ①活化分子间的碰撞不一定能发生化学反应 ②普通分子间的碰撞有时也能发生化学反应 ③增大反应物的浓度,可增大单位体积内活化分子数,从而使有效碰撞次数增多 ④有气体参加的化学反应,若增大压强(缩小容器体积),可增大活化分子百分数,从而使速率加快 ⑤化学反应的实质是旧化学键断裂和新化学键形成的过程 ⑥催化剂能增大活化分子百分数,从而加快化学反应速率 A. 1个 B. 2个 C. 3个 D. 4个 8、某反应过程能量变化如图所示,下列说法正确的是( ) A. 反应过程a有催化剂参与 B. 该反应为放热反应,热效应等于ΔH C.改变催化剂,不能改变该反应的活化能 D.有催化剂条件下,反应的活化能等于E1+E2 9、利用反应:2NO(g)+2CO(g) 2CO2(g)+N2(g) △H=- 746.8kJ·mol-1,可净化汽车尾气,如果要同时提高该反应的速率和NO的转化率,采取的措施是( ) A.降低温度 B.增大压强 C.升高温度同时充入N2 D.及时将CO2和N2从反应体系中移 10、一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的( ) ①NaOH固体 ②KNO3溶液 ③水 ④CH3COONa固体 A.①③ B.②④ C.②③ D.③④ 11、如图为氟利昂(如CFCl3)破坏臭氧层的反应过程示意图,下列说法错误的是( ) A. 过程Ⅰ中断裂极性键C-Cl键 B. 过程Ⅱ可表示为O3+ Cl• C=ClO • + O2 C.过程Ⅲ中O• + O• = O2是吸热过程 D .图示过程说明氟利昂中氯原子是破坏O3的催化剂 12、T℃时,将6molCO2和8molH2充入2L密闭容器中,发生反应CO2(g)+3H2(g)CH3OH(g)+H2O(g),容器中H2的物质的量随时间变化如图中实线所示,图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化,下列说法正确的是( ) A.曲线Ⅱ对应的条件改变是降低压强 B.若曲线Ⅰ对应的条件改变是升温,则该反应△H>0 C.反应开始至a点时v(H2)=1mol·L-1·min-1 D.T℃时,该反应的化学平衡常数为0.125 13、一定温度下,体积不变的密闭容器中发生反应4NH3(g)+5O2(g)4NO(g)+6H2O(g),经2min后达到平衡。NH3的浓度减少了0.6mol·L-1,下列说法正确的是( ) A. 平衡时:5V正O2===4V逆NO B. 2min末的反应速率,用NO表示是0.3 mol·L-1·min-1 A. 由混合气体的密度不再改变可判定达到平衡 B. 由混合气体的压强不再改变可判定达到平衡 14、25 ℃时,用蒸馏水稀释1 mol/L醋酸,下列各项始终保持增大趋势的是( ) A. B. C. D.c(H+)·c(CH3COO-) 15、在一定条件下发生反应:2A(g)+2B(g)xC(g)+2D(g),在2L密闭容器中,把4molA和2molB混合,2min后达到平衡时生成1.2molC,又测得反应速率VD=0.2mol/(L·min),下列说法正确的是( ) A.A和B的转化率均是20% B.x = 3 C.平衡时A的物质的量为2.8mol D.平衡时气体压强比原来减小 16、25 ℃时,下列两溶液混合后所得溶液pH<7的是( ) A.pH=3的盐酸和pH=11的氨水等体积混合 B.pH=3的醋酸和pH=11的氢氧化钡溶液等体积混合 C.pH=3的盐酸和pH=11的氢氧化钡溶液等体积混合 D.pH=3的硫酸和pH=11的氨水等体积混合 17、实验室用标准盐酸溶液测定某NaOH溶液的浓度,用甲基橙作指示剂,下列操作中可能使测定结果偏低的是( ) A.酸式滴定管在装酸液前未用标准盐酸溶液润洗2~3次 B.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失 C.锥形瓶内溶液颜色变化由黄色变橙色,立即记下滴定管液面所在刻度 D.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次 18、一定条件下合成乙烯:6H2(g)+2CO2(g)CH2=CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法正确的是 ( ) A. M点的正反应速率V正大于N点的逆反应速率V逆 B. 若投料比n(H2):n(CO2)=4:1,则图中M点乙烯的体积分数约为5.88% C. 250℃,催化剂对CO2转化率影响最大 D. 当温度高于250℃,升高温度,平衡逆向移动导致催化剂的催化效率降低 19、某温度下,向2L恒容密闭容器中充人1molA和1molB,发生反应A(g)+B(g)C(g) 经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是( ) t/s 0 5 15 25 35 n(A)/mol 1.0 0.85 0.81 O.80 0.80 A.反应在前5s的平均速率V(A)=0.03mol/(L·s) B.保持其他条件不变,升高温度,平衡时c(A)=0.41mol·L-1,则反应的△H>0 C.相同温度下,起始时向容器中充入2.0molC,达到平衡时,C的分解率大于80% D.相同温度下,起始时向容器中充入0.2molA.0.2molB和1.0molC反应达到平衡前反应速率V(正)查看更多